角運動量の合成
量子力学において角運動量の合成(かくうんどうりょうのごうせい)とは、別々の角運動量の固有状態から全角運動量の固有状態を作ることである。
例えば1つの粒子の場合、軌道角運動量とスピン角運動量との間にはスピン軌道相互作用とよばれる相互作用が存在し、完全な物理的描像はスピン-軌道の合成を含まなければならない。
また、ある決まった角運動量を持つ2つの荷電粒子の場合、クーロン力によって相互作用をし、2つの1粒子角運動量で全角運動量を合成することは2粒子シュレディンガー方程式を解くにあたって有効である。
どちらの場合でも、別々の角運動量はもはや保存量ではなく、2つの角運動量を合成したものが保存量となる。
原子における角運動量の合成は、原子スペクトルにおいて重要である。電子スピンの角運動量の合成は、量子化学において重要である。シェルモデルにおいても、角運動量の合成はいたるところで現れる。
一般論[編集]
角運動量保存の法則は、系に外力が働かない場合は系の全角運動量は一定の大きさと方向を持つというものである。角運動量は以下の2つの場合、保存量(時間に依存しない量)となる。
どちらの場合でも角運動量演算子は系のハミルトニアンと交換する。不確定性原理より、これは角運動量とエネルギー(ハミルトニアンの固有値)が同時にある定まった値を持ちうることを意味する。
1. の例として、原子中の電子が核からのクーロン場しか受けないようなモデルを考える。一般に電子-電子間相互作用やその他の小さな相互作用(スピン-軌道相互作用など)を無視した場合、それぞれの電子の軌道角運動量 lは全ハミルトニアンと交換する。このモデルでは、原子のハミルトニアンは電子の運動エネルギーと球対称な電子-核相互作用の合計だけで表せる。よってそれぞれの電子の角運動量l(1) はこのハミルトニアンと交換する。つまり、l(1) は原子をこのようなモデルで近似すると保存量になる。
2. の例として、自由場空間を運動する剛体回転子がある。剛体回転子はある決まった、時間に依存しない角運動量を持つ。
このような2つの場合は古典力学に由来している。3つめの保存する角運動量として、スピンと関連するような、古典力学では記述できないものがある。しかし、角運動量の合成はスピンにおいても適応できる。
一般に角運動量保存の法則は回転群(SO(3)やSU(2)で表現される)を示唆しており、球対称は角運動量の保存を示唆している。もし2つ以上の物理系が保存される角運動量を持つ場合、それらを合成して合成系の全角運動量、つまり全系の保存量を作ることが有効である。それぞれの系の角運動量の固有状態から保存する全角運動量の固有状態を構築することを角運動量の合成と呼ぶ。
角運動量の合成の適用は、相互作用がなく角運動量が保存するような系どうしの間に相互作用があるような場合に有用である。系間の相互作用によって系の球対称性は壊されるが、全系の角運動量は保存量のままである。このことはシュレディンガー方程式を解くにあたって有用となる。
例として、ヘリウム原子内の1,2という電子を考える。もし電子-電子間相互作用が無く、電子-核相互作用のみがある場合、2つの電子は互いに独立に核のまわりを回転し、エネルギーは変わらない。つまり、演算子l(1)もl(2)も保存する。しかし電子間距離d (1, 2)に依存する電子-電子相互作用が生まれると、2つの電子の同時で等しい回転だけがd (1, 2)についての不変量を残す。そのような場合l(1) も l(2)も一般的には保存量ではなく、L = l(1) + l(2)が保存量となる。与えられたl(1) と l(2)の固有状態について、L(保存量)の固有状態を構築することを電子1と2の角運動量の合成と言う。
量子力学において、1つの量子系を記述する異なるヒルベルト空間の角運動量でも合成することができる。例えば、スピンと軌道角運動量の合成などがある。
このことを少し言い方を変えると、それぞれの系を記述する量子状態のテンソル積から成る基底で、構成系(2つの水素原子や2つの電子のようなサブユニットからなるものなど)の量子状態を拡張したことになる。系の状態は、角運動量演算子(とその任意のz 軸成分)の固有状態として選ばれていると仮定する。よって系は量子数l , m の組によって正確に記述される(角運動量を参照)。系の間に相互作用がある場合、全ハミルトニアンは系のみに作用する角運動量演算子とは交換しない項を含んでいる。しかし、それらの項は全角運動量演算子とは交換する。ハミルトニアン内の交換しない相互作用の項は、角運動量の合成を必要とするため、角運動量カップリング項と呼ぶことがある。
スピンと軌道の合成[編集]
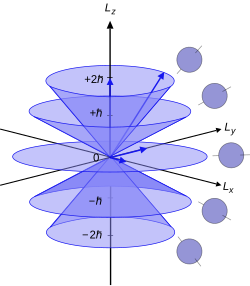

原子やさらに小さい粒子は量子力学で記述される。それぞれの粒子はスピンと呼ばれる角運動量を持ち、(たとえば電子や原子などの)特定の構造は量子数の組で記述される。粒子の集まりも角運動量と対応する量子数を持ち、異なる環境では、それぞれの粒子の角運動量は異なった方法で合成され、全体の角運動量を作る。角運動量の合成は、亜原子粒子が互いに相互作用する幾つかの方法を含んだカテゴリーである。
原子物理学では、スピンと軌道の合成は「スピン対形成」として知られており、粒子のスピンと軌道運動の弱い磁気的な相互作用や合成を表す(電子におけるスピンと原子核の周りの運動など)。この効果の1つに、原子の初期状態のエネルギーを分裂させることがある。平行スピンと反平行スピンはこの効果がなければ同じエネルギーを持つ。この相互作用は原子構造の多くの部分に関与している。
LS結合[編集]
軽い原子(一般的にZ < 30)では、電子スピンsi は互いに相互作用しているので、結合して全スピン角運動量Sを作る。同じことが軌道角運動量ℓi でも起こり、全軌道角運動量Lを作る。量子数LとSの間の相互作用は「ラッセル–サンダーズ結合」または「LS結合」と呼ばれる。この場合、SとLは結合して全角運動量Jを作る。
ここで
LS結合では、、を指定する以下の量子数J, Mもよい量子数となる。
- 、
このようなL, S, J で指定される状態をラッセル–サンダーズ状態という。スピン軌道相互作用まで考えれば、L とS は良い量子数ではなく、J とM だけが良い量子数となる。この場合1つのエネルギー準位は、同じJ、Mを持つラッセル–サンダーズ状態の線形結合で表される。そこで原子のエネルギー準位はしばしば最も寄与の大きいラッセル–サンダーズ状態を使って2S+1LJ のように表記して区別される。
LS結合は外磁場が弱い場合、良い近似を与える。強い磁場では、2つの角運動量はデカップルすることでエネルギー準位における異なる分裂パターンを引き起こし(パッシェン-バック効果)、LS結合項を小さくする。
他のLS結合の適応例については項記号を参照。
jj結合[編集]
重い原子の場合、上記とは状況が異なる。原子核の電荷がより大きい原子では、スピン軌道相互作用がスピン-スピン相互作用や軌道-軌道相互作用と同程度かそれ以上に大きくなることがある。この場合、それぞれの軌道角運動量ℓi は、対応する個々のスピン角運動量si と結合し、個々の全角運動量ji を作る傾向がある。ji は足し合わされて全角運動量Jを作る。
この方法は相互作用の計算を容易にし、「jjカップリング」と呼ばれる。
スピン-スピン結合[編集]
スピン-スピン結合は、異なる粒子のスピン角運動量の合成である。核スピン対間の結合は核磁気共鳴(NMR)分光法において分子の構造についての詳細な情報を与えるので重要である。核スピンと電子スピンの間のスピン-スピン結合 は原子スペクトルにおける超微細構造に関与する。
項記号[編集]
項記号は原子の状態とスペクトル遷移を表現するために使われ、上記の角運動量の合成から作られる。原子の状態が項記号で記述された場合の、許容遷移はどの遷移が角運動量を保存するかを考えることによって、選択律から判別できる。フォトンはスピン1を持ち、フォトンの放出や吸収を伴う遷移がある場合、原子は角運動量を保存するように状態を変える必要がある。項記号の選択律は、 ΔS = 0, ΔL = 0, ±1, Δl = ± 1, ΔJ = 0, ±1
項記号による表現は、原子のリュードベリ状態とそのエネルギー準位に関連する「項系列」に由来する。リュードベリ系列式において、水素様原子から放射された光の振動数や波数は、遷移の2項間の差に比例している。初期の原子スペクトルで知られる系列は、それぞれ「するどい(sharp)」、「主要である(principal)」、「広がっている(diffuse)」、「土台になっている(fundamental)」のような特徴から、原子の軌道角運動量状態を表すのに記号S、P、D、Fが用いられるようになった。[1]
相対論の効果[編集]
非常に重い原子では、電子エネルギー準位の相対論的なシフトがスピン軌道相互作用の効果をさらに際立たせる。例えばウランの分子軌道ダイアグラムは、他の原子との相互作用を考える場合は相対論的な記号を組み込まなければならない。
原子核カップリング[編集]
原子核ではスピン軌道相互作用は、電子の場合よりもはるかに大きく、シェルモデルに組み込まれなければならない。さらに原子-電子項記号の場合とは異なり、最低エネルギー状態はL − Sではなくl + sである。軌道角運動量lが0より大きいすべての原子核の準位は、シェルモデルにおいて分裂しl + s と l − sによって指定される状態を作る。中心力クーロンポテンシャルではなく平均ポテンシャルを仮定しているシェルモデルの性質から、l + sとl − sの状態をとる原子核は縮退している。例えば、2p3/2は4つの同じエネルギーを持った原子核を含む。より高いエネルギーは、2つの等エネルギー原子核を含む2p1/2である。
出典[編集]
- ^ Herzberg, Gerhard (1945), Atomic Spectra and Atomic Structure, New York: Dover, pp. 54–5, ISBN 0-486-60115-3








