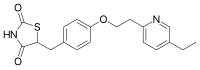
ピオグリタゾン
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | アクトス |
| Drugs.com | monograph |
| MedlinePlus | a699016 |
| ライセンス | EMA:リンク、US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 | |
| 投与経路 | oral |
| 薬物動態データ | |
| 血漿タンパク結合 | >99% |
| 代謝 | liver (CYP2C8) |
| 半減期 | 3–7 時間 |
| 排泄 | 胆汁排泄型 |
| 識別 | |
| CAS番号 |
111025-46-8 |
| ATCコード | A10BG03 (WHO) |
| PubChem | CID: 4829 |
| IUPHAR/BPS | 2694 |
| DrugBank |
DB01132 |
| ChemSpider |
4663 |
| UNII |
X4OV71U42S |
| KEGG |
D08378 |
| ChEBI |
CHEBI:8228 |
| ChEMBL |
CHEMBL595 |
| 化学的データ | |
| 化学式 | C19H20N2O3S |
| 分子量 | 356.44 g/mol |
| |
ピオグリタゾン(Pioglitazone)は、チアゾリジン系の経口血糖降下薬である。商品名アクトスで販売される。日本では、1999年9月22日に武田薬品工業が承認を取得している[1]:1。2009年12月21日付けで再審査結果が通知され、効能・効果および用法・用量に変更なく了解された。2012年12月現在は後発品も多数販売されている。
薬理
[編集]ピオグリタゾンは核内転写因子であるPPARγのアゴニストとして作用し、TNF-αの発現を抑制することでインスリン抵抗性を改善する。また、インスリン受容体に作用してインスリン抵抗性を軽減し、肝における糖産生を抑制し、末梢組織における糖利用を高め血糖を低下させる。この作用は、インスリン抵抗性の主因である細胞内インスリン情報伝達機構を正常化することによると推測される[2]。
また、PPARγはミクログリアの状態に影響を与えるため、うつ病や認知症の治療や予防に有益な選択肢となりうる[3]。
効能・効果
[編集]研究事例
[編集]認知症の発症を遅らせるための大規模な第3相臨床試験が実施中であり、2021年ごろに試験が終了する見込みである[4][5]。
非アルコール性脂肪性肝炎にも有効であるとの研究もある[6]。
禁忌
[編集]- 心不全の患者および心不全の既往歴のある患者[ 動物試験において循環血漿量の増加に伴う代償性の変化と考えられる心重量の増加がみられており、また、臨床的にも心不全を増悪あるいは発症したとの報告がある。]
- 重症ケトーシス、糖尿病性昏睡または前昏睡、1型糖尿病の患者[ 輸液、インスリンによる速やかな高血糖の是正が必須となる。]
- 重篤な肝機能障害のある患者[ 本剤は主に肝臓で代謝されるため、蓄積するおそれがある。]
- 重篤な腎機能障害のある患者
- 重症感染症、手術前後、重篤な外傷のある患者 [ インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
- 製剤成分に対し過敏症の既往歴のある患者
- 妊婦または妊娠している可能性のある婦人
副作用
[編集]重大な副作用として、添付文書に 心不全、浮腫(8.2%)、肝機能障害・黄疸(0.1%未満)、低血糖症状(5%未満)、横紋筋融解症、間質性肺炎、胃潰瘍 が記載されている。
膀胱癌、膵臓癌、前立腺癌などが統計的有意にリスク増加することが分かっている。アメリカ食品医薬品局の有害事象報告システムでは、ピオグリタゾンの報告の2.63%が膀胱癌であった[7]。また、それは他の医薬品における膀胱癌の報告よりも格段に多かった[8]。
AERSで最も多く報告された有害事象は血糖の増加であった[7]。疲労や無力症の報告も多かった[7]。
膀胱癌
[編集]米国での10年間の疫学研究の中間報告が武田薬品工業から示された。それはピオグリタゾンと膀胱癌の関係を示唆するものであった(長期間の使用による上昇傾向)[9][10]pp1 2(2)。又相次いで複数の疫学研究の結果が示されたが、膀胱癌リスクの上昇があるとしたものとないとしたものがあった[10]。これによりFDAは2010年9月に安全性についてのレビューを指示した[11]。しかし、同疫学調査の最終結果では、膀胱癌リスクの上昇が認められないとされた[12]。なお、リスク上昇の有無について相反する結果が存在する事については、「使用経験あり群と無し群を単純に比較すると、割付バイアスが生じ易い為」と説明されている[13]。
2015年7月、武田薬品の関連企業が出資した膀胱癌に関する欧州でのコホート研究の結果が発表された。最長フォローアップ10年間の観察の結果、膀胱癌のハザード比は 1.06 (95%信頼区間 0.89-1.26) であった。前立腺癌のハザード比は 1.13 (95%信頼区間 1.02-1.26) 、膵臓癌のハザード比は 1.41 (95%信頼区間 1.16-1.71) であった。前立腺癌、特に膵臓癌のリスク増加と関連が示された[14]。
2016年3月、大規模な人口ベースのコホート研究結果が公表された。膀胱癌の発生率は、ピオグリタゾンが121.0人/10万人/年、他の糖尿病薬が88.9人/10万人/年、ハザード比 1.63(95%信頼区間 1.22-2.19)であった。この研究結果は、ピオグリタゾンが膀胱癌のリスク増加と関連していることを示した[15]。この報告は、割付バイアスでは説明できない統計的に有意なリスク増加である。
米国での訴訟
[編集]アクトス関連訴訟は、アメリカ連邦裁判所で2,700件以上起こされている[16]。
2014年2月には、ピオグリタゾンによる癌発症のリスクを隠していたことが発覚したことで武田薬品工業とイーライ・リリーが提訴された[17]。同年9月にアメリカ連邦裁判所は懲罰的損害賠償として総額90億ドルの支払いを命じた[18]。しかし、金額が法外であると考えた裁判官によって3,680万ドルに減額された[19][20]。
2014年4月には、米国の男性が武田薬品工業を相手取って起こしていた訴訟で、ルイジアナ州ラファイエットの連邦地裁の陪審は4月7日、武田薬品工業に60億ドル(約6,200億円)の懲罰的損害賠償の支払い義務があると認定した。
2015年4月には、ピオグリタゾンが膀胱癌の発症に関与したと主張する約9,000人に対し、23億7,000万ドル支払うことに武田薬品は同意した[21] 。
武田薬品工業は日米欧各国の規制当局に対して、市販後に課された10年間の疫学研究(武田薬品工業関連企業の出資研究)の結果を示し、膀胱癌発生リスクの統計学的有意な増加は見られなかったと報告した[12]。また、米ネバダ州での同様の訴訟について、裁判所陪審は原告の膀胱癌はピオグリタゾンによるものではないとの評決を下している[20]。しかし、2016年4月発表の大規模な疫学的調査では、割り付けバイアスでは説明が付かない膀胱癌発症リスクの統計学的有意な増加が示された[15]。日本では懲罰的損害賠償の制度が存在しないことから、個々の症例で因果関係を証明しなければならない。
出典
[編集]- ^ “アクトス錠15/アクトス錠30 インタビューフォーム” (PDF) (2015年11月). 2016年6月27日閲覧。
- ^ “アクトス錠15/アクトス錠30 添付文書” (2016年10月). 2016年11月5日閲覧。
- ^ Zhao Q (2016-10-4). “The antidepressant-like effects of pioglitazone in a chronic mild stress mouse model are associated with PPARγ-mediated alteration of microglial activation phenotypes.”. en:Journal of Neuroinflammation. 13 (1): 259. doi:10.1186/s12974-016-0728-y. PMC 5051050. PMID 27716270.
- ^ TOMMORROW試験の患者登録完了について - 武田薬品工業株式会社 2016年10月17日閲覧
- ^ AD-4833/TOMM40_303 Extension Study of the Safety and Efficacy of Pioglitazone to Slow Cognitive Decline in Participants With Mild Cognitive Impairment Due to Alzheimer Disease - ClinicalTrials.gov 2016年10月17日閲覧
- ^ Belfort, R; Harrison, SA; Brown, K; Darland, C; Finch, J; Hardies, J; Balas, B; Gastaldelli, A et al. (November 2006). “A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis”. N. Engl. J. Med. 355 (22): 2297–307. doi:10.1056/NEJMoa060326. PMID 17135584.
- ^ a b c Pioglitazone Hydrochloride - DrugInformer 2016年10月17日
- ^ Bladder Cancer - DrugInformer 2016年10月17日
- ^ “ピオグリタゾン塩酸塩と膀胱癌について” (2011年6月). 2014年11月4日閲覧。
- ^ a b “ピオグリタゾン塩酸塩含有製剤の安全対策について” (2011年6月23日). 2014年11月4日閲覧。
- ^ Peck, Peggy (2010年9月17日). “FDA Says It Will Review Pioglitazone Safety”. MedPage Today 2010年9月18日閲覧。
- ^ a b “ピオグリタゾン含有製剤に関する市販後に課された疫学研究の完了と各国規制当局へのデータ提出について” (2014年8月29日). 2014年10月29日閲覧。
- ^ “ピオグリタゾンに有意な膀胱癌リスク上昇なし” (2015年1月31日). 2015年1月31日閲覧。
- ^ Lewis JD, Habel LA, Quesenberry CP, Strom BL, Peng T, Hedderson MM, Ehrlich SF, Mamtani R, Bilker W, Vaughn DJ, Nessel L, Van Den Eeden SK, Ferrara A (2015-7-21). “Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes”. en:JAMA 314 (3): 265-77. doi:10.1001/jama.2015.7996. PMID 26197187.
- ^ a b Tuccori M, Filion KB, Yin H, Yu OH, Platt RW, Azoulay L (2016-3-30). “Pioglitazone use and risk of bladder cancer: population based cohort study”. en:British Medical Journal (BMJ) 352: i1541. doi:10.1136/bmj.i1541. PMC 4816602. PMID 27029385.
- ^ 武田薬に6200億円の賠償金-糖尿病薬「アクトス」で米陪審 (2014年4月9日) ブルームバーグ
- ^ Takeda, Lilly Jury Awards $9 Billion Over Actos Risks (2014-4-9) ブルームバーグ (企業)
- ^ “武田「アクトス」にぼうこうがん責任なし-ネバダ州地裁陪審” (2014年5月22日). 2014年10月29日閲覧。
- ^ Japan's Takeda Agrees To $2.4B Settlement In Diabetes Drug Actos Lawsuit Over Cancer Risk Allegations (2015-4-29) en:IBT Media
- ^ a b 武田薬品のアクトス訴訟、米裁判所が賠償金を大幅減額, (2014-10-27) 2014年10月29日閲覧。
- ^ Takeda Agrees to Pay $2.4 Billion to Settle Suits Over Cancer Risk of Actos (2015-4-28) en:The New York Times Company
