ヒトパピローマウイルス
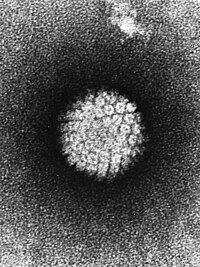
ヒトパピローマウイルス(human papillomavirus:HPV)は、パピローマウイルス科に属するウイルスの一つ。ヒト乳頭腫ウイルス(ヒトにゅうとうしゅウイルス)とも言われる。パピローマまたは乳頭腫と呼ばれる疣を形成することから名付けられた。百数十種類以上の型があり、型によって、手足・顔などにできるイボ、陰部にできる性感染症の尖圭コンジローマ、また子宮頚癌に関りがある。
通常は様々な免疫が応答し体内から排除される[1]。発がん性のリスクが高いといわれるHPV16型や18型でも、出生時に感染がみられ[2][3]、日本の5歳でも、口腔から16型が1/3の子供から検出されている[4]。
感染の多い型のウイルスに対してはヒトパピローマウイルスワクチン(HPVワクチン)が開発されている。
性状[編集]
エンベロープを持たない環状構造の二本鎖DNAウイルス。全世界的に古くから存在していた[要出典]。2016年現在180以上のHPVの遺伝子型に分類されており[5]、生殖器粘膜に感染する40以上の型が知られており、そのうち子宮頸癌の発症に関わる高リスク型HPVとして少なくとも15の型が知られていて、なかでもHPV16は全世界の子宮頸癌の約50%から検出されている[6]。正20面体のカプシドで覆われており、遺伝子サイズは種類により異なるがだいたい約8,000塩基ほどで、8から9のオープンリーディングフレーム(ORF:蛋白をコードしていると推定される遺伝子。しかしその遺伝子産物は同定されていない)を含んでいる。欧米の子宮頸癌でよく発見される16型HPVの場合、初期遺伝子 (E1,E2,E4,E5,E6,E7) と後期遺伝子(L1とL2)というORFを持っている。その中で特にE6とE7が発癌に関与していると考えられている。
E6はがん抑制遺伝子であるp53と結合し分解することで発癌に寄与している。E6はそれ以外にもhTERTの再活性化やPDZドメインを持つたんぱく質を分解することで発癌に寄与している。E7はp53と同様がん抑制遺伝子であるpRbと結合、分解・不活化することでpRbと結合している転写因子であるE2Fを遊離し活性化することで発がんに寄与している。それ以外にもE7はcdk阻害因子であるp21、p27と相互作用することで発癌に寄与している。

それ以外のウイルスがコードするタンパク質ではE1はDNAヘリカーゼ活性を有し、E2と結合することでウイルスゲノムの複製に関与している。E2はE1と同様ウイルスゲノムの複製に関与するが、ウイルス遺伝子の発現調節に関わるLCR (Long Control Region) 上に結合ドメインがあり、初期遺伝子の発現調節(特にE6、E7)に関わっている。E4はサイトケラチンのネットワーク崩壊、E5はEGFRの活性化などが報告されているが、これらのウイルスタンパクの明確な機能は明らかにされていない。L1とL2はカプシドタンパクでL1のみでウイルス様粒子を形成できることが知られている。後半に記述しているGardacilやCervarixなどはいくつかの型のL1をもとに作製したワクチンである。L2はキャプシド形成に補助的に働いていることが知られている。
通常、ウイルスは自己の複製を促すため感染細胞の増殖能を上げるために分化を抑制することが多いが、HPVのゲノム複製は分化依存的に行われる。そのため、単層培養系ではウイルスのライフサイクルを再現することが出来ず、純培養が不可能なウイルスである。
種類[編集]
HPVは2016年現在、180種類以上存在が確認され、発見順に番号がつけられている。
感染部位による分類[編集]
- 上皮型
- HPV1、5、8、14、20、21、25、47型
- 粘膜型
- HPV6、11、16、18、31、33、35、39、41、45、51、52、56、58、59、68、70型
発癌性による分類[編集]
日本性感染症学会の『性感染症 診断・治療 ガイドライン 2016』[5]による分類では、
- 低リスク群
- 手足に発症する尋常性疣贅(イボ)
- HPV2、27、57型など
- 高リスク群
- 子宮頸癌や外陰癌の発症要因の一つと考えられている
- HPV16、18型
- HPV31、33、35、39、45、51、52、56、58、59、68、73、82型など
- 膀胱癌や咽頭癌の他、外陰癌や肛門癌との関連性も近年指摘されている
HPV検査における分類[編集]
子宮頸管部から採取した細胞から抽出したDNAを使用するHPV核酸キット(体外診断用医薬品)が、各社から発売されている。細胞診でBethesda systemのASC-US以上(日母分類のClassIIIa以上に相当)と判定された患者に適用される。子宮頸がんの高リスク型HPV(high risk human papillomavirus; hrHPV)は、HPV16、18、31、33、35、39、45、51、52、56、58、59、68 型(13 種類)。その中でもHPV16、18、31、33、35、(45、)52、58型の感染が子宮頸癌の前駆病変であるCINの進展に有意なリスクであることが報告されており、HPVタイピングが治療方針決定に有用とされる[7]。
- ハイリスクHPV検査
- キットで陽性の判定結果は、子宮頸癌の原因ウイルスである中~高リスク型HPV のいずれかに感染していることを示す。
- HPV DNA「キアゲン」HC II[8]など
- HPVジェノタイプ判定検査
感染方法[編集]
HPVは接触感染で皮膚や粘膜の微小な傷から侵入し、扁平上皮基底部の細胞に感染する。感染HPV は血中に侵入しないのでウイルス血症を起こさない。従って血液感染はない。また感染した細胞を破壊せずウイルス粒子を大量に放出させることもない。このため抗原提示細胞の活性化や抗原認識の過程が回避され、免疫が誘導されにくい[10]。
HPV 感染の70%が1年以内に消失し、約90%が2年以内に消失する。しかし上記のメカニズムによって、一生涯有効な免疫記憶が形成されないため、自然感染後の抗体産生が十分でなく、同じHPV型への感染が何度も起こると考えられている[11]。通常は様々な免疫が応答し体内から排除される[1]。
生殖器へのHPVの感染は、母が感染した乳児の約73%が感染していた[2]。出生時に、HPVの6型、11型、16型、18型はそれぞれ6.4%の乳児が感染しており、生殖器よりも口腔での感染率が2倍であり、感染していた乳児6か月時点で16型は約83%、18型は約20%から検出された[3]。
日本の子供の口腔へのHPVの感染では、3歳の小児では最も多いのは2型、5歳では16型でありこれは35.5%の子供から検出された[4]。別の研究では、成人では16型の口腔からの検出率は1.3%であった[12]。
検査[編集]
皮膚上皮に発生する疣贅の組織中にウイルス粒子の局在を免疫組織学的に証明するために、市販の抗パピローマウイルス抗体(DAKO PATTS社 B-580)がHPVの第1次スクリーニングに多用される時期があった[13]。この抗体は、ウシ乳頭腫ウイルス粒子を界面活性剤で処理し、家兎で免疫し作成した抗体で、全てのタイプのHPVのみならずヒト以外の動物のパピローマウイルスとも反応し、容易に入手であった。2016年ガイドラインでは、in situ hybridizationで病変部細胞からのHPV-DNAの証明、PCR法またはLAMP法によるHPV遺伝子型を決定する、としている[5]。
臨床像[編集]
一般に上皮に対する親和性が強く、それぞれ種類によって生じてくる疾患は異なっている。
- 尖圭コンジローマ:粘膜型低リスク型であるHPV6または11型が約90%を占め、発癌性と関係する高リスク型のHPV16、18型などが混合感染していることもある[5]。HPV16、52、58、18型などに感染した女性の場合、子宮頸部に感染し、子宮頸癌の発癌要因になることもあると考えられている[5]。外生殖器に鶏冠状の乳頭腫を形成する。
- 子宮頸癌:子宮頸癌の90%以上、前癌病変である異形成の95%以上から、正常婦人の外陰からも5-10%、高リスク型HPVが検出される[5]。
- 疣贅:皮膚に出来るイボ。ウイルスの種類により形状・発生場所が異なる。詳しくは内部リンク参照のこと。
- 咽頭乳頭腫:HPVが尖圭コンジローマを有する母親から乳児へ経産道感染することにより、咽頭に形成される良性腫瘍。声門部が好発であり、気道まで進展し稀に狭窄をきたすおそれがあるため、周産期の管理が必要となる。
ワクチン[編集]
HPVワクチンは2価ワクチン、4価ワクチンがあり、後に9価ワクチンが加わり2価は市場から撤退した。いずれも組換えDNA技術を用いているため、ワクチン自体には感染性はない[6]。
米国のメルク社より尖圭コンジローマと子宮頸癌の原因ウイルスであるHPV6 、11、16、18型のワクチン「商品名ガーダシル」(GARDASIL) が開発され、2006年6月にアメリカ食品医薬品局(FDA)に承認された。世界保健機関(WHOから品質や安全性の基準など満たすワクチンとして認定されている。米国でのHPV未感染女性を対象にした、ガーダシルを用いた4つの大規模臨床試験の結果を総合すると、前癌状態であるCIN2、CIN3、AISに対し、99%の発症予防効果があった[14][15]。
次いで米国のグラクソ・スミスクライン社よりHPV16、18型のワクチン「商品名サーバリックス」(Cervix) が開発され、2007年5月に10-45歳の女性用としてオーストラリアの医薬品審査当局で承認された。なお、有効性の承認はないが31型、45型などの他の腫瘍性HPV型に対しても予防効果も示唆されている。日本ではサーバリックスが2009年10月に承認され、ガーダシルが2011年である。
アメリカでは、9価HPVワクチンのガーダシル9の登場によって、2016年に2価のサーバリックスは市場から撤退した[16]。
欧米ではHPV 16型と18型の割合が多い(約70 - 80%)のに対し、日本では割合がやや低い(約60 - 70%)ので欧米より有効性が低い可能性がある。
HPVワクチンはあくまでも予防ワクチンであり、治療ワクチンではない[17]。しかし、抗体陽性であるがウイルスDNA陰性(過去の感染が排除された証拠)の女性においては、ブースター効果によって抗体価が増幅され、その結果、同じ型のHPVのその後の感染は防がれる[18]。CIN治療ワクチンは2012年時点で治験中である[19]。
26歳以上の女性に安全・有効であるかの検証は現在進行しているところであるが、臨床試験の中間報告ではHPV抗体価の10倍以上の上昇と、従来の接種対象年齢と変わらぬ安全性が示されている[18]。ただし、これらのワクチンは子宮頸癌等の定期健診を不要にするものではない。ガーダシルなら6、11、16、18型、サーバリックスなら16、18型以外が原因になる癌(子宮頸癌では20 - 30%の原因となる)には効果が認定されていない。ワクチン接種時点で既に感染しているウイルスにも無効である。WHOなど世界の多くの機関・団体で、ワクチン接種に加えて接種後の定期健診が重要だとしている。
日本では、2013年4月よりHPVワクチンは定期接種となった。若年男子に対する尖圭コンジローマの予防も期待される4価HPVワクチン(ガーダシル)が、日本では若年女子に公費による定期接種に指定されたが、疼痛症候群などの問題により、2価HPVワクチン(サーバリックス)と同じく推奨が控えられるようになった[5]。2013年6月14日には厚生労働省は、ワクチンによる副反応が疑われる事例がことから、積極的な接種推奨を控えるよう勧告した[20]。2022年、ワクチンの安全性に特段の懸念はないとして、積極的推奨が再開された。
出典[編集]
- ^ a b Westrich, Joseph A.; Warren, Cody J.; Pyeon, Dohun; et al. (2017). “Evasion of host immune defenses by human papillomavirus”. Virus Research 231: 21-33. doi:10.1016/j.virusres.2016.11.023. PMC 5325784. PMID 27890631.
- ^ a b Cason J, Kaye JN, Jewers RJ, etal (November 1995). “Perinatal infection and persistence of human papillomavirus types 16 and 18 in infants”. J. Med. Virol. 47 (3): 209-18. PMID 8551271.
- ^ a b Mund, K.; Han, C.; Daum, R.; et al. (1997). “Detection of Human Papillomavirus Type 16 DNA and of Antibodies to Human Papillomavirus Type 16 Proteins in Children”. Intervirology 40 (4): 232-237. doi:10.1159/000150552. PMID 9612724.
- ^ a b Kojima, A; Maeda, H; Kurahashi, N; et al. (2003). “Human papillomaviruses in the normal oral cavity of children in Japan”. Oral Oncology 39 (8): 821-828. doi:10.1016/S1368-8375(03)00100-3. PMID 13679205.
- ^ a b c d e f g 日本性感染症学会「性感染症 診断・治療 ガイドライン2016」(pdf)『日本性感染症学会誌』第27巻1 Supplement、2016年11月。
- ^ a b 柊元巌、森清一郎、長島真美『ヒトパピローマウイルス感染症 (pdf)』(レポート)、国立感染症研究所、2012年9月。2018年3月10日閲覧。
- ^ a b クリニチップHPV pmda
- ^ HPV DNA「キアゲン」HC II pmda
- ^ 子宮頸がんと検診 子宮頸がん検診における細胞診とHPV検査併用の有用性に関する研究班HP
- ^ 笹川寿之「ヒトパピローマウイルス (HPV) ワクチンの現状と課題」(pdf)『Modern Media』第55巻、2009年、269-275頁、NAID 80020752537。
- ^ 今野良「Chapter1 HPV感染と子宮頸癌」『知っておきたい子宮頸がん診療ハンドブック』(pdf)中外医学社、2012年、1-5頁。ISBN 978-4-498-06062-3。
- ^ Kreimer, Aimée R.; Bhatia, Rohini K.; Messeguer, Andrea L.; et al. (2010). “Oral Human Papillomavirus in Healthy Individuals: A Systematic Review of the Literature”. Sexually Transmitted Diseases (6): 1. doi:10.1097/OLQ.0b013e3181c94a3b. PMID 20081557.
- ^ 『ウイルスの臨床検査』《臨床検査MOOK No.28》p.243. 金原出版、1988年、ISBN 978-4307643283。
- ^ ヒトパピローマウイルス(HPV)ワクチン接種への公費助成に関する要望書 (PDF) 日本産科婦人科学会、2010年
- ^ Ault, Kevin A. (2007). “Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials”. The Lancet 369 (9576): 1861-1868. doi:10.1016/S0140-6736(07)60852-6. PMID 17544766.
- ^ Nick Mulcahy (2016年10月24日). “GSK’s HPV Vaccine, Cervarix, No Longer Available in US”. Medscape 2018年3月10日閲覧。
- ^ 松本光司「2) 子宮頸癌制圧のためのHPVワクチン(クリニカルカンファレンス1 婦人科がんとTR,生涯研修プログラム,第60回日本産科婦人科学会学術講演会)」『日本産科婦人科學會雜誌』第60巻第2号、2008年、404頁、NAID 110006804731。
- ^ a b HanleySharon、今野良「HPVワクチン-40歳代女性を含むCatch-up vaccination」『産科と婦人科』第77巻第9号、2010年9月、1016-1022頁、NAID 40017265898。
- ^ “HPV“治療”ワクチンを米社が開発、第I相臨床試験結果発表”. Medical Tribune (2012年10月16日). 2014年9月2日閲覧。
- ^ “ヒトパピローマウイルス感染症(子宮頸がん予防ワクチン)”. 厚生労働省. 2014年9月2日閲覧。
関連項目[編集]
- ハラルド・ツア・ハウゼン
- 性感染症
- 腫瘍ウイルス
- デデ・コサワ - 当該ウイルスを原因とする皮膚病の患者
- p16 - p16蛋白免疫染色はHPV検査に対する病理組織上での代理マーカーである。HPVに感染して宿主細胞の細胞増殖機構に異常をきたした不死化細胞はp16過剰発現を示す。
外部リンク[編集]
- Oral sex-related cancer at 30-year high
- Oral sex can cause throat cancer
- 日本性感染症学会
- メルクマニュアル - 子宮頸癌
- Norma Erickson and Peter H. Duesberg, PhD : What if HPV does NOT cause cervical cancer? SaneVax, Inc.
