インデン
| インデン | |
|---|---|
| |
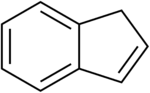
1H-インデン(許容慣用名) | |
別称 ベンゾシクロペンタジエン | |
| 識別情報 | |
| CAS登録番号 | 95-13-6 |
| PubChem | 7219 |
| 日化辞番号 | J4.708B |
| |
| 特性 | |
| 化学式 | C9H8 |
| モル質量 | 116.16 |
| 外観 | 無色~淡黄色液体 |
| 匂い | 特異臭[1] |
| 嗅覚閾値 | 0.0038ppm[6] |
| 密度 | 0.9968 (20 ℃)[2] |
| 融点 |
-1.8 ℃[2] |
| 沸点 |
181.6 ℃[2] |
| 水への溶解度 | 332mg/L (25℃)[3] |
| 有機溶剤への溶解度 | エタノール、クロロホルム、エーテル、アセトンなど多くの有機溶剤に混和する[1] |
| 酸解離定数 pKa | 20.1 (in DMSO)[4][5] |
| 危険性 | |
| 引火点 | 78.33 ℃[3] |
| 関連する物質 | |
| 関連物質 | インドール インダン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
インデン (indene) は、分子式がC9H8と表される二環性の炭化水素。可燃性。ベンゼンがシクロペンタジエン環と縮合した構造を持つ。純粋なインデンは無色だが、保管中に起こる重合や酸化により淡黄色を呈する。主な工業的用途として、熱可塑性を持つクマロン-インデン樹脂の原料となる。
単離
[編集]インデンは天然に存在し、コールタールの175-185 ℃付近の留分から得られる。その留分を金属ナトリウムと加熱して "sodio-indene" として沈殿させる。インデンは弱い酸性を持つため、金属ナトリウムの作用により塩を作るのである。"sodio-indene" から水蒸気蒸留によりインデンを取り出す[7]。
反応
[編集]インデンは容易に重合反応を起こす。また、二クロム酸により酸化するとホモフタル酸(o-カルボキシルフェニル酢酸)を与える。インデンはナトリウムエトキシドの存在下、シュウ酸エチルと縮合してインデン-シュウ酸エステルを作る。また、インデンは塩基の存在下にアルデヒドやケトンと縮合して強い発色を示すベンゾフルベンとなる。また、シクロペンタジエン同様にプロトンの引き抜きによりインデニルアニオンとなり、有機金属化学において配位子として利用される。インデニルアニオンは η5-配位子としてだけではなく η3-配位子としての性質も強いことから、シクロペンタジエニルアニオンとは異なった反応性を示すことがあり、インデニル効果 (indenyl effect) と呼ばれる。
安全性
[編集]日本の消防法では危険物第4類・第3石油類に分類される。目に対する強い刺激性、皮膚に対する軽度の刺激性がある。吸入により、肝臓・腎臓・脾臓に対する障害のおそれがある[3]。
脚注
[編集]- ^ a b 化学物質等安全データシート (PDF) (昭和化学)
- ^ a b c Merck Index 14th ed., 4939.
- ^ a b c 製品安全データシート(安全衛生情報センター)
- ^ Bordwell FG (1988). “Equilibrium acidities in dimethyl sulfoxide solution”. Acc. Chem. Res. 21 (12): 456–463. doi:10.1021/ar00156a004.
- ^ “Bordwell pKa Table in DMSO”. 2011年11月17日閲覧。
- ^ 東京都環境科学研究所調べ 岩崎好陽『新訂 臭気の環境測定法』におい・かおり環境協会、2005年。ISBN 4-915952-15-0。
- ^ Gerd Collin, Rolf Mildenberg, Mechthild Zander, Hartmut Höke, William McKillip, Werner Freitag, Wolfgang Imöhl (2000). “Resins, Synthetic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH
