セプチン
| Cell division/GTP binding protein | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||
| 略号 | Cell_Div_GTP_bd | ||||||||
| Pfam | PF00735 | ||||||||
| Pfam clan | CL0023 | ||||||||
| InterPro | IPR000038 | ||||||||
| |||||||||
セプチン(英: septin)は、植物以外の全ての真核生物で発現しているGTP結合タンパク質である[1][2][3]。さまざまなセプチンが互いに結合し、タンパク質複合体を形成する。こうした複合体はさらにフィラメント、リング、ガーゼ状の構造へと組み立てられ、他のタンパク質を局在させる機能を果たす。こうした局在化は、他のタンパク質が接着する足場を提供する、細胞のある区画から他の区画への分子の拡散を防ぐ障壁を形成する[2][3][4][5]、もしくは細胞皮質で膜結合タンパク質の拡散を防ぐ障壁となる[6]、といった手法で行われる。
セプチンは細胞分裂部位や繊毛や鞭毛などの特殊な構造体が細胞体に接着する部位の細胞膜へ細胞過程を局在させる役割を持つことが示唆されている[4]。セプチンは酵母細胞の細胞分裂時に細胞を区画化し、隔壁(septum)を構造的に支持する足場を構築することから、その名が付けられている[3]。ヒト細胞での研究からは、セプチンは病原性細菌の周囲にカゴ状の構造を構築し、細菌を動けなくすることで他の細胞への侵入を防いでいることが示唆されている[7]。
セプチンはフィラメント形成タンパク質であるため、細胞骨格の一部であると考えられている[4]。極性を持たないフィラメントの形成に加えて、セプチンは細胞膜、細胞皮質、アクチンフィラメント、微小管と結合する[4][6]。
構造[編集]
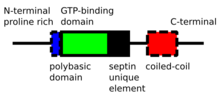

セプチンはPループ型NTPaseタンパク質であり、大きさは30–65 kDaである。セプチンは真核生物の間で高度に保存されている。セプチンのN末端はプロリンに富むさまざまな長さの配列で、膜への結合に重要な塩基性のホスホイノシチド結合モチーフが含まれる。続いてGTP結合ドメイン、高度に保存されたSUE(septin unique element)ドメインが存在し、C末端にはさまざまな長さのコイルドコイルドメインが含まれる[4]。
セプチンはGTP結合ドメインか、N末端とC末端の双方か、これらのいずれかを介して相互作用を行う。発現するセプチンの数は生物種によって異なるが、対称的なオリゴマーを形成する。例えば、ヒトではSEPT7-SEPT6-SEPT2-SEPT2-SEPT6-SEPT7のように結合した複合体が形成され、酵母ではCdc11-Cdc12-Cdc3-Cdc10-Cdc10-Cdc3-Cdc12-Cdc11が形成される。その後こうした複合体どうしが結合し、極性を持たないフィラメント、フィラメントバンドル、ケージまたはリング状の構造が細胞内に形成される[4]。
さまざまな生物のセプチン[編集]
セプチンは菌類、動物、そして一部の真核生物型藻類に存在するが、植物には存在しない[1]。
| 生物種 | 系統学的グループ | セプチンタンパク質 | |
|---|---|---|---|
| 菌類 | 出芽酵母
Saccharomyces cerevisiae |
Cdc3 | Cdc3 |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, Shs1, Spr28 | ||
| Cdc12 | Cdc12, Spr3 | ||
| 分裂酵母
Schizosaccharomyces pombe |
Spn1 | Spn1 | |
| Spn2 | Spn2 | ||
| Spn3 | Spn3, Spn5, Spn7 | ||
| Spn4 | Spn4, Spn6 | ||
| カンジダ
Candida albicans |
Cdc3 | Cdc3 | |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, Sep7, Spr28 | ||
| Cdc12 | Cdc12, Spr3 | ||
| アスペルギルス・ニデュランス
Aspergillus nidulans |
AspD | AspD | |
| AspB | AspB | ||
| AspA | AspA | ||
| AspC | AspC | ||
| AspE | AspE | ||
| 動物 | ヒト | Sept2 | SEPT1, SEPT2, SEPT4, SEPT5 |
| Sept3 | SEPT3, SEPT9, SEPT12 | ||
| Sept6 | SEPT6, SEPT8, SEPT10, SEPT14 | ||
| Sept7 | SEPT7 (偽遺伝子としてSEPT13)[4] | ||
| 線虫 | UNC-59 | UNC-59 | |
| UNC-61 | UNC-61 |
酵母[編集]
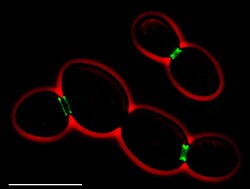
出芽酵母には7種類のセプチンが存在する。そのうち5つ(Cdc3、Cdc10、Cdc11、Cdc12、Shs1)は有糸分裂に関与しており、2つ(Spr3、Spr28)は胞子形成に特異的である[2][3]。有糸分裂セプチンは細胞分裂時にbud neck(親細胞と娘細胞のつなぎ目)にリング構造を形成する[2][4]。これらは出芽部位の選択、紡錘体の配置、極性成長、細胞質分裂に関与している。胞子形成セプチンは、Cdc3、Cdc11とともに前胞子膜(prospore membrane)のエッジに局在する[2]。
組織化[編集]
セプチンは、細胞皮質にseptin cortexと呼ばれる特別な領域を形成する[8]。細胞周期を通じて、septin cortexにはいくつかの変化が生じる。最初に可視化されるセプチンの構造は、出芽の約15分前に出現する明確なリング構造である。出芽後にリング構造は広がり、親細胞のbud neckの周辺で砂時計型の形状となる。細胞質分裂時には、septin cortexは二重のリングへと分割され、最終的には消失する。FRAP解析によって、bud neckでのセプチンのターンオーバーには細胞周期の間で複数回の変化が生じることが明らかにされている。優勢で機能的なコンフォメーションは低いターンオーバー率で特徴づけられ(frozen state)、セプチンはリン酸化されている。構造変化にはseptin cortexの不安定化が必要であり(fluid state)、出芽、リングの分割、細胞の分離に先立って脱リン酸化によって誘導される[3]。
糸状菌[編集]
出芽酵母での発見以降、セプチンのホモログは糸状菌を含む他の真核生物種でも発見されている。糸状菌のセプチンは1つの細胞内でさまざまな形状を示し、フィラメント形態を制御する[9][10]。
カンジダCandida albicans[編集]
カンジダC. albicansのゲノムには出芽酵母の全てのセプチンのホモログがコードされている。Cdc3とCdc12がなければ増殖することはできないが、他のセプチンは形態やキチンの蓄積に影響を与えるものの必須ではない。C. albicansはさまざまな栄養増殖の形態を示し、それによって出現するセプチンの構造が決定される。新たに形成された菌糸の基部ではセプチンのリングが形成される。隔壁形成部位では二重のリングが、先端部ではセプチンキャップが形成される。また、伸びたセプチンフィラメントは球形の厚膜胞子を包む。隔壁形成部位のセプチンの二重リングの成長には極性が存在し、成長端側のリングは解体されるのに対し、基部側のリングは完全なままである[9]。
アスペルギルス・ニデュランスAspergillus nidulans[編集]
A. nidulansには5種類のセプチン(AnAspAp、AnAspBp、AnAspCp、 AnAspDp、AnAspEp)が存在する。AnAspBpは隔膜形成部位で一重のリングを形成し、最終的には二重のリングへと分裂する。さらに、AnAspBpは分岐が出現する部位でリングを形成し、分岐が成長するにつれてバンドへと拡大する。C. albicansと同様に、二重のリングは菌糸の極性を反映している。A. nidulansの場合、極性はより基部側のリングの解体によってもたらされる。頂端側のリングは完全なままであり、成長のガイダンスキューとなっている可能性がある[2]。
Ashbya gossypii[編集]

子嚢菌門の1種A. gossypiiは出芽酵母の全てのセプチンのホモログを持っており、そのうちの1つは重複している(AgCdc3p、AgCdc10p、AgCdc11Ap、AgCdc11Bp、AgCdc12p、AgSep7p)。GFP融合AgSep7pのin vivoでの研究により、セプチンは成長端や分岐形成部位の近傍で非連続的なリングを形成し[2]、分岐部位の基部では非対称的な構造となることが明らかにされている。リングは、成長端の近傍で長く拡散したフィラメント、頂端から離れた部位では短くコンパクトなフィラメントから構成される。隔膜の形成時には、セプチンリングは2つに分割されて二重のリングを形成する。Agcdc3Δ、Agcdc10Δ、Agcdc12Δ欠失変異体は異常な形態を示し、アクチンリングの形成、キチンリングの形成、胞子形成に欠陥が生じる。隔膜の欠損のため、セプチン欠失変異体は損傷感受性が非常に高く、1つの菌糸の損傷によって若い菌糸体の完全な溶菌が生じる。
動物[編集]
酵母のセプチンや動物の他の細胞骨格構成要素とは対照的に、動物のセプチンは細胞内で連続的なネットワークは形成せず、細胞皮質の細胞質でいくつかの分散したネットワークを形成する。これらはアクチンバンドルと微小管によって束ねられる。例えば、アクチンバンドリングタンパク質アニリンはセプチンの組織化の空間的制御に必要である[5]。哺乳類の精子では、セプチンは尾部に輪状小体(annulus)と呼ばれる安定なリングを形成する。マウス(とおそらくヒト)では、輪状小体形成の欠陥は男性不妊の原因となる[4][5]。
ヒト[編集]
ヒトではセプチンは、他のタンパク質をリクルートしたり、拡散の障壁として機能したりすることで、細胞質分裂、繊毛形成、神経発生に関与している。13のヒト遺伝子がセプチンをコードする。これらの遺伝子から産生されるセプチンタンパク質は、その創設メンバーの名称に由来する4つのサブファミリーへと分類される。(i) SEPT2(SEPT1、SEPT4、SEPT5)、(ii) SEPT3(SEPT9、SEPT12)、(iii) SEPT6(SEPT8、SEPT10、SEPT11、SEPT14)、(iv) SEPT7の4種類である。セプチンタンパク質複合体はヘテロ六量体(3つの異なるグループから1種類ずつで各種類2コピーずつ)またはヘテロ八量体(4つの異なるグループから1種類ずつで各種類2コピーずつ)のいずれかへと組み立てられる。これらのヘテロオリゴマーがフィラメントやリングなどのより高次な構造を形成する[1][4][5]。
セプチンは細菌病原体の周囲にカゴ状の構造を形成し、有害な微生物を動けなくすることで健康な細胞への侵入を防ぐ。この細胞防御システムは赤痢や他の疾患に対する治療の開発に利用される可能性がある。例えば、赤痢菌はヒトに致死性の下痢を引き起こす細菌である。赤痢菌はアクチンポリマーの「テール」を形成して移動を推進し、隣接する宿主細胞への侵入を可能にする。免疫応答の一部として、ヒト細胞はTNF-αと呼ばれる細胞シグナル伝達タンパク質を産生し、TNF-αはセプチンフィラメントのバンドリングを開始して感染宿主細胞内の微生物を囲む[11]。こうしたセプチンのカゴに捕捉された微生物はオートファジーによって破壊される[12]。セプチンの破壊やセプチンをコードする遺伝子の変異は、白血病、結腸がん、パーキンソン病やアルツハイマー病などの神経変性疾患の発症に関与している可能性がある。そのためTNF-αの作用を模倣しセプチンのカゴの増殖を可能にする薬剤による免疫系の強化は、赤痢菌によって引き起こされる赤痢などの細菌感染と同様、こうした疾患に対しても治療法となる可能性がある[7]。
線虫Caenorhabditis elegans[編集]
線虫Caenorhabditis elegansにはセプチンをコードする遺伝子が2つ存在し、セプチン複合体はUNC59-UNC61-UNC61-UNC59四量体である。C. elegansのセプチンは細胞分裂時に分裂溝と中央体に濃縮される。また、セプチンは細胞の移動や軸索誘導にも関与している[2]。
ミトコンドリア[編集]
ミトコンドリアに局在するセプチンはM-septin(mitochondrial septin)と呼ばれる。発生中のラットの脳においてCRMP/CRAM相互作用タンパク質であることが同定されている[13]。
歴史[編集]
セプチンは1970年にリーランド・ハートウェルらによって、出芽酵母で細胞分裂に影響を与える温度感受性変異体(cdc変異体)のスクリーニングから発見された。スクリーニングからは制限温度で細胞質分裂が妨げられる4つの変異体が得られた。対応する遺伝子ScCDC3、ScCDC10、ScCDC11、ScCDC12はこの最初の4つのセプチンを表している[3][4]。細胞質分裂の異常にもかかわらず、細胞は出芽、DNA合成、核分裂を継続し、その結果複数の長い芽を持つ巨大な多核細胞が形成された。1976年に電子顕微鏡解析によって、野生型のbud neckの周囲には10 nmのフィラメントが約20本均等に配置した縞がみられるのに対し、セプチン変異体ではみられないことが明らかにされた[3][4][9]。免疫蛍光染色による研究によって、セプチンタンパク質はbud neckに共局在することが明らかにされた[4][9]。4つのセプチンタンパク質の共局在はSccdc3とSccdc12コンディショナル変異体では破壊され、セプチンタンパク質の相互依存性が示された。この発見を強く支持する結果は生化学的研究からももたらされた。4つのセプチンはアフィニティカラムで共精製され、さらに5つ目のセプチンタンパク質も共精製された。このタンパク質はScSEP7またはScSHS1にコードされている。出芽酵母、ショウジョウバエ、ツメガエル、哺乳類の細胞から精製されたセプチンはin vitroで自己集合し、フィラメントを形成した[9]。セプチンがin vitroでどのように相互作用してフィラメントを形成するかに関しては、出芽酵母で詳細な研究が行われた。
出典[編集]
- ^ a b c Neubauer, K; Zieger, B (2017). “The Mammalian Septin Interactome.”. Frontiers in Cell and Developmental Biology 5: 3. doi:10.3389/fcell.2017.00003. PMC 5293755. PMID 28224124.
- ^ a b c d e f g h i “The septin family of GTPases: architecture and dynamics”. Nat. Rev. Mol. Cell Biol. 9 (6): 478–89. (2008). doi:10.1038/nrm2407. PMID 18478031.
- ^ a b c d e f g “Septin function in yeast model systems and pathogenic fungi”. Eukaryotic Cell 4 (9): 1503–12. (2005). doi:10.1128/EC.4.9.1503-1512.2005. PMC 1214204. PMID 16151244.
- ^ a b c d e f g h i j k l m “Septins: the fourth component of the cytoskeleton”. Nat. Rev. Mol. Cell Biol. 13 (3): 183–94. (2012). doi:10.1038/nrm3284. PMID 22314400.
- ^ a b c d “Diversity of septin scaffolds”. Curr. Opin. Cell Biol. 18 (1): 54–60. (2006). doi:10.1016/j.ceb.2005.12.005. PMID 16356703.
- ^ a b Bridges, AA; Gladfelter, AS (10 July 2015). “Septin Form and Function at the Cell Cortex.”. The Journal of Biological Chemistry 290 (28): 17173–80. doi:10.1074/jbc.R114.634444. PMC 4498057. PMID 25957401.
- ^ a b “Septin proteins take bacterial prisoners: A cellular defence against microbial pathogens holds therapeutic potential”. Nature. (December 2011). doi:10.1038/nature.2011.9540.
- ^ Gladfelter, AS; Pringle, JR; Lew, DJ (December 2001). “The septin cortex at the yeast mother-bud neck.”. Current Opinion in Microbiology 4 (6): 681–9. doi:10.1016/s1369-5274(01)00269-7. PMID 11731320.
- ^ a b c d e “Control of filamentous fungal cell shape by septins and formins”. Nat. Rev. Microbiol. 4 (3): 223–9. (2006). doi:10.1038/nrmicro1345. PMID 16429163.
- ^ Harris, SD (2006). “Cell polarity in filamentous fungi: shaping the mold.”. International Review of Cytology 251: 41–77. doi:10.1016/S0074-7696(06)51002-2. ISBN 9780123646552. PMID 16939777.
- ^ “Entrapment of intracytosolic bacteria by septin cage-like structures”. Cell Host Microbe 8 (5): 433–44. (2010). doi:10.1016/j.chom.2010.10.009. PMID 21075354.
- ^ “p62 and NDP52 proteins target intracytosolic Shigella and Listeria to different autophagy pathways”. J. Biol. Chem. 286 (30): 26987–95. (2011). doi:10.1074/jbc.M111.223610. PMC 3143657. PMID 21646350.
- ^ “Isolation and expression of a novel mitochondrial septin that interacts with CRMP/CRAM in the developing neurones”. Genes Cells 8 (2): 81–93. (February 2003). doi:10.1046/j.1365-2443.2003.00617.x. PMID 12581152.
関連文献[編集]
- “The septins: roles in cytokinesis and other processes”. Curr. Opin. Cell Biol. 8 (1): 106–19. (February 1996). doi:10.1016/S0955-0674(96)80054-8. PMID 8791410.
- “Septins: a ring to part mother and daughter”. Curr. Genet. 41 (3): 123–31. (June 2002). doi:10.1007/s00294-002-0304-0. PMID 12111093.
- “Protein-protein interactions governing septin heteropentamer assembly and septin filament organization in Saccharomyces cerevisiae”. Mol. Biol. Cell 15 (10): 4568–83. (October 2004). doi:10.1091/mbc.E04-04-0330. PMC 519150. PMID 15282341.
- “Septin function in yeast model systems and pathogenic fungi”. Eukaryotic Cell 4 (9): 1503–12. (September 2005). doi:10.1128/EC.4.9.1503-1512.2005. PMC 1214204. PMID 16151244.
- “Control of filamentous fungal cell shape by septins and formins”. Nat. Rev. Microbiol. 4 (3): 223–9. (March 2006). doi:10.1038/nrmicro1345. PMID 16429163.
- Hall PA; Russell SEH; Pringle JR (2008). The septins. Oxford: John Wiley-Blackwell. pp. 370. ISBN 978-0-470-51969-1
- Gonzalez-Novo A; Vázquez de Aldana CR; Jimenez J (2009). “Fungal septins: one ring to rule it all?”. Cent. Eur. J. Biol. 4 (3): 274–289. doi:10.2478/s11535-009-0032-2.
