ウイルス・ノイラミニダーゼ
| ノイラミニダーゼ | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
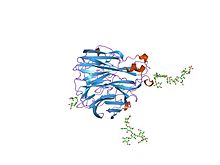 インフルエンザウイルス・ノイラミニダーゼの構造[1] | |||||||||||
| 識別子 | |||||||||||
| 略号 | Neur | ||||||||||
| Pfam | PF00064 | ||||||||||
| Pfam clan | CL0434 | ||||||||||
| InterPro | IPR001860 | ||||||||||
| SCOP | 2bat | ||||||||||
| SUPERFAMILY | 2bat | ||||||||||
| |||||||||||

ウイルス・ノイラミニダーゼ (英: viral neuraminidase) は、ウイルスの表面に存在するノイラミニダーゼの一種であり、宿主細胞内で産生された複製ウイルスの、細胞からの遊離を可能にする。ノイラミニダーゼは一般にシアル酸類を糖タンパク質から切断する酵素であり、インフルエンザウイルスの自己複製プロセスにおいて必要とされる。
ウイルスが感染する際、ウイルスの表面にあるヘマグルチニン (シアル酸類に結合する分子) を使って宿主細胞に吸着する。シアル酸類は、宿主細胞の糖タンパク質に広く見出される糖 (9炭糖)であり、ウイルスはこの分子グループを悪用して宿主細胞に結合する。宿主細胞からウイルスが遊離されるためには、ノイラミニダーゼが酵素として特異的に、ヘマグルチニンが結合する宿主の糖タンパク質のシアル酸を切断しなければならない[2]。ウイルスの自己複製プロセスの不可欠なパートとして、ノイラミニダーゼの機能をノイラミニダーゼ阻害剤でブロックすることは、ウイルス感染治療の有効な方法である。
ムンプスウイルス(流行性耳下腺炎の病原体)およびヒトパラインフルエンザウイルスを含むいくつかのウイルス群においては、ヘマグルチニン-ノイラミニダーゼタンパク質1つで、ノイラミニダーゼとヘマグルチニンの両方の機能を果たしている。
機能[編集]
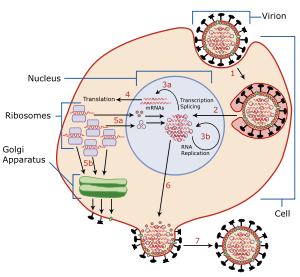
この酵素は、複製されたウイルスの宿主細胞からの遊離を促進する。ウイルスのエンベロープはヘマグルチニンとノイラミニダーゼという2種類の糖タンパク質を持つ。ヘマグルチニンはウイルスが宿主に感染する場合に必要であるが、宿主内で複製されたウイルスが出芽により遊離される際には、複製されたウイルスが宿主細胞の表面にあるシアル酸に、それ自身のヘマグルチニンで結合したままとなり、遊離が阻害される。ウイルス・ノイラミニダーゼは、宿主細胞の表面にある糖タンパク質からシアル酸残基を切断して、ヘマグルチニンと宿主細胞の糖タンパク質との結合を切り離し、子孫ウイルスを遊離させ、宿主周辺の非感染細胞への感染を可能にする[3]。また、ノイラミニダーゼは、ウイルス表面にある糖タンパク質のシアル酸残基を切断することで、ウイルス同士が凝集することも防いでいる。
ノイラミニダーゼ阻害剤[編集]
ノイラミニダーゼは、「構造に基づく酵素阻害剤の設計プログラム」のターゲットにされて来た。このプログラムは、ザナミビル (リレンザ) および オセルタミビル (タミフル)という2種類の薬剤の開発という成果を上げている。ノイラミニダーゼ阻害剤の投与は、症状のひどさを緩和し、ウイルスの蔓延を抑える治療法である。ザナミビルの投与は吸入により、オセルタミビルの投与は経口により行なわれる。2010年1月に日本において製造販売承認を取得したペラミビル(ラピアクタ)は注射(点滴静注)[4]により投与される。世界に先駆けて日本で、2010年10月に純国産の吸入ノイラミニダーゼ阻害薬であるラニナミビル製剤「イナビル®吸入粉末剤20mg」が発売された。
ノイラミターゼ阻害剤耐性[編集]
2005年2月27日に、14歳のベトナム人の少女が、インフルエンザの治療で使用されているオセルタミビルに対して耐性を持つ H5N1 インフルエンザウイルスの変異株に感染していたことが報告されている[5] 。彼女は予防的な投与 (75 mg 1日1回) を受けていたのであるが、この治療法に対する感受性が無かったのである。鳥類による媒介でインフルエンザの世界的流行の脅威が高まる中で、科学者達はタミフル治療への耐性の発生原因の探索を開始し、耐性ウイルスのノイラミニダーゼの274番目のアミノ酸が通常のヒスチジンからチロシンに置き変わっていたことが原因であったことを突き止めている。この変異はザナミビルとラニナミビルに対しては耐性を獲得しないことが判明している。
インフルエンザの変異株は突然変異により継続的に出現することから、薬剤耐性の原因である、ノイラミニダーゼのサブタイプの決定を、科学者達が迅速かつ効果的に行なうことが、特定の種類のインフルエンザ変異株と闘うためには不可欠である。
基質特異性[編集]
理想的には、インフルエンザのウイルス・ノイラミニダーゼ (NA) は、ヘマグルチニン (HA) のレセプター(糖タンパク質)と同じタイプのレセプターにのみ作用すべきであるが、これが常に実現するわけではない。NA と HA の基質特異性に強い一致が無い場合に、ウイルスがいったいどうやって切り抜けているのかは全く不明である。
エキソ型(exo)とエンド型(endo)[編集]
ノイラミニダーゼ酵素群はエキソ型(exo)またはエンド型(endo)のグリコシダーゼ 活性を持つことができる。これは EC 3.2.1.29 (endo-neuraminidase) [6] および EC 3.2.1.18 (exo-neuraminidases)[7]で分類されている。一般に哺乳類のシアル酸残基は、グリカン複合体の終端部に位置し、ウイルス・ノイラミニダーゼはエキソ型グリコシダーゼであり、これらの終端の残基を自分達の基質と認識して作用する(グリコシダーゼ#分類を参照)。
脚注[編集]
- ^ Varghese JN, McKimm-Breschkin JL, Caldwell JB, Kortt AA, Colman PM (November 1992), “The structure of the complex between influenza virus neuraminidase and sialic acid, the viral receptor”, Proteins 14 (3): 327–32, doi:10.1002/prot.340140302, PMID 1438172
- ^ Huang IC, Li W, Sui J, Marasco W, Choe H, Farzan M (May 2008), “Influenza A virus neuraminidase limits viral superinfection”, J. Virol. 82 (10): 4834–43, doi:10.1128/JVI.00079-08, PMC 2346733, PMID 18321971
- ^ 河岡義裕・堀本研子 『インフルエンザパンデミック』 講談社〈ブルーバックス〉、2009年、51頁。
- ^ 『抗インフルエンザウイルス剤「ラピアクタ点滴用バッグ300mg」および「ラピアクタ点滴用バイアル150mg」の製造販売承認取得について』(PDF)(プレスリリース)塩野義製薬、2010年1月13日。2010年12月24日閲覧。
- ^ USATODAY.com - Vietnamese girl's bird flu infection resistant to Tamiflu
- ^ EC 3.2.1.129
- ^ EC 3.2.1.18
外部リンク[編集]
- Influenza Research Database Database of influenza sequences (including neuraminidase).
- Proteopedia Avian_Influenza_Neuraminidase,_Tamiflu_and_Relenza
