「先天性高インスリン血症」の版間の差分
m編集の要約なし |
Smilesworth (会話 | 投稿記録) en:Congenital hyperinsulinism (04:07, 28 June 2023 UTC) の翻訳をもとに作成 タグ: サイズの大幅な増減 曖昧さ回避ページへのリンク |
||
| 1行目: | 1行目: | ||
{{Infobox medical condition (new) |
|||
{{Expand English|en:Congenital hyperinsulinism|date=2023-07-03}} |
|||
| name = Congenital hyperinsulinism |
|||
'''先天性高インスリン血症'''(せんてんせいこうインスリンけっしょう、{{Lang-en-short|congenital hyperinsulinism}})は、遺伝子疾患の一種<ref name="ahegao">{{cite journal|last1=Glaser|first1=Benjamin|date=1 January 1993|title=Familial Hyperinsulinism|url=https://www.ncbi.nlm.nih.gov/books/NBK1375/|journal=GeneReviews|accessdate=2023-07-03|pmid=20301549}}update 2013</ref>。 |
|||
| synonyms = CHI |
|||
| image = InsulinHexamer.jpg |
|||
| caption = '''インスリン'''<br/>(この疾患では過剰産生される) |
|||
| pronounce = |
|||
| field = |
|||
| symptoms = 低血糖<ref name=rar/> |
|||
| complications = |
|||
| onset = |
|||
| duration = |
|||
| types = |
|||
| causes = ''ABCC8''遺伝子変異(最も一般的)<ref name=gen1>{{Cite web|url=https://ghr.nlm.nih.gov/condition/congenital-hyperinsulinism|title=congenital hyperinsulinism|last=Reference|first=Genetics Home|website=Genetics Home Reference|access-date=2016-10-07}}</ref> |
|||
| risks = |
|||
| diagnosis = 血液試料<ref name=sampl>{{cite journal|last1=Hussain|first1=K.|title=Congenital hyperinsulinism|journal=Seminars in Fetal and Neonatal Medicine|date=August 2005|volume=10|issue=4|pages=369–376|doi=10.1016/j.siny.2005.03.001|pmid=15916932}}</ref> |
|||
| differential = |
|||
| prevention = |
|||
| treatment = オクトレオチド、ニフェジピン<ref name=emed/> |
|||
| medication = |
|||
| prognosis = |
|||
| frequency = |
|||
| deaths = |
|||
}} |
|||
'''先天性高インスリン血症'''(せんてんせいこうインスリンけっしょう、{{Lang-en-short|congenital hyperinsulinism}}、略称: '''CHI''')は、[[インスリン]]の分泌過多によって[[低血糖症|低血糖]]が引き起こされる、一連の先天性疾患を指す用語である<ref name="emed">{{Cite journal|date=2016-07-01|title=Congenital Hyperinsulinism: Background, Pathophysiology, Etiology|url=http://emedicine.medscape.com/article/923538-overview}}</ref><ref name="gen">{{cite journal|last1=Glaser|first1=Benjamin|date=1 January 1993|title=Familial Hyperinsulinism|url=https://www.ncbi.nlm.nih.gov/books/NBK1375/|journal=GeneReviews|accessdate=9 October 2016|pmid=20301549}}update 2013</ref>。先天性{{仮リンク|高インスリン血性低血糖症|en|Hyperinsulinemic hypoglycemia}}には、一過性のものと持続性のものがあり、軽症から重症までさまざまである。こうした症状は出生時には既に存在しており、ほとんどの場合には乳児期の初期に明らかとなる。軽症例は頻回食によって治療することができるが、より重症例ではインスリンの分泌や作用を低下させる医薬品による制御が行われる<ref name="rar">{{cite web |title=Familial hyperinsulinism {{!}} Genetic and Rare Diseases Information Center(GARD) – an NCATS Program |url=https://rarediseases.info.nih.gov/diseases/3947/familial-hyperinsulinism |website=rarediseases.info.nih.gov |accessdate=28 November 2016}}</ref><ref name="gen" />。 |
|||
先天的な遺伝子異常によりインスリンが体内で多く産生されるせいで、[[低血糖症|低血糖]]が慢性的に引き起こされる。 |
|||
== 徴候と症状 == |
|||
新生児期から異常な摂食行動がみられるため、容易に発見される。 |
|||
[[File:Cardiomegalia.JPG|thumb|130 px|right|心肥大]] |
|||
CHIは先天性疾患であるため、通常は新生児は出生後数日以内に徴候や症状を示し始めるが、極めて稀に、より後の段階になって症状が出現する可能性がある。CHIの徴候や症状は新生児や幼児の典型的挙動と混同されることが多く、その特定は困難であることが多い<ref name=":25">{{Cite journal|last=Hussain|first=K.|date=2005-08-24|title=Congenital hyperinsulinism|url=https://linkinghub.elsevier.com/retrieve/pii/S1744165X05000168|journal=Seminars in Fetal and Neonatal Medicine|volume=10|issue=4|pages=369–376|language=en|doi=10.1016/j.siny.2005.03.001}}</ref>。 |
|||
CHIの症状はいくつかの形で出現する可能性があるが、低血糖症に一般的な症状は次のようなものである。 |
|||
== 脚注 == |
|||
{{脚注ヘルプ}} |
|||
* 易刺激性<ref name=":9">{{Cite journal|last=Pagliara|first=Anthony S.|last2=Karl|first2=Irne E.|last3=Haymond|first3=Morey|last4=Kipnis|first4=David M.|date=April 1973|title=Hypoglycemia in infancy and childhood. Part II|url=https://linkinghub.elsevier.com/retrieve/pii/S0022347673805815|journal=The Journal of Pediatrics|volume=82|issue=4|pages=558–577|language=en|doi=10.1016/S0022-3476(73)80581-5}}</ref><ref name=":10">{{Cite journal|last=Kane|first=Charlotte|last2=Shepherd|first2=Ruth M.|last3=Squires|first3=Paul E.|last4=Johnson|first4=Paul R.V.|last5=James|first5=Roger F.L.|last6=Milla|first6=Peter J.|last7=Aynsley-Green|first7=Albert|last8=Lindley|first8=Keith J.|last9=Dunne|first9=Mark J.|date=1 December 1996|title=Loss of functional KATP channels in pancreatic β–cells causes persistent hyperinsulinemic hypoglycemia of infancy|url=http://www.nature.com/articles/nm1296-1344|journal=Nature Medicine|volume=2|issue=12|pages=1344–1347|language=en|doi=10.1038/nm1296-1344|issn=1078-8956}}</ref> |
|||
=== 出典 === |
|||
* {{仮リンク|嗜眠|en|Lethargy}}<ref name=":10" /><ref name=":11">{{Cite journal|last=Stanley|first=Charles A.|last2=Lieu|first2=Yen K.|last3=Hsu|first3=Betty Y.L.|last4=Burlina|first4=Alberto B.|last5=Greenberg|first5=Cheryl R.|last6=Hopwood|first6=Nancy J.|last7=Perlman|first7=Kusiel|last8=Rich|first8=Barry H.|last9=Zammarchi|first9=Enrico|date=1998-05-07|title=Hyperinsulinism and Hyperammonemia in Infants with Regulatory Mutations of the Glutamate Dehydrogenase Gene|url=http://www.nejm.org/doi/abs/10.1056/NEJM199805073381904|journal=New England Journal of Medicine|volume=338|issue=19|pages=1352–1357|language=en|doi=10.1056/NEJM199805073381904|issn=0028-4793|last10=Poncz|first10=Mortimer}}</ref> |
|||
* Jitteriness/振戦<ref name=":9" /><ref name=":10" /><ref name=":11" /><ref name=":12">{{Cite journal|last=Rosenfeld|first=Elizabeth|last2=De León|first2=Diva D.|date=2023-03-28|title=Bridging the gaps: recent advances in diagnosis, care, and outcomes in congenital hyperinsulinism|url=https://journals.lww.com/10.1097/MOP.0000000000001243|journal=Current Opinion in Pediatrics|volume=Publish Ahead of Print|language=en|doi=10.1097/MOP.0000000000001243|issn=1040-8703}}</ref> |
|||
* [[頻脈]]または[[徐脈]]<ref name=":13">{{Cite journal|last=Verkarre|first=V|last2=Fournet|first2=J C|last3=de Lonlay|first3=P|last4=Gross-Morand|first4=M S|last5=Devillers|first5=M|last6=Rahier|first6=J|last7=Brunelle|first7=F|last8=Robert|first8=J J|last9=Nihoul-Fékété|first9=C|date=1998-10-01|title=Paternal mutation of the sulfonylurea receptor (SUR1) gene and maternal loss of 11p15 imprinted genes lead to persistent hyperinsulinism in focal adenomatous hyperplasia.|url=http://www.jci.org/articles/view/4495|journal=Journal of Clinical Investigation|volume=102|issue=7|pages=1286–1291|language=en|doi=10.1172/JCI4495|issn=0021-9738|pmc=508975|pmid=9769320|last10=Saudubray|first10=J M|last11=Junien|first11=C}}</ref> |
|||
* 異常呼吸パターン/[[無呼吸]]<ref name=":9" /><ref name=":10" /> |
|||
* [[低体温症|低体温]]<ref name=":9" /><ref name=":10" /><ref name=":11" /> |
|||
* 異常な摂食行動(摂食のために目覚めることがない、哺乳困難、落ち着きがない、順調な授乳が続いた後に頻繁に授乳を要求する)<ref name=":9" /><ref name=":10" /><ref name=":11" /> |
|||
* 甲高い泣き声<ref name=":11" /> |
|||
* 筋緊張低下<ref name=":9" /><ref name=":10" /><ref name=":11" /> |
|||
* 蒼白/[[チアノーゼ]]<ref name=":9" /> |
|||
* 発汗<ref name=":10" /><ref name=":12" /> |
|||
より成長した小児や成人の症状には、頭痛、意識不鮮明、めまいなどがある<ref name=":13" />。 |
|||
親による最初の懸念や症状として、吸い付きが弱い、眠りがち、過敏などと表現されることが多い<ref name=":22">{{Cite journal|last=Banerjee|first=Indraneel|last2=Raskin|first2=Julie|last3=Arnoux|first3=Jean-Baptiste|last4=De Leon|first4=Diva D.|last5=Weinzimer|first5=Stuart A.|last6=Hammer|first6=Mette|last7=Kendall|first7=David M.|last8=Thornton|first8=Paul S.|date=2022-02-19|title=Congenital hyperinsulinism in infancy and childhood: challenges, unmet needs and the perspective of patients and families|url=https://ojrd.biomedcentral.com/articles/10.1186/s13023-022-02214-y|journal=Orphanet Journal of Rare Diseases|volume=17|issue=1|pages=61|language=en|doi=10.1186/s13023-022-02214-y|issn=1750-1172|pmc=8858501|pmid=35183224}}</ref>。 |
|||
低血糖状態が持続したり、極度の低血糖状態となった場合には、[[てんかん発作]](けいれん)などより重篤な症状が生じる場合がある<ref name=":9" /><ref name=":10" /><ref name=":12" /><ref name=":14">{{Cite journal|last=Otonkoski|first=Timo|last2=Näntö-Salonen|first2=Kirsti|last3=Seppänen|first3=Marko|last4=Veijola|first4=Riitta|last5=Huopio|first5=Hanna|last6=Hussain|first6=Khalid|last7=Tapanainen|first7=Päivi|last8=Eskola|first8=Olli|last9=Parkkola|first9=Riitta|date=January 2006|title=Noninvasive diagnosis of focal hyperinsulinism of infancy with [18F]-DOPA positron emission tomography|url=https://pubmed.ncbi.nlm.nih.gov/16380471|journal=Diabetes|volume=55|issue=1|pages=13–18|issn=0012-1797|pmid=16380471|last10=Ekström|first10=Klas|last11=Guiot|first11=Yves|last12=Rahier|first12=Jacques|last13=Laakso|first13=Markku|last14=Rintala|first14=Risto|last15=Nuutila|first15=Pirjo}}</ref>。血糖値が回復しない場合には、意識消失や脳損傷が生じる可能性がある<ref name=":14" />。 |
|||
何らかの低血糖症状がみられる場合には、簡易的な血糖測定が不可欠である<ref name=":26">{{Cite journal|last=Williams|first=A. F.|date=1997|title=Hypoglycaemia of the newborn: a review|url=https://pubmed.ncbi.nlm.nih.gov/9277014|journal=Bulletin of the World Health Organization|volume=75|issue=3|pages=261–290|issn=0042-9686|pmc=2486945|pmid=9277014}}</ref>。 |
|||
== 原因 == |
|||
高インスリン血症(HI)や先天性高インスリン血症(CHI)には、遺伝的要因と後天的要因の双方がありうる。後天的要因によるものとしては、{{仮リンク|胎児発育不全|en|Intrauterine growth restriction}}、{{仮リンク|周産期仮死|en|Perinatal asphyxia}}、[[妊娠糖尿病]]など周産期の因子によって二次的に生じたものの可能性があり、これらはまとめてperinatal stress-induced HI(周産期ストレス誘発性HI)と呼ばれることも多い。こうした症状は出生後24時間以内にみられるのが一般的であり、多くの場合2週以内に消失する<ref name=":27">{{Cite journal|last=Bailey|first=Miranda J.|last2=Rout|first2=Allie|last3=Harding|first3=Jane E.|last4=Alsweiler|first4=Jane M.|last5=Cutfield|first5=Wayne S.|last6=McKinlay|first6=Christopher J. D.|date=5 December 2020|title=Prolonged transitional neonatal hypoglycaemia: characterisation of a clinical syndrome|url=http://www.nature.com/articles/s41372-020-00891-w|journal=Journal of Perinatology|volume=41|issue=5|pages=1149–1157|language=en|doi=10.1038/s41372-020-00891-w|issn=0743-8346}}</ref><ref name=":28">{{Cite journal|last=Hoe|first=Francis M.|last2=Thornton|first2=Paul S.|last3=Wanner|first3=Laura A.|last4=Steinkrauss|first4=Linda|last5=Simmons|first5=Rebecca A.|last6=Stanley|first6=Charles A.|date=20 February 2006|title=Clinical features and insulin regulation in infants with a syndrome of prolonged neonatal hyperinsulinism|url=https://linkinghub.elsevier.com/retrieve/pii/S0022347605009832|journal=The Journal of Pediatrics|volume=148|issue=2|pages=207–212|language=en|doi=10.1016/j.jpeds.2005.10.002}}</ref>。 |
|||
周産期ストレスによる低血糖とは対照的に、CHIは遺伝的要因によるものもある。そのため、後天的要因の可能性が低い小児に対しては[[遺伝子検査]]が考慮に入れられる。こうしたケースには、第一選択薬となる{{仮リンク|ジアゾキシド|en|Diazoxide}}に反応しない場合などが含まれる。ジアゾキシドに反応するものの低血糖が4ヶ月以降も持続する小児に対しても、遺伝子検査が行われる場合がある<ref name=":0">{{cite book |last1=G.P |first1=TALWAR |title=TEXTBOOK OF BIOCHEMISTRY, BIOTECHNOLOGY, ALLIED AND MOLECULAR MEDICINE |date=2016 |publisher=PHI Learning Pvt. Ltd. |isbn=9788120351257 |page=240 |url=https://books.google.com/books?id=mVuNCwAAQBAJ&q=congenital+hyperinsulinism+cardiomegaly&pg=PA240 |accessdate=29 January 2017 |language=en}}</ref><ref name=":1">{{cite journal|last1=James|first1=C.|last2=Kapoor|first2=R. R.|last3=Ismail|first3=D.|last4=Hussain|first4=K.|date=1 May 2009|title=The genetic basis of congenital hyperinsulinism|url=http://jmg.bmj.com/content/46/5/289.long|journal=Journal of Medical Genetics|volume=46|issue=5|pages=289–299|language=en|accessdate=29 January 2017|doi=10.1136/jmg.2008.064337|issn=1468-6244|pmid=19254908|doi-access=free}}</ref>。 |
|||
CHIの遺伝的要因は多くあり、症状が単独で出現する場合(非症候群性、isolated form)と、より広範囲の疾患(症候群)の一部として症状がみられる場合(症候群性、syndromic form)がある<ref name=":2">{{cite journal|last1=Arnoux|first1=Jean-Baptiste|last2=Verkarre|first2=Virginie|last3=Saint-Martin|first3=Cécile|last4=Montravers|first4=Françoise|last5=Brassier|first5=Anaïs|last6=Valayannopoulos|first6=Vassili|last7=Brunelle|first7=Francis|last8=Fournet|first8=Jean-Christophe|last9=Robert|first9=Jean-Jacques|date=1 January 2011|title=Congenital hyperinsulinism: current trends in diagnosis and therapy|journal=Orphanet Journal of Rare Diseases|volume=6|pages=63|doi=10.1186/1750-1172-6-63|issn=1750-1172|pmc=3199232|pmid=21967988|last10=Aigrain|first10=Yves|last11=Bellanné-Chantelot|first11=Christine|last12=de Lonlay|first12=Pascale}}</ref>。 |
|||
=== 非症候群性 === |
|||
非症候群性の高インスリン血症は、CHIの大部分を占める。最も一般的な遺伝的要因は、[[カリウムチャネル]]([[ATP感受性カリウムチャネル|K<sub>ATP</sub>チャネル]])の構成要素をコードする遺伝子(''{{仮リンク|ABCC8|en|ABCC8}}''もしくは''{{仮リンク|KCNJ11|en|Kir6.2}}'')の一方または双方のコピーの変化である<ref name=":29">{{Cite journal|last=Kapoor|first=Ritika R|last2=Flanagan|first2=Sarah E|last3=Arya|first3=Ved Bhushan|last4=Shield|first4=Julian P|last5=Ellard|first5=Sian|last6=Hussain|first6=Khalid|date=1 April 2013|title=Clinical and molecular characterisation of 300 patients with congenital hyperinsulinism|url=https://academic.oup.com/ejendo/article/168/4/557/6659608|journal=European Journal of Endocrinology|volume=168|issue=4|pages=557–564|doi=10.1530/EJE-12-0673|issn=0804-4643|pmc=3599069|pmid=23345197}}</ref><ref name=":15">{{Cite journal|last=Snider|first=K. E.|last2=Becker|first2=S.|last3=Boyajian|first3=L.|last4=Shyng|first4=S.-L.|last5=MacMullen|first5=C.|last6=Hughes|first6=N.|last7=Ganapathy|first7=K.|last8=Bhatti|first8=T.|last9=Stanley|first9=C. A.|date=1 February 2013|title=Genotype and Phenotype Correlations in 417 Children With Congenital Hyperinsulinism|url=https://academic.oup.com/jcem/article-lookup/doi/10.1210/jc.2012-2169|journal=The Journal of Clinical Endocrinology & Metabolism|volume=98|issue=2|pages=E355–E363|language=en|doi=10.1210/jc.2012-2169|issn=0021-972X|pmc=3565119|pmid=23275527|last10=Ganguly|first10=A.}}</ref>。このチャネルは通常は[[膵臓]]の[[β細胞]]において血糖値に応答したインスリン産生を調節しているが、チャネルの変化や欠陥によって無制御かつ過剰なインスリン産生が行われるようになる。こうした''ABCC8''もしくは''KCNJ11''遺伝子の変化によるCHIは優性遺伝する場合も劣性遺伝する場合もある。優性型の場合、一方の親から遺伝した1つの変化(もしくは散発的に生じた変化)によってびまん性のCHIが引き起こされる。びまん性CHIでは、膵臓全体が影響を受ける。優性型のCHIは軽症でジアゾキシドに反応する場合も、重症でジアゾキシドに反応しない場合もある。''ABCC8''もしくは''KCNJ11''遺伝子の変化によるCHIの一部は劣性遺伝する。こうした家系では、両親はそれぞれ1コピーずつ欠陥遺伝子を保有しているが、発症に至ることはない。子が両親から1つずつ欠陥遺伝子を受け継いだ場合、CHIを発症する。一般的に劣性型は、ジアゾキシド不応性のびまん性CHIを引き起こす。一部の症例では、父親由来の欠陥遺伝子の遺伝と膵臓内での母親由来の正常コピーの喪失との組み合わせによってCHIが引きこされている場合がある。こうしたケースでは局所性のCHIとなり、膵臓の一部(局所性病変)でのみインスリンか過剰産生される<ref name=":0" /><ref name=":30">{{Cite journal|last=de Lonlay|first=P|last2=Fournet|first2=J C|last3=Rahier|first3=J|last4=Gross-Morand|first4=M S|last5=Poggi-Travert|first5=F|last6=Foussier|first6=V|last7=Bonnefont|first7=J P|last8=Brusset|first8=M C|last9=Brunelle|first9=F|date=1997-08-15|title=Somatic deletion of the imprinted 11p15 region in sporadic persistent hyperinsulinemic hypoglycemia of infancy is specific of focal adenomatous hyperplasia and endorses partial pancreatectomy.|url=http://www.jci.org/articles/view/119594|journal=Journal of Clinical Investigation|volume=100|issue=4|pages=802–807|language=en|doi=10.1172/JCI119594|issn=0021-9738|pmc=508251|pmid=9259578|last10=Robert|first10=J J|last11=Nihoul-Fékété|first11=C|last12=Saudubray|first12=J M|last13=Junien|first13=C}}</ref><ref name=":3">{{cite web |title=Blood Glucose Monitoring - National Library of Medicine |url=https://www.ncbi.nlm.nih.gov/pubmedhealth/PMHT0024698/ |website=PubMed Health |accessdate=27 January 2017}}</ref>。 |
|||
重症のCHIで医薬品に反応しない場合には、''ABCC8''、''KCNJ11''遺伝子の迅速な検査が推奨される。この検査は、疾患初期に局所性CHIの可能性を特定するために有用である。遺伝子検査後には、{{仮リンク|フルオロドパ (18F)|en|Fluorodopa|label=<sup>18</sup>F-DOPA}}を用いた[[ポジトロン断層法|ポジトロン断層撮影]](PET)によって外科的除去を行う局所性病変を特定する。遺伝子検査は''ABCC8''もしくは''KCNJ11''遺伝子の双方のコピーが欠陥を有するかどうかを明らかにするためにも有用であり、両コピーに欠陥がみられる場合にはジアゾキシド不応性のびまん性CHIと診断される。こうした症例は[[オクトレオチド]]などの代替的な医薬品による治療を必要とし、膵臓の大部分の外科的除去が必要となる可能性がある。このように、重症CHIの小児に対する内科的・外科的管理の指針として、早期の迅速な遺伝子検査は重要である。CHIに関する遺伝子検査の結果は、CHIに関して経験豊富で専門的知識を有する[[分子遺伝学]]研究室で解析されることが望ましい<ref name=":1" /><ref name=":2" /><ref name=":3" /><ref name=":5">{{Cite journal|last1=Sprague|first1=Jennifer E.|last2=Arbeláez|first2=Ana María|date=2017-01-27|title=Glucose Counterregulatory Responses to Hypoglycemia|journal=Pediatric Endocrinology Reviews|volume=9|issue=1|pages=463–475|issn=1565-4753|pmc=3755377|pmid=22783644}}</ref>。 |
|||
CHIの原因として一般的な他の遺伝的要因には、[[グルタミン酸デヒドロゲナーゼ]](GDH)をコードする遺伝子''{{仮リンク|GLUD1|en|Glutamate dehydrogenase 1}}''の変化がある。このタイプはGDH-CHIもしくはGLUD1-CHIと呼ばれる。このタイプのCHIは優性遺伝するが、散発性のものである可能性もある。このタイプのCHIでは、血中[[アンモニア]]濃度が緩やかに上昇する。GDH-CHIの小児や成人はジアゾキシドに反応することが多い。食事中のタンパク質の過剰によって低血糖がもたらされるため、炭水化物とタンパク質の比率を適切にすることが勧められる。非症状群性CHIの遺伝的要因は他にも多くあり、[[3-ヒドロキシアシルCoAデヒドロゲナーゼ|ヒドロキシアシルCoAデヒドロゲナーゼ]](SCHAD-CHI)や[[グルコキナーゼ]](GCK-CHI)の変異のほか、近年ではグルコキナーゼに類似した酵素{{仮リンク|HK1|en|HK1}}も軽症型・重症型双方の原因となることが特定されている<ref name=":1" /><ref name=":3" /><ref name=":31">{{Cite journal|last=Maiorana|first=Arianna|last2=Lepri|first2=Francesca Romana|last3=Novelli|first3=Antonio|last4=Dionisi-Vici|first4=Carlo|date=2022-03-29|title=Hypoglycaemia Metabolic Gene Panel Testing|url=https://www.frontiersin.org/articles/10.3389/fendo.2022.826167/full|journal=Frontiers in Endocrinology|volume=13|pages=826167|doi=10.3389/fendo.2022.826167|issn=1664-2392|pmc=9001947|pmid=35422763}}</ref>。 |
|||
=== 症候群性 === |
|||
症候群性のCHIは非症候群性CHIと比較して少数であり、疾患レジストリのデータからは報告症例の1%未満であることが示唆されている<ref name=":6">{{Cite journal|last1=Yang|first1=Jigang|last2=Hao|first2=Ruirui|last3=Zhu|first3=Xiaohua|date=April 2013|title=Diagnostic role of 18F-dihydroxyphenylalanine positron emission tomography in patients with congenital hyperinsulinism: a meta-analysis|journal=Nuclear Medicine Communications|volume=34|issue=4|pages=347–353|doi=10.1097/MNM.0b013e32835e6ac6|issn=1473-5628|pmid=23376859|s2cid=30804790}}</ref>。症候群性CHIは、遺伝的要因が一般的である<ref name=":33">{{Cite journal|last=Zenker|first=Martin|last2=Mohnike|first2=Klaus|last3=Palm|first3=Katja|date=2023-03-30|title=Syndromic forms of congenital hyperinsulinism|url=https://www.frontiersin.org/articles/10.3389/fendo.2023.1013874/full|journal=Frontiers in Endocrinology|volume=14|pages=1013874|doi=10.3389/fendo.2023.1013874|issn=1664-2392|pmc=10098214|pmid=37065762}}</ref>。{{仮リンク|ベックウィズ-ヴィーデマン症候群|en|Beckwith–Wiedemann syndrome}}(BWS)は、症候群性CHIの原因としてよく知られた過成長症候群である。CHIを一般的な特徴とする他の症候群には、[[歌舞伎症候群]]や[[ターナー症候群]]がある。症候群性CHIの大部分はジアゾキシド治療に反応し、CHIは経時的に軽快する可能性があるが、BWSに伴うCHIは重症型で通常の治療に反応しない場合もある<ref name=":34">{{Cite journal|last=Brioude|first=Frédéric|last2=Kalish|first2=Jennifer M.|last3=Mussa|first3=Alessandro|last4=Foster|first4=Alison C.|last5=Bliek|first5=Jet|last6=Ferrero|first6=Giovanni Battista|last7=Boonen|first7=Susanne E.|last8=Cole|first8=Trevor|last9=Baker|first9=Robert|date=29 January 2018|title=Clinical and molecular diagnosis, screening and management of Beckwith–Wiedemann syndrome: an international consensus statement|url=http://www.nature.com/articles/nrendo.2017.166|journal=Nature Reviews Endocrinology|volume=14|issue=4|pages=229–249|language=en|doi=10.1038/nrendo.2017.166|issn=1759-5029|pmc=6022848|pmid=29377879|last10=Bertoletti|first10=Monica|last11=Cocchi|first11=Guido|last12=Coze|first12=Carole|last13=De Pellegrin|first13=Maurizio|last14=Hussain|first14=Khalid|last15=Ibrahim|first15=Abdulla}}</ref><ref name=":35">{{Cite journal|last=Wang|first=Kathleen H.|last2=Kupa|first2=Jonida|last3=Duffy|first3=Kelly A.|last4=Kalish|first4=Jennifer M.|date=2020-01-21|title=Diagnosis and Management of Beckwith-Wiedemann Syndrome|url=https://www.frontiersin.org/article/10.3389/fped.2019.00562/full|journal=Frontiers in Pediatrics|volume=7|pages=562|doi=10.3389/fped.2019.00562|issn=2296-2360|pmc=6990127|pmid=32039119}}</ref><ref name=":36">{{Citation|title=Syndromic Causes of Congenital Hyperinsulinism|last=Kalish|first=Jennifer M.|last2=Arnoux|first2=Jean-Baptiste|date=2019|url=http://link.springer.com/10.1007/978-3-030-02961-6_4|work=Congenital Hyperinsulinism|publisher=Springer International Publishing|editor-last=De León-Crutchlow|editor-first=Diva D.|pages=49–59|place=Cham|isbn=978-3-030-02960-9|editor2-last=Stanley|editor2-first=Charles A.|doi=10.1007/978-3-030-02961-6_4|access-date=2023-05-08}}</ref>。 |
|||
== 診断 == |
|||
[[File:Ketone-group-2D-skeletal.svg|thumb|130 px|ケトン体(低値が高インスリン血症の指標となる)]] |
|||
CHIは膵臓β細胞のインスリン分泌の調節不全を原因とする。低血糖時にはインスリンは抑制されず血中に存在する。インスリン濃度は変動するため、測定は困難な場合がある。CHIの診断は、低血糖時のインスリン作用の亢進や血漿インスリンの不十分な抑制をもとに行われる。インスリン作用の亢進は、グルコース必要量の増加によって示される(一例として、新生児の正常値4-6 mg/kg/分に対し、8 mg/kg/分以上)<ref name=":4">{{Cite journal|last=Bier|first=Dennis M|last2=Leake|first2=Rosemary D|last3=Haymond|first3=Morey W|last4=Arnold|first4=Kenneth J|last5=Gruenke|first5=Larry D|last6=Sperling|first6=Mark A|last7=Kipnis|first7=David M|date=1977-11-01|title=Measurement of “True” Glucose Production Rates in Infancy and Childhood with 6,6-Dideuteroglucose|url=https://diabetesjournals.org/diabetes/article/26/11/1016/4344/Measurement-of-True-Glucose-Production-Rates-in|journal=Diabetes|volume=26|issue=11|pages=1016–1023|language=en|doi=10.2337/diab.26.11.1016|issn=0012-1797}}</ref>。過剰なインスリン作用の他の徴候としては、低血糖時の[[遊離脂肪酸]]や[[ケトン体]]([[3-ヒドロキシ酪酸|β-ヒドロキシ酪酸]])の血中濃度の低下が挙げられる。臨床診断は低血糖時[[グルカゴン]]投与後の血糖値の大幅な上昇によっても支持される<ref name=":37">{{Cite journal|last=Palladino|first=Andrew A|last2=Bennett|first2=Michael J|last3=Stanley|first3=Charles A|date=2008-02-01|title=Hyperinsulinism in Infancy and Childhood: When an Insulin Level Is Not Always Enough|url=https://academic.oup.com/clinchem/article/54/2/256/5628508|journal=Clinical Chemistry|volume=54|issue=2|pages=256–263|language=en|doi=10.1373/clinchem.2007.098988|issn=0009-9147}}</ref><ref name=":38">{{Cite journal|last=Ferrara|first=Christine|last2=Patel|first2=Payal|last3=Becker|first3=Susan|last4=Stanley|first4=Charles A.|last5=Kelly|first5=Andrea|date=17 October 2015|title=Biomarkers of Insulin for the Diagnosis of Hyperinsulinemic Hypoglycemia in Infants and Children|url=https://linkinghub.elsevier.com/retrieve/pii/S0022347615010586|journal=The Journal of Pediatrics|volume=168|pages=212–219|language=en|doi=10.1016/j.jpeds.2015.09.045}}</ref><ref name=":39">{{Cite journal|last=Sakakibara|first=Azumi|last2=Hashimoto|first2=Yukiko|last3=Kawakita|first3=Rie|last4=Hosokawa|first4=Yuki|last5=Nagahara|first5=Keiko|last6=Hasegawa|first6=Yukihiro|last7=Hoshino|first7=Shin|last8=Nagasaka|first8=Hironori|last9=Yorifuji|first9=Tohru|date=9 June 2017|title=Diagnosis of congenital hyperinsulinism: Biochemical profiles during hypoglycemia|url=https://onlinelibrary.wiley.com/doi/10.1111/pedi.12548|journal=Pediatric Diabetes|volume=19|issue=2|pages=259–264|language=en|doi=10.1111/pedi.12548}}</ref>。グルカゴンは膵臓から分泌される他のホルモンであり、インスリンの作用に対抗して[[肝臓]]に貯蔵されている[[グリコーゲン]]からグルコースの放出を刺激する。インスリン、[[C-ペプチド]](インスリンと共に分泌される)、遊離脂肪酸、ケトン体濃度の測定やグルカゴン負荷試験は、自然に生じた低血糖時や管理下絶食によって誘発された低血糖時に行われる。新生児の場合、出生後72時間以内は一過性低血糖の期間であるため、臨床診断は72時間経過後に行うのが最善である<ref name=":24">{{Cite journal|last=Stanley|first=Charles A.|date=1 March 2016|title=Perspective on the Genetics and Diagnosis of Congenital Hyperinsulinism Disorders|url=https://academic.oup.com/jcem/article-lookup/doi/10.1210/jc.2015-3651|journal=The Journal of Clinical Endocrinology & Metabolism|volume=101|issue=3|pages=815–826|language=en|doi=10.1210/jc.2015-3651|issn=0021-972X|pmc=4803157|pmid=26908106}}</ref>。血中アンモニア、アシル[[カルニチン]]分析、尿中代謝物分析、タンパク質やアミノ酸([[ロイシン]])に対する応答の検査は、CHIのサブタイプの決定に有用である可能性がある<ref name=":42">{{Cite journal|last=Palladino|first=Andrew A.|last2=Stanley|first2=Charles A.|date=9 October 2010|title=The hyperinsulinism/hyperammonemia syndrome|url=http://link.springer.com/10.1007/s11154-010-9146-0|journal=Reviews in Endocrine and Metabolic Disorders|volume=11|issue=3|pages=171–178|language=en|doi=10.1007/s11154-010-9146-0|issn=1389-9155}}</ref><ref name=":40">{{Cite journal|last=Zhang|first=Wei|last2=Sang|first2=Yan-Mei|date=4 November 2021|title=Genetic pathogenesis, diagnosis, and treatment of short-chain 3-hydroxyacyl-coenzyme A dehydrogenase hyperinsulinism|url=https://ojrd.biomedcentral.com/articles/10.1186/s13023-021-02088-6|journal=Orphanet Journal of Rare Diseases|volume=16|issue=1|pages=467|language=en|doi=10.1186/s13023-021-02088-6|issn=1750-1172|pmc=8567654|pmid=34736508}}</ref><ref name=":41">{{Cite journal|last=Kelly|first=Andrea|last2=Ng|first2=Diva|last3=Ferry|first3=Robert J.|last4=Grimberg|first4=Adda|last5=Koo-McCoy|first5=Samantha|last6=Thornton|first6=Paul S.|last7=Stanley|first7=Charles A.|date=2001-08-01|title=Acute Insulin Responses to Leucine in Children with the Hyperinsulinism/Hyperammonemia Syndrome|url=https://academic.oup.com/jcem/article/86/8/3724/2848874|journal=The Journal of Clinical Endocrinology & Metabolism|volume=86|issue=8|pages=3724–3728|language=en|doi=10.1210/jcem.86.8.7755|issn=0021-972X|pmc=3313679|pmid=11502802}}</ref><ref name=":43">{{Cite journal|last=Fourtner|first=Shannon H.|last2=Stanley|first2=Charles A.|last3=Kelly|first3=Andrea|date=July 2006|title=Protein-sensitive hypoglycemia without leucine sensitivity in hyperinsulinism caused by KATP channel mutations|url=https://linkinghub.elsevier.com/retrieve/pii/S0022347606001296|journal=The Journal of Pediatrics|volume=149|issue=1|pages=47–52|language=en|doi=10.1016/j.jpeds.2006.02.033}}</ref>。 |
|||
== 治療 == |
|||
[[File:Diazoxide 3d.png|thumb|ジアゾキシド]] |
|||
[[File:Diagram showing the area removed for surgery to remove all of the pancreas (total pancreatectomy) CRUK 287.svg|thumb|right|膵切除術によって除去される領域を示した模式図]] |
|||
高インスリン血症の治療目標は低血糖による脳損傷を防ぐことであり、血糖値を正常範囲 [>70 mg/dL (3.9 mmol/L)] に維持することが目標となる。第一段階は急性低血糖後の血糖値の正常範囲への回復であり、続いてCHIで一般的な再発性低血糖の防止となる。 |
|||
最初の治療としてはグルコースの静注が最も効果的となる。遺伝子型や表現型などによってCHIの診断が確定すると、特異的治療が開始される。よく試みられる治療法を次に挙げる。 |
|||
* 栄養療法: 経腸栄養({{仮リンク|経鼻胃管挿管|en|Nasogastric intubation|label=経鼻}}、[[胃瘻造設術|胃ろう]])による炭水化物(ブドウ糖、フォーミュラ)の持続注入<ref name=":9" /> |
|||
* インスリン分泌を抑える医薬品: ジアゾキシド、オクトレオチドや[[ランレオチド]]など[[ソマトスタチン]]アナログ<ref name=":44">{{Cite journal|last=Yorifuji|first=Tohru|date=2014-06|title=Congenital hyperinsulinism: current status and future perspectives|url=https://pubmed.ncbi.nlm.nih.gov/25077087|journal=Annals of Pediatric Endocrinology & Metabolism|volume=19|issue=2|pages=57–68|doi=10.6065/apem.2014.19.2.57|issn=2287-1012|pmc=4114053|pmid=25077087}}</ref> |
|||
* インスリン作用に対抗する医薬品: グルカゴン<ref name=":44" /> |
|||
* 膵臓の一部またはほぼ全域を除去する外科手術([[膵切除術]])<ref name=":44" /> |
|||
ジアゾキシドはK<sub>ATP</sub>チャネル開口薬であり、K<sub>ATP</sub>チャネルの{{仮リンク|ABCC8|en|ABCC8|label=SUR1}}サブユニットに結合することでインスリン分泌を阻害する。ジアゾキシドはCHIの治療に承認されている唯一の医薬品であり、この疾患の治療における第一選択薬である<ref name=":45">{{Cite journal|last=Brar|first=Preneet Cheema|last2=Heksch|first2=Ryan|last3=Cossen|first3=Kristina|last4=De Leon|first4=Diva D|last5=Kamboj|first5=Manmohan K|last6=Marks|first6=Seth D|last7=Marshall|first7=Bess A|last8=Miller|first8=Ryan|last9=Page|first9=Laura|date=2020-12-01|title=Management and Appropriate Use of Diazoxide in Infants and Children with Hyperinsulinism|url=https://academic.oup.com/jcem/article/105/12/3750/5894029|journal=The Journal of Clinical Endocrinology & Metabolism|volume=105|issue=12|pages=3750–3761|language=en|doi=10.1210/clinem/dgaa543|issn=0021-972X|last10=Stanley|first10=Takara|last11=Mitchell|first11=Deborah|last12=Thornton|first12=Paul}}</ref>。ジアゾキシドによる体液貯留の副作用を防ぐため、[[利尿薬]]による治療が同時に開始されるのが一般的である。用量の選択と漸増は、反応と副作用を注意深く考慮しながら行う。半減期は長いため、十分な治療効果が得られるには最大で5日かかる可能性がある。次の重要な段階はジアゾキシド反応性の評価であり、診断と治療において重要な意味を持つ。ジアゾキシド反応性の判断は、CHIの主要な特徴である低ケトン性低血糖の改善をもとに行われる。ジアゾキシド反応性は絶食試験による評価が最善であり、血漿グルコース濃度が70 mg/dL(3.9 mmol/L)以上の状態で12–18時間の絶食が可能であること、または絶食時に血漿グルコース濃度が50–60 mg/dL(2.8–3.3 mmol/L)未満に減少する前に血漿β-ヒドロキシ酪酸濃度が1.8 mmol/L以上に増加することで示される。ジアゾキシド不応性は、CHIがK<sub>ATP</sub>チャネルをコードする遺伝子の不活性化変異によるものである可能性を示唆する。こうした症例では、局所性CHIの可能性を明らかにするために''ABCC8''または''KCNJ11''遺伝子の迅速な遺伝子検査が重要である<ref name=":153">{{Cite journal|last=Snider|first=K. E.|last2=Becker|first2=S.|last3=Boyajian|first3=L.|last4=Shyng|first4=S.-L.|last5=MacMullen|first5=C.|last6=Hughes|first6=N.|last7=Ganapathy|first7=K.|last8=Bhatti|first8=T.|last9=Stanley|first9=C. A.|date=1 February 2013|title=Genotype and Phenotype Correlations in 417 Children With Congenital Hyperinsulinism|url=https://academic.oup.com/jcem/article-lookup/doi/10.1210/jc.2012-2169|journal=The Journal of Clinical Endocrinology & Metabolism|volume=98|issue=2|pages=E355–E363|language=en|doi=10.1210/jc.2012-2169|issn=0021-972X|pmc=3565119|pmid=23275527|last10=Ganguly|first10=A.}}</ref>。 |
|||
局所性CHIには手術が治療選択となるが、手術前に病変部位を特定することが重要である。こうした病変は[[超音波検査]]や[[コンピュータ断層撮影|CTスキャン]]、[[核磁気共鳴画像法|MRI]]といった従来のイメージング手法で可視化することはできない。しかしながら、<sup>18</sup>F-DOPAを用いたPETスキャンによってほぼ100%正確に局所病変を特定することが可能である<ref name=":46">{{Cite journal|last=States|first=Lisa J.|last2=Saade-Lemus|first2=Sandra|last3=De Leon|first3=Diva D.|date=July 2020|title=18-F-L 3,4-Dihydroxyphenylalanine PET/Computed Tomography in the Management of Congenital Hyperinsulinism|url=https://linkinghub.elsevier.com/retrieve/pii/S155685982030016X|journal=PET Clinics|volume=15|issue=3|pages=349–359|language=en|doi=10.1016/j.cpet.2020.03.004}}</ref>。術中凍結組織検体を用いた膵臓組織の専門家による評価と手術の専門的技術が成功の鍵となる。局所性CHIの治癒率は97%と報告されている<ref name=":162">{{Cite journal|last=Adzick|first=N. Scott|last2=De Leon|first2=Diva D.|last3=States|first3=Lisa J.|last4=Lord|first4=Katherine|last5=Bhatti|first5=Tricia R.|last6=Becker|first6=Susan A.|last7=Stanley|first7=Charles A.|date=18 October 2018|title=Surgical treatment of congenital hyperinsulinism: Results from 500 pancreatectomies in neonates and children|url=https://linkinghub.elsevier.com/retrieve/pii/S0022346818306481|journal=Journal of Pediatric Surgery|volume=54|issue=1|pages=27–32|language=en|doi=10.1016/j.jpedsurg.2018.10.030|pmc=6339589|pmid=30343978}}</ref>。 |
|||
局所性でないジアゾキシド不応性症例の場合、治療オプションは限られている。ソマトスタチンアナログであるオクトレオチドの適応外処方は、CHIの治療におけるセカンドライン治療として長く用いられているが<ref name=":172">{{Cite journal|last=Welters|first=Alena|last2=Lerch|first2=Christian|last3=Kummer|first3=Sebastian|last4=Marquard|first4=Jan|last5=Salgin|first5=Burak|last6=Mayatepek|first6=Ertan|last7=Meissner|first7=Thomas|date=25 November 2015|title=Long-term medical treatment in congenital hyperinsulinism: a descriptive analysis in a large cohort of patients from different clinical centers|url=http://www.ojrd.com/content/10/1/150|journal=Orphanet Journal of Rare Diseases|volume=10|issue=1|pages=150|language=en|doi=10.1186/s13023-015-0367-x|issn=1750-1172|pmc=4660626|pmid=26608306}}</ref>、その効果は[[タキフィラキシー]]によって限定的なものとなる。ジアゾキシドを用いることができない地域では、オクトレオチドが第一選択薬となる可能性がある。オクトレオチドは致死的な[[壊死性腸炎]]と関係している可能性があるため、新生児に対する使用はリスクとベネフィットを注意深く考慮して行うべきである<ref name=":47">{{Cite journal|last=McMahon|first=Ann W.|last2=Wharton|first2=Gerold T.|last3=Thornton|first3=Paul|last4=De Leon|first4=Diva D.|date=2 December 2016|title=Octreotide use and safety in infants with hyperinsulinism: Octreotide Use and Safety|url=https://onlinelibrary.wiley.com/doi/10.1002/pds.4144|journal=Pharmacoepidemiology and Drug Safety|volume=26|issue=1|pages=26–31|language=en|doi=10.1002/pds.4144|pmc=5286465|pmid=27910218}}</ref>。オクトレオチドは一般的には6時間ごとに[[皮下注射]]によって投与されるが、ポンプを用いた持続皮下注射も可能である。長時間作用型ソマトスタチンアナログであるオクトレオチドLAR([[筋肉内注射]])やランレオチド(深部皮下注射)は、より年長児にとって便利なオプションとなる。オクトレオチドが適応外もしくは不応性のジアゾキシド不応性症例に対する代替的な治療アプローチは胃ろうを介したブドウ糖の持続注入となる<ref name=":48">{{Cite journal|last=Vajravelu|first=Mary Ellen|last2=Congdon|first2=Morgan|last3=Mitteer|first3=Lauren|last4=Koh|first4=Jamie|last5=Givler|first5=Stephanie|last6=Shults|first6=Justine|last7=De León|first7=Diva D.|date=7 August 2018|title=Continuous Intragastric Dextrose: A Therapeutic Option for Refractory Hypoglycemia in Congenital Hyperinsulinism|url=https://www.karger.com/Article/FullText/491105|journal=Hormone Research in Paediatrics|volume=91|issue=1|pages=62–68|language=en|doi=10.1159/000491105|issn=1663-2818|pmc=6661174|pmid=30086540}}</ref>。 |
|||
== 予後 == |
|||
CHI患者の予後は、診断の遅れの影響、治療の副作用、治療の効果などの影響を受ける。 |
|||
ジアゾキシドやソマトスタチンアナログによる治療を行った小児では副作用は一般的であり、さまざまな重症度の治療患者の最大50%が影響を受ける<ref name=":49">{{Cite journal|last=Avatapalle|first=B.|last2=Padidela|first2=R.|last3=Randell|first3=T.|last4=Banerjee|first4=I.|date=2012-07-30|title=Drug-induced hepatitis following use of octreotide for long-term treatment of congenital hyperinsulinism|url=https://casereports.bmj.com/lookup/doi/10.1136/bcr-2012-006271|journal=Case Reports|volume=2012|issue=jul30 1|pages=bcr2012006271–bcr2012006271|language=en|doi=10.1136/bcr-2012-006271|issn=1757-790X|pmc=4543377|pmid=22850563}}</ref><ref name=":50">{{Cite journal|last=Cuff|first=Heather|last2=Lord|first2=Katherine|last3=Ballester|first3=Lance|last4=Scully|first4=Tryce|last5=Stewart|first5=Nicole|last6=De Leon|first6=Diva D|date=2022-07-14|title=The Use of Lanreotide in the Treatment of Congenital Hyperinsulinism|url=https://academic.oup.com/jcem/article/107/8/e3115/6589462|journal=The Journal of Clinical Endocrinology & Metabolism|volume=107|issue=8|pages=e3115–e3120|language=en|doi=10.1210/clinem/dgac322|issn=0021-972X}}</ref><ref name=":18">{{Cite journal|last=Herrera|first=Adriana|last2=Vajravelu|first2=Mary Ellen|last3=Givler|first3=Stephanie|last4=Mitteer|first4=Lauren|last5=Avitabile|first5=Catherine M|last6=Lord|first6=Katherine|last7=De León|first7=Diva D|date=2018-12-01|title=Prevalence of Adverse Events in Children With Congenital Hyperinsulinism Treated With Diazoxide|url=https://academic.oup.com/jcem/article/103/12/4365/5104459|journal=The Journal of Clinical Endocrinology & Metabolism|volume=103|issue=12|pages=4365–4372|language=en|doi=10.1210/jc.2018-01613|issn=0021-972X|pmc=6207144|pmid=30247666}}</ref><ref name=":51">{{Cite journal|last=Thornton|first=Paul|last2=Truong|first2=Lisa|last3=Reynolds|first3=Courtney|last4=Hamby|first4=Tyler|last5=Nedrelow|first5=Jonathan|date=19 March 2019|title=Rate of Serious Adverse Events Associated with Diazoxide Treatment of Patients with Hyperinsulinism|url=https://www.karger.com/Article/FullText/497458|journal=Hormone Research in Paediatrics|volume=91|issue=1|pages=25–32|language=en|doi=10.1159/000497458|issn=1663-2818}}</ref><ref name=":17">{{Cite journal|last=Welters|first=Alena|last2=Lerch|first2=Christian|last3=Kummer|first3=Sebastian|last4=Marquard|first4=Jan|last5=Salgin|first5=Burak|last6=Mayatepek|first6=Ertan|last7=Meissner|first7=Thomas|date=25 November 2015|title=Long-term medical treatment in congenital hyperinsulinism: a descriptive analysis in a large cohort of patients from different clinical centers|url=http://www.ojrd.com/content/10/1/150|journal=Orphanet Journal of Rare Diseases|volume=10|issue=1|pages=150|language=en|doi=10.1186/s13023-015-0367-x|issn=1750-1172|pmc=4660626|pmid=26608306}}</ref>。局所性CHIの小児の手術予後は優れており、治癒率は97%である<ref name=":16">{{Cite journal|last=Adzick|first=N. Scott|last2=De Leon|first2=Diva D.|last3=States|first3=Lisa J.|last4=Lord|first4=Katherine|last5=Bhatti|first5=Tricia R.|last6=Becker|first6=Susan A.|last7=Stanley|first7=Charles A.|date=18 October 2018|title=Surgical treatment of congenital hyperinsulinism: Results from 500 pancreatectomies in neonates and children|url=https://linkinghub.elsevier.com/retrieve/pii/S0022346818306481|journal=Journal of Pediatric Surgery|volume=54|issue=1|pages=27–32|language=en|doi=10.1016/j.jpedsurg.2018.10.030|pmc=6339589|pmid=30343978}}</ref>。一方で、びまん型CHIで膵亜全摘を行った小児の最大50%では術後も低血糖が継続し、さらなる治療を必要とする<ref name=":16" /><ref name=":19">{{Cite journal|last=Lord|first=Katherine|last2=Radcliffe|first2=Jerilynn|last3=Gallagher|first3=Paul R.|last4=Adzick|first4=N. Scott|last5=Stanley|first5=Charles A.|last6=De León|first6=Diva D.|date=1 September 2015|title=High Risk of Diabetes and Neurobehavioral Deficits in Individuals With Surgically Treated Hyperinsulinism|url=https://academic.oup.com/jcem/article-lookup/doi/10.1210/jc.2015-2539|journal=The Journal of Clinical Endocrinology & Metabolism|volume=100|issue=11|pages=4133–4139|language=en|doi=10.1210/jc.2015-2539|issn=0021-972X|pmc=4702456|pmid=26327482}}</ref>。そして時間経過とともにインスリン依存性糖尿病と膵機能不全を発症する。膵亜全摘を行った小児の91%が14歳までにインスリンを必要とする状態となる<ref name=":20">{{Cite journal|last=Beltrand|first=Jacques|last2=Caquard|first2=Marylène|last3=Arnoux|first3=Jean-Baptiste|last4=Laborde|first4=Kathleen|last5=Velho|first5=Gilberto|last6=Verkarre|first6=Virginie|last7=Rahier|first7=Jacques|last8=Brunelle|first8=Francis|last9=Nihoul-Fékété|first9=Claire|date=2012-02-01|title=Glucose Metabolism in 105 Children and Adolescents After Pancreatectomy for Congenital Hyperinsulinism|url=https://diabetesjournals.org/care/article/35/2/198/38450/Glucose-Metabolism-in-105-Children-and-Adolescents|journal=Diabetes Care|volume=35|issue=2|pages=198–203|language=en|doi=10.2337/dc11-1296|issn=0149-5992|pmc=3263917|pmid=22190679|last10=Saudubray|first10=Jean-Marie|last11=Robert|first11=Jean-Jacques|last12=de Lonlay|first12=Pascale}}</ref>。 |
|||
高インスリン血症の小児における神経発達・神経行動学的症状の頻度は、患者の種類や国によって異なるものの40–50%と高い<ref name=":19" /><ref name=":21">{{Cite journal|last=Avatapalle|first=Hima Bindu|last2=Banerjee|first2=Indraneel|last3=Shah|first3=Sajni|last4=Pryce|first4=Megan|last5=Nicholson|first5=Jacqueline|last6=Rigby|first6=Lindsey|last7=Caine|first7=Louise|last8=Didi|first8=Mohammed|last9=Skae|first9=Mars|date=2013|title=Abnormal Neurodevelopmental Outcomes are Common in Children with Transient Congenital Hyperinsulinism|url=http://journal.frontiersin.org/article/10.3389/fendo.2013.00060/abstract|journal=Frontiers in Endocrinology|volume=4|doi=10.3389/fendo.2013.00060|issn=1664-2392|pmc=3657691|pmid=23730298|last10=Ehtisham|first10=Sarah|last11=Patel|first11=Leena|last12=Padidela|first12=Raja|last13=Cosgrove|first13=Karen E.|last14=Dunne|first14=Mark J.|last15=Clayton|first15=Peter E.}}</ref><ref name=":53">{{Cite journal|last=Meissner|first=T|last2=Wendel|first2=U|last3=Burgard|first3=P|last4=Schaetzle|first4=S|last5=Mayatepek|first5=E|date=2003-07-01|title=Long-term follow-up of 114 patients with congenital hyperinsulinism|url=https://academic.oup.com/ejendo/article/149/1/43/6753399|journal=European Journal of Endocrinology|pages=43–51|doi=10.1530/eje.0.1490043|issn=0804-4643}}</ref><ref name=":54">{{Cite journal|last=Menni|first=Francesca|last2=de Lonlay|first2=Pascale|last3=Sevin|first3=Caroline|last4=Touati|first4=Guy|last5=Peigné|first5=Catherine|last6=Barbier|first6=Valérie|last7=Nihoul-Fékété|first7=Claire|last8=Saudubray|first8=Jean-Marie|last9=Robert|first9=Jean-Jacques|date=2001-03-01|title=Neurologic Outcomes of 90 Neonates and Infants With Persistent Hyperinsulinemic Hypoglycemia|url=https://publications.aap.org/pediatrics/article/107/3/476/66041/Neurologic-Outcomes-of-90-Neonates-and-Infants|journal=Pediatrics|volume=107|issue=3|pages=476–479|language=en|doi=10.1542/peds.107.3.476|issn=1098-4275}}</ref>。そのため、成長したり手術によって治癒した場合であっても、小児期を通じて神経発達検査を行うべきである。 |
|||
== 疫学 == |
|||
CHIの罹患率はさまざまである。[[いとこ婚]]が一般的な地域では2,500人に1人、その他では50,000人に1人とされるが、これらの値は少数の入院患者に基づいたものであるため不正確である可能性がある<ref name=":55">{{Cite journal|last=Arnoux|first=Jean-Baptiste|last2=Verkarre|first2=Virginie|last3=Saint-Martin|first3=Cécile|last4=Montravers|first4=Françoise|last5=Brassier|first5=Anaïs|last6=Valayannopoulos|first6=Vassili|last7=Brunelle|first7=Francis|last8=Fournet|first8=Jean-Christophe|last9=Robert|first9=Jean-Jacques|date=3 October 2011|title=Congenital hyperinsulinism: current trends in diagnosis and therapy|url=https://ojrd.biomedcentral.com/articles/10.1186/1750-1172-6-63|journal=Orphanet Journal of Rare Diseases|volume=6|issue=1|language=en|doi=10.1186/1750-1172-6-63|issn=1750-1172|pmc=3199232|pmid=21967988|last10=Aigrain|first10=Yves|last11=Bellanné-Chantelot|first11=Christine|last12=de Lonlay|first12=Pascale}}</ref>。イギリスにおける持続性CHIの罹患率は、28,389人に1人と報告されている<ref name=":56">{{Cite journal|last=Yau|first=Daphne|last2=Laver|first2=Thomas W.|last3=Dastamani|first3=Antonia|last4=Senniappan|first4=Senthil|last5=Houghton|first5=Jayne A. L.|last6=Shaikh|first6=Guftar|last7=Cheetham|first7=Tim|last8=Mushtaq|first8=Talat|last9=Kapoor|first9=Ritika R.|editor-last=Brusgaard|editor-first=Klaus|date=2020-02-06|title=Using referral rates for genetic testing to determine the incidence of a rare disease: The minimal incidence of congenital hyperinsulinism in the UK is 1 in 28,389|url=https://dx.plos.org/10.1371/journal.pone.0228417|journal=PLOS ONE|volume=15|issue=2|pages=e0228417|language=en|doi=10.1371/journal.pone.0228417|issn=1932-6203|pmc=7004321|pmid=32027664|last10=Randell|first10=Tabitha|last11=Ellard|first11=Sian|last12=Shah|first12=Pratik|last13=Banerjee|first13=Indraneel|last14=Flanagan|first14=Sarah E.}}</ref>。フィンランドでは、持続性CHIの罹患率は13,500人に1人、一過性CHIは7,400人に1人と報告されている<ref>{{Cite journal|last=Männistö|first=Jonna M. E.|last2=Jääskeläinen|first2=Jarmo|last3=Otonkoski|first3=Timo|last4=Huopio|first4=Hanna|date=2021-03-25|title=Long-Term Outcome and Treatment in Persistent and Transient Congenital Hyperinsulinism: A Finnish Population-Based Study|url=https://pubmed.ncbi.nlm.nih.gov/33475139|journal=The Journal of Clinical Endocrinology and Metabolism|volume=106|issue=4|pages=e1542–e1551|doi=10.1210/clinem/dgab024|issn=1945-7197|pmc=7993590|pmid=33475139}}</ref>。しかしながら、周産期ストレスによる高インスリン血症は比較的よくみられるものであるため、実際の値はより高いと予測されている<ref name=":32">{{Cite journal|last=Rosenfeld|first=Elizabeth|last2=Ganguly|first2=Arupa|last3=De Leon|first3=Diva D.|date=14 August 2019|title=Congenital hyperinsulinism disorders: Genetic and clinical characteristics|url=https://onlinelibrary.wiley.com/doi/10.1002/ajmg.c.31737|journal=American Journal of Medical Genetics Part C: Seminars in Medical Genetics|volume=181|issue=4|pages=682–692|language=en|doi=10.1002/ajmg.c.31737|issn=1552-4868|pmc=7229866|pmid=31414570}}</ref>。CHIに関する新生児スクリーニングは開発されていないため、本当の罹患率は未知である。 |
|||
CHIの経過は疾患の重症度や、一過性のものかどうかによって異なる。重症CHI患者は投薬治療に反応しないことが多く、膵臓の手術が必要となる可能性がある<ref name=":52">{{Cite journal|last=Banerjee|first=I|last2=Skae|first2=M|last3=Flanagan|first3=S E|last4=Rigby|first4=L|last5=Patel|first5=L|last6=Didi|first6=M|last7=Blair|first7=J|last8=Ehtisham|first8=S|last9=Ellard|first9=S|date=1 May 2011|title=The contribution of rapid KATP channel gene mutation analysis to the clinical management of children with congenital hyperinsulinism|url=https://academic.oup.com/ejendo/article/164/5/733/6676807|journal=European Journal of Endocrinology|volume=164|issue=5|pages=733–740|doi=10.1530/EJE-10-1136|issn=0804-4643|last10=Cosgrove|first10=K E|last11=Dunne|first11=M J|last12=Clayton|first12=P E}}</ref>。遺伝性のCHI患者に対しては手術が行われる可能性が高いが、時間経過とともにその重症度は低下するようであり、そのため一部の医師はオクトレオチドと炭水化物に富む食事との併用によって正常な血糖値を維持することを推奨している<ref name=":163">{{Cite journal|last=Adzick|first=N. Scott|last2=De Leon|first2=Diva D.|last3=States|first3=Lisa J.|last4=Lord|first4=Katherine|last5=Bhatti|first5=Tricia R.|last6=Becker|first6=Susan A.|last7=Stanley|first7=Charles A.|date=18 October 2018|title=Surgical treatment of congenital hyperinsulinism: Results from 500 pancreatectomies in neonates and children|url=https://linkinghub.elsevier.com/retrieve/pii/S0022346818306481|journal=Journal of Pediatric Surgery|volume=54|issue=1|pages=27–32|language=en|doi=10.1016/j.jpedsurg.2018.10.030|pmc=6339589|pmid=30343978}}</ref><ref name=":57">{{Cite journal|last=Mazor-Aronovitch|first=K|last2=Gillis|first2=D|last3=Lobel|first3=D|last4=Hirsch|first4=H J|last5=Pinhas-Hamiel|first5=O|last6=Modan-Moses|first6=D|last7=Glaser|first7=B|last8=Landau|first8=H|date=1 October 2007|title=Long-term neurodevelopmental outcome in conservatively treated congenital hyperinsulinism|url=https://academic.oup.com/ejendo/article/157/4/491/6695966|journal=European Journal of Endocrinology|volume=157|issue=4|pages=491–497|doi=10.1530/EJE-07-0445|issn=0804-4643}}</ref>。同様に、K<sub>ATP</sub>チャネルの構成要素をコードする遺伝子(''ABCC8''/''KCNJ11'')に変化が生じている小児の一部も経過とともに重症度の低下を示す<ref name=":58">{{Cite journal|last=Salomon-Estebanez|first=Maria|last2=Flanagan|first2=Sarah E.|last3=Ellard|first3=Sian|last4=Rigby|first4=Lindsey|last5=Bowden|first5=Louise|last6=Mohamed|first6=Zainab|last7=Nicholson|first7=Jacqueline|last8=Skae|first8=Mars|last9=Hall|first9=Caroline|date=1 December 2016|title=Conservatively treated Congenital Hyperinsulinism (CHI) due to K-ATP channel gene mutations: reducing severity over time|url=http://ojrd.biomedcentral.com/articles/10.1186/s13023-016-0547-3|journal=Orphanet Journal of Rare Diseases|volume=11|issue=1|pages=163|language=en|doi=10.1186/s13023-016-0547-3|issn=1750-1172|pmc=5133749|pmid=27908292|last10=Craigie|first10=Ross|last11=Padidela|first11=Raja|last12=Murphy|first12=Nuala|last13=Randell|first13=Tabitha|last14=Cosgrove|first14=Karen E.|last15=Dunne|first15=Mark J.}}</ref>。 |
|||
''ABCC8''または''KCNJ11''遺伝子の1コピーの変化が優性遺伝、すなわち患者の親から子へ遺伝する場合がある。こうした小児では、程度はさまざまであるものの、寛解が生じる場合がある<ref name=":59">{{Cite journal|last=Flanagan|first=Se|last2=Kapoor|first2=Rr|last3=Banerjee|first3=I|last4=Hall|first4=C|last5=Smith|first5=Vv|last6=Hussain|first6=K|last7=Ellard|first7=S|date=5 May 2011|title=Dominantly acting ABCC8 mutations in patients with medically unresponsive hyperinsulinaemic hypoglycaemia|url=https://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2010.01476.x|journal=Clinical Genetics|volume=79|issue=6|pages=582–587|language=en|doi=10.1111/j.1399-0004.2010.01476.x|issn=0009-9163|pmc=3375476|pmid=20573158}}</ref><ref name=":60">{{Cite journal|last=Pinney|first=Sara E.|last2=MacMullen|first2=Courtney|last3=Becker|first3=Susan|last4=Lin|first4=Yu-Wen|last5=Hanna|first5=Cheryl|last6=Thornton|first6=Paul|last7=Ganguly|first7=Arupa|last8=Shyng|first8=Show-Ling|last9=Stanley|first9=Charles A.|date=2008-08-01|title=Clinical characteristics and biochemical mechanisms of congenital hyperinsulinism associated with dominant KATP channel mutations|url=http://www.jci.org/articles/view/35414|journal=Journal of Clinical Investigation|volume=118|issue=8|pages=2877–2886|language=en|doi=10.1172/JCI35414|issn=0021-9738|pmc=2441858|pmid=18596924}}</ref>。このグループでは、小児や成人の一部では後に高血糖と糖尿病を発症する可能性もある<ref name=":61">{{Cite journal|last=Kapoor|first=R. R.|last2=Flanagan|first2=S. E.|last3=James|first3=C. T.|last4=McKiernan|first4=J.|last5=Thomas|first5=A. M.|last6=Harmer|first6=S. C.|last7=Shield|first7=J. P.|last8=Tinker|first8=A.|last9=Ellard|first9=S.|date=15 June 2011|title=Hyperinsulinaemic hypoglycaemia and diabetes mellitus due to dominant ABCC8/KCNJ11 mutations|url=http://link.springer.com/10.1007/s00125-011-2207-4|journal=Diabetologia|volume=54|issue=10|pages=2575–2583|language=en|doi=10.1007/s00125-011-2207-4|issn=0012-186X|pmc=3168751|pmid=21674179|last10=Hussain|first10=K.}}</ref>。同様の低血糖から高血糖への変化は、''[[HNF1A]]''や''[[HNF4A]]''遺伝子に変化が生じている患者でもみられる<ref name=":63">{{Cite journal|last=McGlacken-Byrne|first=Sinéad M|last2=Mohammad|first2=Jasmina Kallefullah|last3=Conlon|first3=Niamh|last4=Gubaeva|first4=Diliara|last5=Siersbæk|first5=Julie|last6=Schou|first6=Anders Jørgen|last7=Demirbilek|first7=Huseyin|last8=Dastamani|first8=Antonia|last9=Houghton|first9=Jayne A L|date=2022-04-01|title=Clinical and genetic heterogeneity of HNF4A/HNF1A mutations in a multicentre paediatric cohort with hyperinsulinaemic hypoglycaemia|url=https://academic.oup.com/ejendo/article/186/4/417/6852977|journal=European Journal of Endocrinology|volume=186|issue=4|pages=417–427|doi=10.1530/EJE-21-0897|issn=0804-4643|last10=Brusgaard|first10=Klaus|last11=Melikyan|first11=Maria|last12=Christesen|first12=Henrik|last13=Flanagan|first13=Sarah E|last14=Murphy|first14=Nuala P|last15=Shah|first15=Pratik}}</ref><ref name=":64">{{Cite journal|last=Yau|first=Daphne|last2=Colclough|first2=Kevin|last3=Natarajan|first3=Anuja|last4=Parikh|first4=Ruchi|last5=Canham|first5=Natalie|last6=Didi|first6=Mohammed|last7=Senniappan|first7=Senthil|last8=Banerjee|first8=Indraneel|date=20 April 2020|title=Congenital hyperinsulinism due to mutations in HNF1A|url=https://linkinghub.elsevier.com/retrieve/pii/S1769721219305038|journal=European Journal of Medical Genetics|volume=63|issue=6|pages=103928|language=en|doi=10.1016/j.ejmg.2020.103928}}</ref>。 |
|||
CHIの経過は、低血糖の問題以外にも及ぶ。幼児期の低血糖症による重要な影響は脳損傷である。小児期の発達の遅れは患者の最大50%、特に重症型CHIの患者で多く報告される<ref name=":192">{{Cite journal|last=Lord|first=Katherine|last2=Radcliffe|first2=Jerilynn|last3=Gallagher|first3=Paul R.|last4=Adzick|first4=N. Scott|last5=Stanley|first5=Charles A.|last6=De León|first6=Diva D.|date=1 September 2015|title=High Risk of Diabetes and Neurobehavioral Deficits in Individuals With Surgically Treated Hyperinsulinism|url=https://academic.oup.com/jcem/article-lookup/doi/10.1210/jc.2015-2539|journal=The Journal of Clinical Endocrinology & Metabolism|volume=100|issue=11|pages=4133–4139|language=en|doi=10.1210/jc.2015-2539|issn=0021-972X|pmc=4702456|pmid=26327482}}</ref><ref name=":212">{{Cite journal|last=Avatapalle|first=Hima Bindu|last2=Banerjee|first2=Indraneel|last3=Shah|first3=Sajni|last4=Pryce|first4=Megan|last5=Nicholson|first5=Jacqueline|last6=Rigby|first6=Lindsey|last7=Caine|first7=Louise|last8=Didi|first8=Mohammed|last9=Skae|first9=Mars|date=2013|title=Abnormal Neurodevelopmental Outcomes are Common in Children with Transient Congenital Hyperinsulinism|url=http://journal.frontiersin.org/article/10.3389/fendo.2013.00060/abstract|journal=Frontiers in Endocrinology|volume=4|doi=10.3389/fendo.2013.00060|issn=1664-2392|pmc=3657691|pmid=23730298|last10=Ehtisham|first10=Sarah|last11=Patel|first11=Leena|last12=Padidela|first12=Raja|last13=Cosgrove|first13=Karen E.|last14=Dunne|first14=Mark J.|last15=Clayton|first15=Peter E.}}</ref>。摂食の問題も親から報告されることが一般的である<ref name=":62">{{Cite journal|last=Pasquini|first=Tai L. S.|last2=Mesfin|first2=Mahlet|last3=Schmitt|first3=Jennifer|last4=Raskin|first4=Julie|date=2022-06-02|title=Global Registries in Congenital Hyperinsulinism|url=https://www.frontiersin.org/articles/10.3389/fendo.2022.876903/full|journal=Frontiers in Endocrinology|volume=13|pages=876903|doi=10.3389/fendo.2022.876903|issn=1664-2392|pmc=9201947|pmid=35721728}}</ref><ref name=":222">{{Cite journal|last=Banerjee|first=Indraneel|last2=Raskin|first2=Julie|last3=Arnoux|first3=Jean-Baptiste|last4=De Leon|first4=Diva D.|last5=Weinzimer|first5=Stuart A.|last6=Hammer|first6=Mette|last7=Kendall|first7=David M.|last8=Thornton|first8=Paul S.|date=2022-02-19|title=Congenital hyperinsulinism in infancy and childhood: challenges, unmet needs and the perspective of patients and families|url=https://ojrd.biomedcentral.com/articles/10.1186/s13023-022-02214-y|journal=Orphanet Journal of Rare Diseases|volume=17|issue=1|pages=61|language=en|doi=10.1186/s13023-022-02214-y|issn=1750-1172|pmc=8858501|pmid=35183224}}</ref>。重症型CHI患者でより高頻度でみられるようであり、長期間継続する可能性がある<ref name=":65">{{Cite journal|last=Banerjee|first=Indraneel|last2=Forsythe|first2=Lynette|last3=Skae|first3=Mars|last4=Avatapalle|first4=Hima Bindu|last5=Rigby|first5=Lindsey|last6=Bowden|first6=Louise E.|last7=Craigie|first7=Ross|last8=Padidela|first8=Raja|last9=Ehtisham|first9=Sarah|date=2016-02-09|title=Feeding Problems Are Persistent in Children with Severe Congenital Hyperinsulinism|url=http://journal.frontiersin.org/Article/10.3389/fendo.2016.00008/abstract|journal=Frontiers in Endocrinology|volume=7|doi=10.3389/fendo.2016.00008|issn=1664-2392|pmc=4747152|pmid=26903946|last10=Patel|first10=Leena|last11=Cosgrove|first11=Karen E.|last12=Dunne|first12=Mark J.|last13=Clayton|first13=Peter E.}}</ref><ref name=":66">{{Cite journal|last=Worth|first=Chris|last2=Hall|first2=Caroline|last3=Wilson|first3=Sarah|last4=Gilligan|first4=Niamh|last5=O'Shea|first5=Elaine|last6=Salomon-Estebanez|first6=Maria|last7=Dunne|first7=Mark|last8=Banerjee|first8=Indraneel|date=2020-03-18|title=Delayed Resolution of Feeding Problems in Patients With Congenital Hyperinsulinism|url=https://www.frontiersin.org/article/10.3389/fendo.2020.00143/full|journal=Frontiers in Endocrinology|volume=11|pages=143|doi=10.3389/fendo.2020.00143|issn=1664-2392|pmc=7093368|pmid=32256453}}</ref>。 |
|||
CHIの経過には、治療と関連した副作用も関係する。ジアゾキシドは短期的には致死的な[[肺高血圧]]を引き起こす可能性があるが、こうした副作用はわずかな症例で生じるのみである<ref name=":67">{{Cite journal|last=Chen|first=Suet Ching|last2=Dastamani|first2=Antonia|last3=Pintus|first3=Donatella|last4=Yau|first4=Daphne|last5=Aftab|first5=Sommayya|last6=Bath|first6=Louise|last7=Swinburne|first7=Craig|last8=Hunter|first8=Lindsey|last9=Giardini|first9=Alessandro|date=14 September 2019|title=Diazoxide‐induced pulmonary hypertension in hyperinsulinaemic hypoglycaemia: Recommendations from a multicentre study in the United Kingdom|url=https://onlinelibrary.wiley.com/doi/10.1111/cen.14096|journal=Clinical Endocrinology|volume=91|issue=6|pages=770–775|language=en|doi=10.1111/cen.14096|issn=0300-0664|last10=Christov|first10=Georgi|last11=Senniappan|first11=Senthil|last12=Banerjee|first12=Indraneel|last13=Shaikh|first13=Mohamad Guftar|last14=Shah|first14=Pratik}}</ref>。より一般的なものとしては、ジアゾキシドは体毛の増加や長期的には顔貌の変化を引き起こすことがある<ref name=":62" /><ref name=":02">{{Cite journal|last=Banerjee|first=I.|last2=Salomon-Estebanez|first2=M.|last3=Shah|first3=P.|last4=Nicholson|first4=J.|last5=Cosgrove|first5=K. E.|last6=Dunne|first6=M. J.|date=23 September 2018|title=Therapies and outcomes of congenital hyperinsulinism-induced hypoglycaemia|url=https://pubmed.ncbi.nlm.nih.gov/30246418|journal=Diabetic Medicine: A Journal of the British Diabetic Association|volume=36|issue=1|pages=9–21|doi=10.1111/dme.13823|issn=1464-5491|pmc=6585719|pmid=30246418}}</ref><ref name=":182">{{Cite journal|last=Herrera|first=Adriana|last2=Vajravelu|first2=Mary Ellen|last3=Givler|first3=Stephanie|last4=Mitteer|first4=Lauren|last5=Avitabile|first5=Catherine M|last6=Lord|first6=Katherine|last7=De León|first7=Diva D|date=2018-12-01|title=Prevalence of Adverse Events in Children With Congenital Hyperinsulinism Treated With Diazoxide|url=https://academic.oup.com/jcem/article/103/12/4365/5104459|journal=The Journal of Clinical Endocrinology & Metabolism|volume=103|issue=12|pages=4365–4372|language=en|doi=10.1210/jc.2018-01613|issn=0021-972X|pmc=6207144|pmid=30247666}}</ref>。部分的膵切除による治療を受けた局所性CHI患者は多くの場合治癒し、膵臓に問題が残ることはない。対照的に、膵亜全摘などより広範囲の手術行われた場合には、小児期の後期や思春期にインスリン依存性糖尿病を発症する<ref name=":202">{{Cite journal|last=Beltrand|first=Jacques|last2=Caquard|first2=Marylène|last3=Arnoux|first3=Jean-Baptiste|last4=Laborde|first4=Kathleen|last5=Velho|first5=Gilberto|last6=Verkarre|first6=Virginie|last7=Rahier|first7=Jacques|last8=Brunelle|first8=Francis|last9=Nihoul-Fékété|first9=Claire|date=2012-02-01|title=Glucose Metabolism in 105 Children and Adolescents After Pancreatectomy for Congenital Hyperinsulinism|url=https://diabetesjournals.org/care/article/35/2/198/38450/Glucose-Metabolism-in-105-Children-and-Adolescents|journal=Diabetes Care|volume=35|issue=2|pages=198–203|language=en|doi=10.2337/dc11-1296|issn=0149-5992|pmc=3263917|pmid=22190679|last10=Saudubray|first10=Jean-Marie|last11=Robert|first11=Jean-Jacques|last12=de Lonlay|first12=Pascale}}</ref>。手術後、糖尿病の発症前には低血糖と高血糖の双方がみられることが多い。こうした患者の約半数では膵酵素補充療法の必要性が生じる<ref name=":68">{{Cite journal|last=Arya|first=Ved Bhushan|last2=Senniappan|first2=Senthil|last3=Demirbilek|first3=Huseyin|last4=Alam|first4=Syeda|last5=Flanagan|first5=Sarah E.|last6=Ellard|first6=Sian|last7=Hussain|first7=Khalid|editor-last=Brusgaard|editor-first=Klaus|date=2014-05-19|title=Pancreatic Endocrine and Exocrine Function in Children following Near-Total Pancreatectomy for Diffuse Congenital Hyperinsulinism|url=https://dx.plos.org/10.1371/journal.pone.0098054|journal=PLoS ONE|volume=9|issue=5|pages=e98054|language=en|doi=10.1371/journal.pone.0098054|issn=1932-6203|pmc=4026387|pmid=24840042}}</ref>。 |
|||
==歴史== |
|||
先天性高インスリン血症(CHI)はこれまでさまざまな名称で呼ばれており、1970年代には膵島細胞症(nesidioblastosis)やislet cell adenomatosis、1980年代には beta cell dysregulation syndromeやbeta cell dysmaturation syndrome、そして1990年代には乳児持続性高インスリン血性低血糖症(persistent hyperinsulinemic hypoglycemia of infancy、PHHI)という名称が好まれていた<ref name=":8">{{Cite journal|last=Thornton|first=Paul S.|last2=Stanley|first2=Charles A.|last3=De Leon|first3=Diva D.|date=2022|title=Congenital Hyperinsulinism: An Historical Perspective|url=https://www.karger.com/Article/FullText/526442|journal=Hormone Research in Paediatrics|volume=95|issue=6|pages=631–637|language=en|doi=10.1159/000526442|issn=1663-2818}}</ref>。 |
|||
インスリン誘発性の症候性低血糖は1922年に初めて認識され、インスリン治療を受けた最初の糖尿病患者でインスリンによる低血糖によって神経質になるといった症状がみられた。先天性高インスリン血症の小児の最初の記載は、1954年にIrvine McQuarrieによって米国小児科学会(American Academy of Pediatrics)での会長講演の中でなされた。McQuarrieはこの疾患を"idiopathic hypoglycemia of infancy"と呼び、患者の何人かは血糖値を制御するために膵臓の大部分の切除が必要であった。一部の患者は低血糖の家系であったため、McQuarrieはこの疾患が遺伝性である可能性を示唆した。その翌年、トロントのCochraneらによって、こうした特発性低血糖症の全てではないものの、その一部ではタンパク質もしくは特定のアミノ酸、特にロイシンによって引き起こされることが報告された<ref name=":8" />。こうしたロイシン感受性の低血糖症の発見によって、グルコースだけでなくアミノ酸もインスリン放出の重要な刺激因子となっている可能性が初めて示された<ref name=":69">{{Cite journal|last=Stanley|first=C. A.|last2=Baker|first2=L.|date=1976|title=Hyperinsulinism in infants and children: diagnosis and therapy|url=https://pubmed.ncbi.nlm.nih.gov/795282|journal=Advances in Pediatrics|volume=23|pages=315–355|issn=0065-3101|pmid=795282}}</ref><ref name=":70">{{Cite journal|last=Pagliara|first=Anthony S.|last2=Karl|first2=Irene E.|last3=Haymond|first3=Morey|last4=Kipnis|first4=David M.|date=March 1973|title=Hypoglycemia in infancy and childhood. Part I|url=https://linkinghub.elsevier.com/retrieve/pii/S002234767380109X|journal=The Journal of Pediatrics|volume=82|issue=3|pages=365–379|language=en|doi=10.1016/S0022-3476(73)80109-X}}</ref><ref name=":92">{{Cite journal|last=Pagliara|first=Anthony S.|last2=Karl|first2=Irne E.|last3=Haymond|first3=Morey|last4=Kipnis|first4=David M.|date=April 1973|title=Hypoglycemia in infancy and childhood. Part II|url=https://linkinghub.elsevier.com/retrieve/pii/S0022347673805815|journal=The Journal of Pediatrics|volume=82|issue=4|pages=558–577|language=en|doi=10.1016/S0022-3476(73)80581-5}}</ref>。 |
|||
CHIは膵島細胞症(nesidioblastosis)と呼ばれることがあるが、この名称は膵臓組織で[[膵管]]上皮細胞からインスリン産生細胞が生じているように観察されることに基づいている。しかしながら、このことは新生児の膵臓の一般的特徴に過ぎないことが示され、この名称は用いられなくなった<ref name=":8" />。現在では、CHIは遺伝的変異によるβ細胞でのインスリン調節の異常が疾患の原因であることが広く認識されている<ref name=":23">{{Cite journal|last=Stanley|first=Charles A.|date=1 March 2016|title=Perspective on the Genetics and Diagnosis of Congenital Hyperinsulinism Disorders|url=https://academic.oup.com/jcem/article-lookup/doi/10.1210/jc.2015-3651|journal=The Journal of Clinical Endocrinology & Metabolism|volume=101|issue=3|pages=815–826|language=en|doi=10.1210/jc.2015-3651|issn=0021-972X|pmc=4803157|pmid=26908106}}</ref>。 |
|||
1964年Drashらによって、インスリン分泌を抑える[[高血圧治療薬]]であるジアゾキシドによってCHIの小児の一部で低血糖が制御されることが報告された。現時点では、ジアゾキシドが高インスリン血症の治療に対して[[アメリカ食品医薬品局|FDA]]の承認を受けている唯一の医薬品である<ref name=":8" />。 |
|||
1996年、グルコース刺激によるインスリン分泌に重要な役割を果たしているK<sub>ATP</sub>チャネルをコードする遺伝子(''ABCC8''、''KCNJ11'')にCHIの原因変異が発見された<ref name=":102">{{Cite journal|last=Kane|first=Charlotte|last2=Shepherd|first2=Ruth M.|last3=Squires|first3=Paul E.|last4=Johnson|first4=Paul R.V.|last5=James|first5=Roger F.L.|last6=Milla|first6=Peter J.|last7=Aynsley-Green|first7=Albert|last8=Lindley|first8=Keith J.|last9=Dunne|first9=Mark J.|date=1 December 1996|title=Loss of functional KATP channels in pancreatic β–cells causes persistent hyperinsulinemic hypoglycemia of infancy|url=http://www.nature.com/articles/nm1296-1344|journal=Nature Medicine|volume=2|issue=12|pages=1344–1347|language=en|doi=10.1038/nm1296-1344|issn=1078-8956}}</ref><ref name=":71">{{Cite journal|last=Dunne|first=Mark J.|last2=Kane|first2=Charlotte|last3=Shepherd|first3=Ruth M.|last4=Sanchez|first4=Jorge A.|last5=James|first5=Roger F.L.|last6=Johnson|first6=Paul R.V.|last7=Aynsley-Green|first7=Albert|last8=Lu|first8=Shan|last9=Clement|first9=John P.|date=1997-03-06|title=Familial Persistent Hyperinsulinemic Hypoglycemia of Infancy and Mutations in the Sulfonylurea Receptor|url=http://www.nejm.org/doi/abs/10.1056/NEJM199703063361005|journal=New England Journal of Medicine|volume=336|issue=10|pages=703–706|language=en|doi=10.1056/NEJM199703063361005|issn=0028-4793|last10=Lindley|first10=Keith J.|last11=Seino|first11=Susumu|last12=Aguilar-Bryan|first12=Lydia|last13=Gonzalez|first13=Gabriela|last14=Milla|first14=Peter J.}}</ref>。すぐ後には、グルコキナーゼ(GCK)やグルタミン酸デヒドロゲナーゼ(GLUD1)の変異も高インスリン血症の原因となることが特定された<ref name=":23" /><ref name=":72">{{Cite journal|last=Glaser|first=Benjamin|last2=Kesavan|first2=Prebakaran|last3=Heyman|first3=Mozhgan|last4=Davis|first4=Elizabeth|last5=Cuesta|first5=Antonio|last6=Buchs|first6=Andreas|last7=Stanley|first7=Charles A.|last8=Thornton|first8=Paul S.|last9=Permutt|first9=M. Alan|date=1998-01-22|title=Familial Hyperinsulinism Caused by an Activating Glucokinase Mutation|url=http://www.nejm.org/doi/abs/10.1056/NEJM199801223380404|journal=New England Journal of Medicine|volume=338|issue=4|pages=226–230|language=en|doi=10.1056/NEJM199801223380404|issn=0028-4793|last10=Matschinsky|first10=Franz M.|last11=Herold|first11=Kevan C.}}</ref><ref name=":112">{{Cite journal|last=Stanley|first=Charles A.|last2=Lieu|first2=Yen K.|last3=Hsu|first3=Betty Y.L.|last4=Burlina|first4=Alberto B.|last5=Greenberg|first5=Cheryl R.|last6=Hopwood|first6=Nancy J.|last7=Perlman|first7=Kusiel|last8=Rich|first8=Barry H.|last9=Zammarchi|first9=Enrico|date=1998-05-07|title=Hyperinsulinism and Hyperammonemia in Infants with Regulatory Mutations of the Glutamate Dehydrogenase Gene|url=http://www.nejm.org/doi/abs/10.1056/NEJM199805073381904|journal=New England Journal of Medicine|volume=338|issue=19|pages=1352–1357|language=en|doi=10.1056/NEJM199805073381904|issn=0028-4793|last10=Poncz|first10=Mortimer}}</ref>。現在では、CHIの原因となる遺伝子は30以上同定されている<ref name=":122">{{Cite journal|last=Rosenfeld|first=Elizabeth|last2=De León|first2=Diva D.|date=2023-03-28|title=Bridging the gaps: recent advances in diagnosis, care, and outcomes in congenital hyperinsulinism|url=https://journals.lww.com/10.1097/MOP.0000000000001243|journal=Current Opinion in Pediatrics|volume=Publish Ahead of Print|language=en|doi=10.1097/MOP.0000000000001243|issn=1040-8703}}</ref>。一般的なCHI原因遺伝子に対する迅速な遺伝子検査は標準的診断の一部となっており、外科的除去によって治癒可能な局所性CHIの可能性が高い幼児の特定に役立っている<ref name=":110">{{Cite journal|last=Hewat|first=Thomas I.|last2=Johnson|first2=Matthew B.|last3=Flanagan|first3=Sarah E.|date=7 July 2022|title=Congenital Hyperinsulinism: Current Laboratory-Based Approaches to the Genetic Diagnosis of a Heterogeneous Disease|url=https://www.frontiersin.org/articles/10.3389/fendo.2022.873254|journal=Frontiers in Endocrinology|volume=13|doi=10.3389/fendo.2022.873254|issn=1664-2392|pmc=9302115|pmid=35872984}}</ref><ref name=":132">{{Cite journal|last=Verkarre|first=V|last2=Fournet|first2=J C|last3=de Lonlay|first3=P|last4=Gross-Morand|first4=M S|last5=Devillers|first5=M|last6=Rahier|first6=J|last7=Brunelle|first7=F|last8=Robert|first8=J J|last9=Nihoul-Fékété|first9=C|date=1998-10-01|title=Paternal mutation of the sulfonylurea receptor (SUR1) gene and maternal loss of 11p15 imprinted genes lead to persistent hyperinsulinism in focal adenomatous hyperplasia.|url=http://www.jci.org/articles/view/4495|journal=Journal of Clinical Investigation|volume=102|issue=7|pages=1286–1291|language=en|doi=10.1172/JCI4495|issn=0021-9738|pmc=508975|pmid=9769320|last10=Saudubray|first10=J M|last11=Junien|first11=C}}</ref>。2003年には、<sup>18</sup>F-DOPAを用いたPETスキャンが局所性CHIの病変部位の特定と切除に有用であることが示された<ref name=":142">{{Cite journal|last=Otonkoski|first=Timo|last2=Näntö-Salonen|first2=Kirsti|last3=Seppänen|first3=Marko|last4=Veijola|first4=Riitta|last5=Huopio|first5=Hanna|last6=Hussain|first6=Khalid|last7=Tapanainen|first7=Päivi|last8=Eskola|first8=Olli|last9=Parkkola|first9=Riitta|date=January 2006|title=Noninvasive diagnosis of focal hyperinsulinism of infancy with [18F]-DOPA positron emission tomography|url=https://pubmed.ncbi.nlm.nih.gov/16380471|journal=Diabetes|volume=55|issue=1|pages=13–18|issn=0012-1797|pmid=16380471|last10=Ekström|first10=Klas|last11=Guiot|first11=Yves|last12=Rahier|first12=Jacques|last13=Laakso|first13=Markku|last14=Rintala|first14=Risto|last15=Nuutila|first15=Pirjo}}</ref>。 |
|||
== 社会と文化 == |
|||
=== 患者支援組織 === |
|||
先天性高インスリン血症の患者の生活の改善を目的とした患者支援組織は、患者とその家族の支援、CHIに関する研究への参加と資金提供、そしてこの疾患への認識を高める重要な役割を果たしている<ref name=":73">{{Cite journal|last=Raskin|first=Julie|last2=Pasquini|first2=Tai L. S.|last3=Bose|first3=Sheila|last4=Tallis|first4=Dina|last5=Schmitt|first5=Jennifer|date=2022|title=Congenital Hyperinsulinism International: A Community Focused on Improving the Lives of People Living With Congenital Hyperinsulinism|url=https://www.frontiersin.org/articles/10.3389/fendo.2022.886552|journal=Frontiers in Endocrinology|volume=13|doi=10.3389/fendo.2022.886552|issn=1664-2392|pmc=9097272|pmid=35573986}}</ref><ref name=":74">{{Cite journal|last=Ng|first=Sze May|last2=Dearman|first2=Sarah|last3=Fisher|first3=Mark|last4=Mushtaq|first4=Talat|last5=Randell|first5=Tabitha|date=2023-02-09|title=Paediatric Society and Hyperinsulinism Charity National Surveys on CGM Access for Patients With Recurrent Hypoglycaemia|url=https://pubmed.ncbi.nlm.nih.gov/36824585|journal=Journal of the Endocrine Society|volume=7|issue=4|pages=bvad021|doi=10.1210/jendso/bvad021|issn=2472-1972|pmc=9942542|pmid=36824585}}</ref>。Congenital Hyperinsulinism Internationalはこうした目的で設立された国際的な患者支援組織であり、{{仮リンク|チャン・ザッカーバーグ・イニシアチブ|en|Chan Zuckerberg Initiative}}のRare as One Networkのメンバーである<ref name=":62" />。 |
|||
=== 疾患レジストリ === |
|||
先天性高インスリン血症の患者は、HI Global Registryと呼ばれる{{仮リンク|疾患レジストリ|en|Disease registry}}に登録することができる。自身の経験に関する調査をレジストリに投稿することで、疾患研究に貢献することができる<ref name=":62" /><ref name=":75">{{Cite web |title=HI Global Registry |url=https://www.higlobalregistry.org/ |access-date=2023-06-25 |website=www.higlobalregistry.org}}</ref>。 |
|||
== 出典 == |
|||
{{Reflist}} |
{{Reflist}} |
||
== 関連文献 == |
|||
{{medical-stub}} |
|||
* {{cite book|last1=Hoyme|first1= Louanne Hudgins|last2=Toriello|first2=Helga V.|last3=Enns|first3=Gregory M.|last4=Hoyme|first4=H. Eugene|title=Signs and symptoms of genetic disease : a handbook|date=2014|publisher=Oxford University Press|location=Oxford|isbn=9780199930975|url=https://books.google.com/books?id=h-J_AwAAQBAJ&q=Congenital+hyperinsulinism+signs&pg=PA260|language=en}} |
|||
* {{cite book|editor-last1=Hertz|editor-first1=David E.|title=Care of the newborn a handbook for primary care|date=2005|publisher=Lippincott Williams & Wilkins|location=Philadelphia|isbn=9780781755856|url=https://books.google.com/books?id=bjdK9__HCV4C&q=Congenital+hyperinsulinism+signs&pg=PA56|language=en}} |
|||
== 関連項目 == |
|||
* {{仮リンク|高アンモニア血症|en|Hyperammonemia}} |
|||
== 外部リンク == |
|||
[[Category:遺伝子疾患]] |
|||
* [https://www.ncbi.nlm.nih.gov/pubmed/ PubMed] |
|||
{{デフォルトソート:せんてんせいこういんすりんけつしよう}} |
|||
{{Medical resources |
|||
| DiseasesDB = |
|||
| ICD10 = |
|||
| ICD9 = {{ICD9|251.1}} |
|||
| ICDO = |
|||
| OMIM = 256450 |
|||
| MedlinePlus = |
|||
| eMedicineSubj = article |
|||
| eMedicineTopic = 923538 |
|||
| MeshID = D044903 |
|||
}} |
|||
{{DEFAULTSORT:せんてんせいこういんすりんけつしよう}} |
|||
{{Authority control}} |
|||
[[Category:新生児科学]] |
|||
[[Category:希少疾患]] |
|||
2023年7月16日 (日) 05:51時点における最新版
| Congenital hyperinsulinism | |
|---|---|
| 別称 | CHI |
 | |
|
インスリン (この疾患では過剰産生される) | |
| 概要 | |
| 症状 | 低血糖[1] |
| 原因 | ABCC8遺伝子変異(最も一般的)[2] |
| 診断法 | 血液試料[3] |
| 治療 | オクトレオチド、ニフェジピン[4] |
| 分類および外部参照情報 | |
先天性高インスリン血症(せんてんせいこうインスリンけっしょう、英: congenital hyperinsulinism、略称: CHI)は、インスリンの分泌過多によって低血糖が引き起こされる、一連の先天性疾患を指す用語である[4][5]。先天性高インスリン血性低血糖症には、一過性のものと持続性のものがあり、軽症から重症までさまざまである。こうした症状は出生時には既に存在しており、ほとんどの場合には乳児期の初期に明らかとなる。軽症例は頻回食によって治療することができるが、より重症例ではインスリンの分泌や作用を低下させる医薬品による制御が行われる[1][5]。
徴候と症状
[編集]
CHIは先天性疾患であるため、通常は新生児は出生後数日以内に徴候や症状を示し始めるが、極めて稀に、より後の段階になって症状が出現する可能性がある。CHIの徴候や症状は新生児や幼児の典型的挙動と混同されることが多く、その特定は困難であることが多い[6]。
CHIの症状はいくつかの形で出現する可能性があるが、低血糖症に一般的な症状は次のようなものである。
- 易刺激性[7][8]
- 嗜眠[8][9]
- Jitteriness/振戦[7][8][9][10]
- 頻脈または徐脈[11]
- 異常呼吸パターン/無呼吸[7][8]
- 低体温[7][8][9]
- 異常な摂食行動(摂食のために目覚めることがない、哺乳困難、落ち着きがない、順調な授乳が続いた後に頻繁に授乳を要求する)[7][8][9]
- 甲高い泣き声[9]
- 筋緊張低下[7][8][9]
- 蒼白/チアノーゼ[7]
- 発汗[8][10]
より成長した小児や成人の症状には、頭痛、意識不鮮明、めまいなどがある[11]。
親による最初の懸念や症状として、吸い付きが弱い、眠りがち、過敏などと表現されることが多い[12]。
低血糖状態が持続したり、極度の低血糖状態となった場合には、てんかん発作(けいれん)などより重篤な症状が生じる場合がある[7][8][10][13]。血糖値が回復しない場合には、意識消失や脳損傷が生じる可能性がある[13]。
何らかの低血糖症状がみられる場合には、簡易的な血糖測定が不可欠である[14]。
原因
[編集]高インスリン血症(HI)や先天性高インスリン血症(CHI)には、遺伝的要因と後天的要因の双方がありうる。後天的要因によるものとしては、胎児発育不全、周産期仮死、妊娠糖尿病など周産期の因子によって二次的に生じたものの可能性があり、これらはまとめてperinatal stress-induced HI(周産期ストレス誘発性HI)と呼ばれることも多い。こうした症状は出生後24時間以内にみられるのが一般的であり、多くの場合2週以内に消失する[15][16]。
周産期ストレスによる低血糖とは対照的に、CHIは遺伝的要因によるものもある。そのため、後天的要因の可能性が低い小児に対しては遺伝子検査が考慮に入れられる。こうしたケースには、第一選択薬となるジアゾキシドに反応しない場合などが含まれる。ジアゾキシドに反応するものの低血糖が4ヶ月以降も持続する小児に対しても、遺伝子検査が行われる場合がある[17][18]。
CHIの遺伝的要因は多くあり、症状が単独で出現する場合(非症候群性、isolated form)と、より広範囲の疾患(症候群)の一部として症状がみられる場合(症候群性、syndromic form)がある[19]。
非症候群性
[編集]非症候群性の高インスリン血症は、CHIの大部分を占める。最も一般的な遺伝的要因は、カリウムチャネル(KATPチャネル)の構成要素をコードする遺伝子(ABCC8もしくはKCNJ11)の一方または双方のコピーの変化である[20][21]。このチャネルは通常は膵臓のβ細胞において血糖値に応答したインスリン産生を調節しているが、チャネルの変化や欠陥によって無制御かつ過剰なインスリン産生が行われるようになる。こうしたABCC8もしくはKCNJ11遺伝子の変化によるCHIは優性遺伝する場合も劣性遺伝する場合もある。優性型の場合、一方の親から遺伝した1つの変化(もしくは散発的に生じた変化)によってびまん性のCHIが引き起こされる。びまん性CHIでは、膵臓全体が影響を受ける。優性型のCHIは軽症でジアゾキシドに反応する場合も、重症でジアゾキシドに反応しない場合もある。ABCC8もしくはKCNJ11遺伝子の変化によるCHIの一部は劣性遺伝する。こうした家系では、両親はそれぞれ1コピーずつ欠陥遺伝子を保有しているが、発症に至ることはない。子が両親から1つずつ欠陥遺伝子を受け継いだ場合、CHIを発症する。一般的に劣性型は、ジアゾキシド不応性のびまん性CHIを引き起こす。一部の症例では、父親由来の欠陥遺伝子の遺伝と膵臓内での母親由来の正常コピーの喪失との組み合わせによってCHIが引きこされている場合がある。こうしたケースでは局所性のCHIとなり、膵臓の一部(局所性病変)でのみインスリンか過剰産生される[17][22][23]。
重症のCHIで医薬品に反応しない場合には、ABCC8、KCNJ11遺伝子の迅速な検査が推奨される。この検査は、疾患初期に局所性CHIの可能性を特定するために有用である。遺伝子検査後には、18F-DOPAを用いたポジトロン断層撮影(PET)によって外科的除去を行う局所性病変を特定する。遺伝子検査はABCC8もしくはKCNJ11遺伝子の双方のコピーが欠陥を有するかどうかを明らかにするためにも有用であり、両コピーに欠陥がみられる場合にはジアゾキシド不応性のびまん性CHIと診断される。こうした症例はオクトレオチドなどの代替的な医薬品による治療を必要とし、膵臓の大部分の外科的除去が必要となる可能性がある。このように、重症CHIの小児に対する内科的・外科的管理の指針として、早期の迅速な遺伝子検査は重要である。CHIに関する遺伝子検査の結果は、CHIに関して経験豊富で専門的知識を有する分子遺伝学研究室で解析されることが望ましい[18][19][23][24]。
CHIの原因として一般的な他の遺伝的要因には、グルタミン酸デヒドロゲナーゼ(GDH)をコードする遺伝子GLUD1の変化がある。このタイプはGDH-CHIもしくはGLUD1-CHIと呼ばれる。このタイプのCHIは優性遺伝するが、散発性のものである可能性もある。このタイプのCHIでは、血中アンモニア濃度が緩やかに上昇する。GDH-CHIの小児や成人はジアゾキシドに反応することが多い。食事中のタンパク質の過剰によって低血糖がもたらされるため、炭水化物とタンパク質の比率を適切にすることが勧められる。非症状群性CHIの遺伝的要因は他にも多くあり、ヒドロキシアシルCoAデヒドロゲナーゼ(SCHAD-CHI)やグルコキナーゼ(GCK-CHI)の変異のほか、近年ではグルコキナーゼに類似した酵素HK1も軽症型・重症型双方の原因となることが特定されている[18][23][25]。
症候群性
[編集]症候群性のCHIは非症候群性CHIと比較して少数であり、疾患レジストリのデータからは報告症例の1%未満であることが示唆されている[26]。症候群性CHIは、遺伝的要因が一般的である[27]。ベックウィズ-ヴィーデマン症候群(BWS)は、症候群性CHIの原因としてよく知られた過成長症候群である。CHIを一般的な特徴とする他の症候群には、歌舞伎症候群やターナー症候群がある。症候群性CHIの大部分はジアゾキシド治療に反応し、CHIは経時的に軽快する可能性があるが、BWSに伴うCHIは重症型で通常の治療に反応しない場合もある[28][29][30]。
診断
[編集]
CHIは膵臓β細胞のインスリン分泌の調節不全を原因とする。低血糖時にはインスリンは抑制されず血中に存在する。インスリン濃度は変動するため、測定は困難な場合がある。CHIの診断は、低血糖時のインスリン作用の亢進や血漿インスリンの不十分な抑制をもとに行われる。インスリン作用の亢進は、グルコース必要量の増加によって示される(一例として、新生児の正常値4-6 mg/kg/分に対し、8 mg/kg/分以上)[31]。過剰なインスリン作用の他の徴候としては、低血糖時の遊離脂肪酸やケトン体(β-ヒドロキシ酪酸)の血中濃度の低下が挙げられる。臨床診断は低血糖時グルカゴン投与後の血糖値の大幅な上昇によっても支持される[32][33][34]。グルカゴンは膵臓から分泌される他のホルモンであり、インスリンの作用に対抗して肝臓に貯蔵されているグリコーゲンからグルコースの放出を刺激する。インスリン、C-ペプチド(インスリンと共に分泌される)、遊離脂肪酸、ケトン体濃度の測定やグルカゴン負荷試験は、自然に生じた低血糖時や管理下絶食によって誘発された低血糖時に行われる。新生児の場合、出生後72時間以内は一過性低血糖の期間であるため、臨床診断は72時間経過後に行うのが最善である[35]。血中アンモニア、アシルカルニチン分析、尿中代謝物分析、タンパク質やアミノ酸(ロイシン)に対する応答の検査は、CHIのサブタイプの決定に有用である可能性がある[36][37][38][39]。
治療
[編集]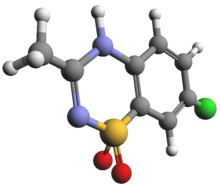

高インスリン血症の治療目標は低血糖による脳損傷を防ぐことであり、血糖値を正常範囲 [>70 mg/dL (3.9 mmol/L)] に維持することが目標となる。第一段階は急性低血糖後の血糖値の正常範囲への回復であり、続いてCHIで一般的な再発性低血糖の防止となる。
最初の治療としてはグルコースの静注が最も効果的となる。遺伝子型や表現型などによってCHIの診断が確定すると、特異的治療が開始される。よく試みられる治療法を次に挙げる。
- 栄養療法: 経腸栄養(経鼻、胃ろう)による炭水化物(ブドウ糖、フォーミュラ)の持続注入[7]
- インスリン分泌を抑える医薬品: ジアゾキシド、オクトレオチドやランレオチドなどソマトスタチンアナログ[40]
- インスリン作用に対抗する医薬品: グルカゴン[40]
- 膵臓の一部またはほぼ全域を除去する外科手術(膵切除術)[40]
ジアゾキシドはKATPチャネル開口薬であり、KATPチャネルのSUR1サブユニットに結合することでインスリン分泌を阻害する。ジアゾキシドはCHIの治療に承認されている唯一の医薬品であり、この疾患の治療における第一選択薬である[41]。ジアゾキシドによる体液貯留の副作用を防ぐため、利尿薬による治療が同時に開始されるのが一般的である。用量の選択と漸増は、反応と副作用を注意深く考慮しながら行う。半減期は長いため、十分な治療効果が得られるには最大で5日かかる可能性がある。次の重要な段階はジアゾキシド反応性の評価であり、診断と治療において重要な意味を持つ。ジアゾキシド反応性の判断は、CHIの主要な特徴である低ケトン性低血糖の改善をもとに行われる。ジアゾキシド反応性は絶食試験による評価が最善であり、血漿グルコース濃度が70 mg/dL(3.9 mmol/L)以上の状態で12–18時間の絶食が可能であること、または絶食時に血漿グルコース濃度が50–60 mg/dL(2.8–3.3 mmol/L)未満に減少する前に血漿β-ヒドロキシ酪酸濃度が1.8 mmol/L以上に増加することで示される。ジアゾキシド不応性は、CHIがKATPチャネルをコードする遺伝子の不活性化変異によるものである可能性を示唆する。こうした症例では、局所性CHIの可能性を明らかにするためにABCC8またはKCNJ11遺伝子の迅速な遺伝子検査が重要である[42]。
局所性CHIには手術が治療選択となるが、手術前に病変部位を特定することが重要である。こうした病変は超音波検査やCTスキャン、MRIといった従来のイメージング手法で可視化することはできない。しかしながら、18F-DOPAを用いたPETスキャンによってほぼ100%正確に局所病変を特定することが可能である[43]。術中凍結組織検体を用いた膵臓組織の専門家による評価と手術の専門的技術が成功の鍵となる。局所性CHIの治癒率は97%と報告されている[44]。
局所性でないジアゾキシド不応性症例の場合、治療オプションは限られている。ソマトスタチンアナログであるオクトレオチドの適応外処方は、CHIの治療におけるセカンドライン治療として長く用いられているが[45]、その効果はタキフィラキシーによって限定的なものとなる。ジアゾキシドを用いることができない地域では、オクトレオチドが第一選択薬となる可能性がある。オクトレオチドは致死的な壊死性腸炎と関係している可能性があるため、新生児に対する使用はリスクとベネフィットを注意深く考慮して行うべきである[46]。オクトレオチドは一般的には6時間ごとに皮下注射によって投与されるが、ポンプを用いた持続皮下注射も可能である。長時間作用型ソマトスタチンアナログであるオクトレオチドLAR(筋肉内注射)やランレオチド(深部皮下注射)は、より年長児にとって便利なオプションとなる。オクトレオチドが適応外もしくは不応性のジアゾキシド不応性症例に対する代替的な治療アプローチは胃ろうを介したブドウ糖の持続注入となる[47]。
予後
[編集]CHI患者の予後は、診断の遅れの影響、治療の副作用、治療の効果などの影響を受ける。
ジアゾキシドやソマトスタチンアナログによる治療を行った小児では副作用は一般的であり、さまざまな重症度の治療患者の最大50%が影響を受ける[48][49][50][51][52]。局所性CHIの小児の手術予後は優れており、治癒率は97%である[53]。一方で、びまん型CHIで膵亜全摘を行った小児の最大50%では術後も低血糖が継続し、さらなる治療を必要とする[53][54]。そして時間経過とともにインスリン依存性糖尿病と膵機能不全を発症する。膵亜全摘を行った小児の91%が14歳までにインスリンを必要とする状態となる[55]。
高インスリン血症の小児における神経発達・神経行動学的症状の頻度は、患者の種類や国によって異なるものの40–50%と高い[54][56][57][58]。そのため、成長したり手術によって治癒した場合であっても、小児期を通じて神経発達検査を行うべきである。
疫学
[編集]CHIの罹患率はさまざまである。いとこ婚が一般的な地域では2,500人に1人、その他では50,000人に1人とされるが、これらの値は少数の入院患者に基づいたものであるため不正確である可能性がある[59]。イギリスにおける持続性CHIの罹患率は、28,389人に1人と報告されている[60]。フィンランドでは、持続性CHIの罹患率は13,500人に1人、一過性CHIは7,400人に1人と報告されている[61]。しかしながら、周産期ストレスによる高インスリン血症は比較的よくみられるものであるため、実際の値はより高いと予測されている[62]。CHIに関する新生児スクリーニングは開発されていないため、本当の罹患率は未知である。
CHIの経過は疾患の重症度や、一過性のものかどうかによって異なる。重症CHI患者は投薬治療に反応しないことが多く、膵臓の手術が必要となる可能性がある[63]。遺伝性のCHI患者に対しては手術が行われる可能性が高いが、時間経過とともにその重症度は低下するようであり、そのため一部の医師はオクトレオチドと炭水化物に富む食事との併用によって正常な血糖値を維持することを推奨している[64][65]。同様に、KATPチャネルの構成要素をコードする遺伝子(ABCC8/KCNJ11)に変化が生じている小児の一部も経過とともに重症度の低下を示す[66]。
ABCC8またはKCNJ11遺伝子の1コピーの変化が優性遺伝、すなわち患者の親から子へ遺伝する場合がある。こうした小児では、程度はさまざまであるものの、寛解が生じる場合がある[67][68]。このグループでは、小児や成人の一部では後に高血糖と糖尿病を発症する可能性もある[69]。同様の低血糖から高血糖への変化は、HNF1AやHNF4A遺伝子に変化が生じている患者でもみられる[70][71]。
CHIの経過は、低血糖の問題以外にも及ぶ。幼児期の低血糖症による重要な影響は脳損傷である。小児期の発達の遅れは患者の最大50%、特に重症型CHIの患者で多く報告される[72][73]。摂食の問題も親から報告されることが一般的である[74][75]。重症型CHI患者でより高頻度でみられるようであり、長期間継続する可能性がある[76][77]。
CHIの経過には、治療と関連した副作用も関係する。ジアゾキシドは短期的には致死的な肺高血圧を引き起こす可能性があるが、こうした副作用はわずかな症例で生じるのみである[78]。より一般的なものとしては、ジアゾキシドは体毛の増加や長期的には顔貌の変化を引き起こすことがある[74][79][80]。部分的膵切除による治療を受けた局所性CHI患者は多くの場合治癒し、膵臓に問題が残ることはない。対照的に、膵亜全摘などより広範囲の手術行われた場合には、小児期の後期や思春期にインスリン依存性糖尿病を発症する[81]。手術後、糖尿病の発症前には低血糖と高血糖の双方がみられることが多い。こうした患者の約半数では膵酵素補充療法の必要性が生じる[82]。
歴史
[編集]先天性高インスリン血症(CHI)はこれまでさまざまな名称で呼ばれており、1970年代には膵島細胞症(nesidioblastosis)やislet cell adenomatosis、1980年代には beta cell dysregulation syndromeやbeta cell dysmaturation syndrome、そして1990年代には乳児持続性高インスリン血性低血糖症(persistent hyperinsulinemic hypoglycemia of infancy、PHHI)という名称が好まれていた[83]。
インスリン誘発性の症候性低血糖は1922年に初めて認識され、インスリン治療を受けた最初の糖尿病患者でインスリンによる低血糖によって神経質になるといった症状がみられた。先天性高インスリン血症の小児の最初の記載は、1954年にIrvine McQuarrieによって米国小児科学会(American Academy of Pediatrics)での会長講演の中でなされた。McQuarrieはこの疾患を"idiopathic hypoglycemia of infancy"と呼び、患者の何人かは血糖値を制御するために膵臓の大部分の切除が必要であった。一部の患者は低血糖の家系であったため、McQuarrieはこの疾患が遺伝性である可能性を示唆した。その翌年、トロントのCochraneらによって、こうした特発性低血糖症の全てではないものの、その一部ではタンパク質もしくは特定のアミノ酸、特にロイシンによって引き起こされることが報告された[83]。こうしたロイシン感受性の低血糖症の発見によって、グルコースだけでなくアミノ酸もインスリン放出の重要な刺激因子となっている可能性が初めて示された[84][85][86]。
CHIは膵島細胞症(nesidioblastosis)と呼ばれることがあるが、この名称は膵臓組織で膵管上皮細胞からインスリン産生細胞が生じているように観察されることに基づいている。しかしながら、このことは新生児の膵臓の一般的特徴に過ぎないことが示され、この名称は用いられなくなった[83]。現在では、CHIは遺伝的変異によるβ細胞でのインスリン調節の異常が疾患の原因であることが広く認識されている[87]。
1964年Drashらによって、インスリン分泌を抑える高血圧治療薬であるジアゾキシドによってCHIの小児の一部で低血糖が制御されることが報告された。現時点では、ジアゾキシドが高インスリン血症の治療に対してFDAの承認を受けている唯一の医薬品である[83]。
1996年、グルコース刺激によるインスリン分泌に重要な役割を果たしているKATPチャネルをコードする遺伝子(ABCC8、KCNJ11)にCHIの原因変異が発見された[88][89]。すぐ後には、グルコキナーゼ(GCK)やグルタミン酸デヒドロゲナーゼ(GLUD1)の変異も高インスリン血症の原因となることが特定された[87][90][91]。現在では、CHIの原因となる遺伝子は30以上同定されている[92]。一般的なCHI原因遺伝子に対する迅速な遺伝子検査は標準的診断の一部となっており、外科的除去によって治癒可能な局所性CHIの可能性が高い幼児の特定に役立っている[93][94]。2003年には、18F-DOPAを用いたPETスキャンが局所性CHIの病変部位の特定と切除に有用であることが示された[95]。
社会と文化
[編集]患者支援組織
[編集]先天性高インスリン血症の患者の生活の改善を目的とした患者支援組織は、患者とその家族の支援、CHIに関する研究への参加と資金提供、そしてこの疾患への認識を高める重要な役割を果たしている[96][97]。Congenital Hyperinsulinism Internationalはこうした目的で設立された国際的な患者支援組織であり、チャン・ザッカーバーグ・イニシアチブのRare as One Networkのメンバーである[74]。
疾患レジストリ
[編集]先天性高インスリン血症の患者は、HI Global Registryと呼ばれる疾患レジストリに登録することができる。自身の経験に関する調査をレジストリに投稿することで、疾患研究に貢献することができる[74][98]。
出典
[編集]- ^ a b “Familial hyperinsulinism | Genetic and Rare Diseases Information Center(GARD) – an NCATS Program”. rarediseases.info.nih.gov. 28 November 2016閲覧。
- ^ Reference, Genetics Home. “congenital hyperinsulinism”. Genetics Home Reference. 2016年10月7日閲覧。
- ^ Hussain, K. (August 2005). “Congenital hyperinsulinism”. Seminars in Fetal and Neonatal Medicine 10 (4): 369–376. doi:10.1016/j.siny.2005.03.001. PMID 15916932.
- ^ a b Congenital Hyperinsulinism: Background, Pathophysiology, Etiology. (2016-07-01).
- ^ a b Glaser, Benjamin (1 January 1993). “Familial Hyperinsulinism”. GeneReviews. PMID 20301549 9 October 2016閲覧。.update 2013
- ^ Hussain, K. (2005-08-24). “Congenital hyperinsulinism” (英語). Seminars in Fetal and Neonatal Medicine 10 (4): 369–376. doi:10.1016/j.siny.2005.03.001.
- ^ a b c d e f g h i Pagliara, Anthony S.; Karl, Irne E.; Haymond, Morey; Kipnis, David M. (April 1973). “Hypoglycemia in infancy and childhood. Part II” (英語). The Journal of Pediatrics 82 (4): 558–577. doi:10.1016/S0022-3476(73)80581-5.
- ^ a b c d e f g h i Kane, Charlotte; Shepherd, Ruth M.; Squires, Paul E.; Johnson, Paul R.V.; James, Roger F.L.; Milla, Peter J.; Aynsley-Green, Albert; Lindley, Keith J. et al. (1 December 1996). “Loss of functional KATP channels in pancreatic β–cells causes persistent hyperinsulinemic hypoglycemia of infancy” (英語). Nature Medicine 2 (12): 1344–1347. doi:10.1038/nm1296-1344. ISSN 1078-8956.
- ^ a b c d e f Stanley, Charles A.; Lieu, Yen K.; Hsu, Betty Y.L.; Burlina, Alberto B.; Greenberg, Cheryl R.; Hopwood, Nancy J.; Perlman, Kusiel; Rich, Barry H. et al. (1998-05-07). “Hyperinsulinism and Hyperammonemia in Infants with Regulatory Mutations of the Glutamate Dehydrogenase Gene” (英語). New England Journal of Medicine 338 (19): 1352–1357. doi:10.1056/NEJM199805073381904. ISSN 0028-4793.
- ^ a b c Rosenfeld, Elizabeth; De León, Diva D. (2023-03-28). “Bridging the gaps: recent advances in diagnosis, care, and outcomes in congenital hyperinsulinism” (英語). Current Opinion in Pediatrics Publish Ahead of Print. doi:10.1097/MOP.0000000000001243. ISSN 1040-8703.
- ^ a b Verkarre, V; Fournet, J C; de Lonlay, P; Gross-Morand, M S; Devillers, M; Rahier, J; Brunelle, F; Robert, J J et al. (1998-10-01). “Paternal mutation of the sulfonylurea receptor (SUR1) gene and maternal loss of 11p15 imprinted genes lead to persistent hyperinsulinism in focal adenomatous hyperplasia.” (英語). Journal of Clinical Investigation 102 (7): 1286–1291. doi:10.1172/JCI4495. ISSN 0021-9738. PMC 508975. PMID 9769320.
- ^ Banerjee, Indraneel; Raskin, Julie; Arnoux, Jean-Baptiste; De Leon, Diva D.; Weinzimer, Stuart A.; Hammer, Mette; Kendall, David M.; Thornton, Paul S. (2022-02-19). “Congenital hyperinsulinism in infancy and childhood: challenges, unmet needs and the perspective of patients and families” (英語). Orphanet Journal of Rare Diseases 17 (1): 61. doi:10.1186/s13023-022-02214-y. ISSN 1750-1172. PMC 8858501. PMID 35183224.
- ^ a b Otonkoski, Timo; Näntö-Salonen, Kirsti; Seppänen, Marko; Veijola, Riitta; Huopio, Hanna; Hussain, Khalid; Tapanainen, Päivi; Eskola, Olli et al. (January 2006). “Noninvasive diagnosis of focal hyperinsulinism of infancy with [18F-DOPA positron emission tomography”]. Diabetes 55 (1): 13–18. ISSN 0012-1797. PMID 16380471.
- ^ Williams, A. F. (1997). “Hypoglycaemia of the newborn: a review”. Bulletin of the World Health Organization 75 (3): 261–290. ISSN 0042-9686. PMC 2486945. PMID 9277014.
- ^ Bailey, Miranda J.; Rout, Allie; Harding, Jane E.; Alsweiler, Jane M.; Cutfield, Wayne S.; McKinlay, Christopher J. D. (5 December 2020). “Prolonged transitional neonatal hypoglycaemia: characterisation of a clinical syndrome” (英語). Journal of Perinatology 41 (5): 1149–1157. doi:10.1038/s41372-020-00891-w. ISSN 0743-8346.
- ^ Hoe, Francis M.; Thornton, Paul S.; Wanner, Laura A.; Steinkrauss, Linda; Simmons, Rebecca A.; Stanley, Charles A. (20 February 2006). “Clinical features and insulin regulation in infants with a syndrome of prolonged neonatal hyperinsulinism” (英語). The Journal of Pediatrics 148 (2): 207–212. doi:10.1016/j.jpeds.2005.10.002.
- ^ a b G.P, TALWAR (2016) (英語). TEXTBOOK OF BIOCHEMISTRY, BIOTECHNOLOGY, ALLIED AND MOLECULAR MEDICINE. PHI Learning Pvt. Ltd.. p. 240. ISBN 9788120351257 29 January 2017閲覧。
- ^ a b c James, C.; Kapoor, R. R.; Ismail, D.; Hussain, K. (1 May 2009). “The genetic basis of congenital hyperinsulinism” (英語). Journal of Medical Genetics 46 (5): 289–299. doi:10.1136/jmg.2008.064337. ISSN 1468-6244. PMID 19254908 29 January 2017閲覧。.
- ^ a b Arnoux, Jean-Baptiste; Verkarre, Virginie; Saint-Martin, Cécile; Montravers, Françoise; Brassier, Anaïs; Valayannopoulos, Vassili; Brunelle, Francis; Fournet, Jean-Christophe et al. (1 January 2011). “Congenital hyperinsulinism: current trends in diagnosis and therapy”. Orphanet Journal of Rare Diseases 6: 63. doi:10.1186/1750-1172-6-63. ISSN 1750-1172. PMC 3199232. PMID 21967988.
- ^ Kapoor, Ritika R; Flanagan, Sarah E; Arya, Ved Bhushan; Shield, Julian P; Ellard, Sian; Hussain, Khalid (1 April 2013). “Clinical and molecular characterisation of 300 patients with congenital hyperinsulinism”. European Journal of Endocrinology 168 (4): 557–564. doi:10.1530/EJE-12-0673. ISSN 0804-4643. PMC 3599069. PMID 23345197.
- ^ Snider, K. E.; Becker, S.; Boyajian, L.; Shyng, S.-L.; MacMullen, C.; Hughes, N.; Ganapathy, K.; Bhatti, T. et al. (1 February 2013). “Genotype and Phenotype Correlations in 417 Children With Congenital Hyperinsulinism” (英語). The Journal of Clinical Endocrinology & Metabolism 98 (2): E355–E363. doi:10.1210/jc.2012-2169. ISSN 0021-972X. PMC 3565119. PMID 23275527.
- ^ de Lonlay, P; Fournet, J C; Rahier, J; Gross-Morand, M S; Poggi-Travert, F; Foussier, V; Bonnefont, J P; Brusset, M C et al. (1997-08-15). “Somatic deletion of the imprinted 11p15 region in sporadic persistent hyperinsulinemic hypoglycemia of infancy is specific of focal adenomatous hyperplasia and endorses partial pancreatectomy.” (英語). Journal of Clinical Investigation 100 (4): 802–807. doi:10.1172/JCI119594. ISSN 0021-9738. PMC 508251. PMID 9259578.
- ^ a b c “Blood Glucose Monitoring - National Library of Medicine”. PubMed Health. 27 January 2017閲覧。
- ^ Sprague, Jennifer E.; Arbeláez, Ana María (2017-01-27). “Glucose Counterregulatory Responses to Hypoglycemia”. Pediatric Endocrinology Reviews 9 (1): 463–475. ISSN 1565-4753. PMC 3755377. PMID 22783644.
- ^ Maiorana, Arianna; Lepri, Francesca Romana; Novelli, Antonio; Dionisi-Vici, Carlo (2022-03-29). “Hypoglycaemia Metabolic Gene Panel Testing”. Frontiers in Endocrinology 13: 826167. doi:10.3389/fendo.2022.826167. ISSN 1664-2392. PMC 9001947. PMID 35422763.
- ^ Yang, Jigang; Hao, Ruirui; Zhu, Xiaohua (April 2013). “Diagnostic role of 18F-dihydroxyphenylalanine positron emission tomography in patients with congenital hyperinsulinism: a meta-analysis”. Nuclear Medicine Communications 34 (4): 347–353. doi:10.1097/MNM.0b013e32835e6ac6. ISSN 1473-5628. PMID 23376859.
- ^ Zenker, Martin; Mohnike, Klaus; Palm, Katja (2023-03-30). “Syndromic forms of congenital hyperinsulinism”. Frontiers in Endocrinology 14: 1013874. doi:10.3389/fendo.2023.1013874. ISSN 1664-2392. PMC 10098214. PMID 37065762.
- ^ Brioude, Frédéric; Kalish, Jennifer M.; Mussa, Alessandro; Foster, Alison C.; Bliek, Jet; Ferrero, Giovanni Battista; Boonen, Susanne E.; Cole, Trevor et al. (29 January 2018). “Clinical and molecular diagnosis, screening and management of Beckwith–Wiedemann syndrome: an international consensus statement” (英語). Nature Reviews Endocrinology 14 (4): 229–249. doi:10.1038/nrendo.2017.166. ISSN 1759-5029. PMC 6022848. PMID 29377879.
- ^ Wang, Kathleen H.; Kupa, Jonida; Duffy, Kelly A.; Kalish, Jennifer M. (2020-01-21). “Diagnosis and Management of Beckwith-Wiedemann Syndrome”. Frontiers in Pediatrics 7: 562. doi:10.3389/fped.2019.00562. ISSN 2296-2360. PMC 6990127. PMID 32039119.
- ^ Kalish, Jennifer M.; Arnoux, Jean-Baptiste (2019), De León-Crutchlow, Diva D.; Stanley, Charles A., eds., “Syndromic Causes of Congenital Hyperinsulinism”, Congenital Hyperinsulinism (Cham: Springer International Publishing): pp. 49–59, doi:10.1007/978-3-030-02961-6_4, ISBN 978-3-030-02960-9 2023年5月8日閲覧。
- ^ Bier, Dennis M; Leake, Rosemary D; Haymond, Morey W; Arnold, Kenneth J; Gruenke, Larry D; Sperling, Mark A; Kipnis, David M (1977-11-01). “Measurement of “True” Glucose Production Rates in Infancy and Childhood with 6,6-Dideuteroglucose” (英語). Diabetes 26 (11): 1016–1023. doi:10.2337/diab.26.11.1016. ISSN 0012-1797.
- ^ Palladino, Andrew A; Bennett, Michael J; Stanley, Charles A (2008-02-01). “Hyperinsulinism in Infancy and Childhood: When an Insulin Level Is Not Always Enough” (英語). Clinical Chemistry 54 (2): 256–263. doi:10.1373/clinchem.2007.098988. ISSN 0009-9147.
- ^ Ferrara, Christine; Patel, Payal; Becker, Susan; Stanley, Charles A.; Kelly, Andrea (17 October 2015). “Biomarkers of Insulin for the Diagnosis of Hyperinsulinemic Hypoglycemia in Infants and Children” (英語). The Journal of Pediatrics 168: 212–219. doi:10.1016/j.jpeds.2015.09.045.
- ^ Sakakibara, Azumi; Hashimoto, Yukiko; Kawakita, Rie; Hosokawa, Yuki; Nagahara, Keiko; Hasegawa, Yukihiro; Hoshino, Shin; Nagasaka, Hironori et al. (9 June 2017). “Diagnosis of congenital hyperinsulinism: Biochemical profiles during hypoglycemia” (英語). Pediatric Diabetes 19 (2): 259–264. doi:10.1111/pedi.12548.
- ^ Stanley, Charles A. (1 March 2016). “Perspective on the Genetics and Diagnosis of Congenital Hyperinsulinism Disorders” (英語). The Journal of Clinical Endocrinology & Metabolism 101 (3): 815–826. doi:10.1210/jc.2015-3651. ISSN 0021-972X. PMC 4803157. PMID 26908106.
- ^ Palladino, Andrew A.; Stanley, Charles A. (9 October 2010). “The hyperinsulinism/hyperammonemia syndrome” (英語). Reviews in Endocrine and Metabolic Disorders 11 (3): 171–178. doi:10.1007/s11154-010-9146-0. ISSN 1389-9155.
- ^ Zhang, Wei; Sang, Yan-Mei (4 November 2021). “Genetic pathogenesis, diagnosis, and treatment of short-chain 3-hydroxyacyl-coenzyme A dehydrogenase hyperinsulinism” (英語). Orphanet Journal of Rare Diseases 16 (1): 467. doi:10.1186/s13023-021-02088-6. ISSN 1750-1172. PMC 8567654. PMID 34736508.
- ^ Kelly, Andrea; Ng, Diva; Ferry, Robert J.; Grimberg, Adda; Koo-McCoy, Samantha; Thornton, Paul S.; Stanley, Charles A. (2001-08-01). “Acute Insulin Responses to Leucine in Children with the Hyperinsulinism/Hyperammonemia Syndrome” (英語). The Journal of Clinical Endocrinology & Metabolism 86 (8): 3724–3728. doi:10.1210/jcem.86.8.7755. ISSN 0021-972X. PMC 3313679. PMID 11502802.
- ^ Fourtner, Shannon H.; Stanley, Charles A.; Kelly, Andrea (July 2006). “Protein-sensitive hypoglycemia without leucine sensitivity in hyperinsulinism caused by KATP channel mutations” (英語). The Journal of Pediatrics 149 (1): 47–52. doi:10.1016/j.jpeds.2006.02.033.
- ^ a b c Yorifuji, Tohru (2014-06). “Congenital hyperinsulinism: current status and future perspectives”. Annals of Pediatric Endocrinology & Metabolism 19 (2): 57–68. doi:10.6065/apem.2014.19.2.57. ISSN 2287-1012. PMC 4114053. PMID 25077087.
- ^ Brar, Preneet Cheema; Heksch, Ryan; Cossen, Kristina; De Leon, Diva D; Kamboj, Manmohan K; Marks, Seth D; Marshall, Bess A; Miller, Ryan et al. (2020-12-01). “Management and Appropriate Use of Diazoxide in Infants and Children with Hyperinsulinism” (英語). The Journal of Clinical Endocrinology & Metabolism 105 (12): 3750–3761. doi:10.1210/clinem/dgaa543. ISSN 0021-972X.
- ^ Snider, K. E.; Becker, S.; Boyajian, L.; Shyng, S.-L.; MacMullen, C.; Hughes, N.; Ganapathy, K.; Bhatti, T. et al. (1 February 2013). “Genotype and Phenotype Correlations in 417 Children With Congenital Hyperinsulinism” (英語). The Journal of Clinical Endocrinology & Metabolism 98 (2): E355–E363. doi:10.1210/jc.2012-2169. ISSN 0021-972X. PMC 3565119. PMID 23275527.
- ^ States, Lisa J.; Saade-Lemus, Sandra; De Leon, Diva D. (July 2020). “18-F-L 3,4-Dihydroxyphenylalanine PET/Computed Tomography in the Management of Congenital Hyperinsulinism” (英語). PET Clinics 15 (3): 349–359. doi:10.1016/j.cpet.2020.03.004.
- ^ Adzick, N. Scott; De Leon, Diva D.; States, Lisa J.; Lord, Katherine; Bhatti, Tricia R.; Becker, Susan A.; Stanley, Charles A. (18 October 2018). “Surgical treatment of congenital hyperinsulinism: Results from 500 pancreatectomies in neonates and children” (英語). Journal of Pediatric Surgery 54 (1): 27–32. doi:10.1016/j.jpedsurg.2018.10.030. PMC 6339589. PMID 30343978.
- ^ Welters, Alena; Lerch, Christian; Kummer, Sebastian; Marquard, Jan; Salgin, Burak; Mayatepek, Ertan; Meissner, Thomas (25 November 2015). “Long-term medical treatment in congenital hyperinsulinism: a descriptive analysis in a large cohort of patients from different clinical centers” (英語). Orphanet Journal of Rare Diseases 10 (1): 150. doi:10.1186/s13023-015-0367-x. ISSN 1750-1172. PMC 4660626. PMID 26608306.
- ^ McMahon, Ann W.; Wharton, Gerold T.; Thornton, Paul; De Leon, Diva D. (2 December 2016). “Octreotide use and safety in infants with hyperinsulinism: Octreotide Use and Safety” (英語). Pharmacoepidemiology and Drug Safety 26 (1): 26–31. doi:10.1002/pds.4144. PMC 5286465. PMID 27910218.
- ^ Vajravelu, Mary Ellen; Congdon, Morgan; Mitteer, Lauren; Koh, Jamie; Givler, Stephanie; Shults, Justine; De León, Diva D. (7 August 2018). “Continuous Intragastric Dextrose: A Therapeutic Option for Refractory Hypoglycemia in Congenital Hyperinsulinism” (英語). Hormone Research in Paediatrics 91 (1): 62–68. doi:10.1159/000491105. ISSN 1663-2818. PMC 6661174. PMID 30086540.
- ^ Avatapalle, B.; Padidela, R.; Randell, T.; Banerjee, I. (2012-07-30). “Drug-induced hepatitis following use of octreotide for long-term treatment of congenital hyperinsulinism” (英語). Case Reports 2012 (jul30 1): bcr2012006271–bcr2012006271. doi:10.1136/bcr-2012-006271. ISSN 1757-790X. PMC 4543377. PMID 22850563.
- ^ Cuff, Heather; Lord, Katherine; Ballester, Lance; Scully, Tryce; Stewart, Nicole; De Leon, Diva D (2022-07-14). “The Use of Lanreotide in the Treatment of Congenital Hyperinsulinism” (英語). The Journal of Clinical Endocrinology & Metabolism 107 (8): e3115–e3120. doi:10.1210/clinem/dgac322. ISSN 0021-972X.
- ^ Herrera, Adriana; Vajravelu, Mary Ellen; Givler, Stephanie; Mitteer, Lauren; Avitabile, Catherine M; Lord, Katherine; De León, Diva D (2018-12-01). “Prevalence of Adverse Events in Children With Congenital Hyperinsulinism Treated With Diazoxide” (英語). The Journal of Clinical Endocrinology & Metabolism 103 (12): 4365–4372. doi:10.1210/jc.2018-01613. ISSN 0021-972X. PMC 6207144. PMID 30247666.
- ^ Thornton, Paul; Truong, Lisa; Reynolds, Courtney; Hamby, Tyler; Nedrelow, Jonathan (19 March 2019). “Rate of Serious Adverse Events Associated with Diazoxide Treatment of Patients with Hyperinsulinism” (英語). Hormone Research in Paediatrics 91 (1): 25–32. doi:10.1159/000497458. ISSN 1663-2818.
- ^ Welters, Alena; Lerch, Christian; Kummer, Sebastian; Marquard, Jan; Salgin, Burak; Mayatepek, Ertan; Meissner, Thomas (25 November 2015). “Long-term medical treatment in congenital hyperinsulinism: a descriptive analysis in a large cohort of patients from different clinical centers” (英語). Orphanet Journal of Rare Diseases 10 (1): 150. doi:10.1186/s13023-015-0367-x. ISSN 1750-1172. PMC 4660626. PMID 26608306.
- ^ a b Adzick, N. Scott; De Leon, Diva D.; States, Lisa J.; Lord, Katherine; Bhatti, Tricia R.; Becker, Susan A.; Stanley, Charles A. (18 October 2018). “Surgical treatment of congenital hyperinsulinism: Results from 500 pancreatectomies in neonates and children” (英語). Journal of Pediatric Surgery 54 (1): 27–32. doi:10.1016/j.jpedsurg.2018.10.030. PMC 6339589. PMID 30343978.
- ^ a b Lord, Katherine; Radcliffe, Jerilynn; Gallagher, Paul R.; Adzick, N. Scott; Stanley, Charles A.; De León, Diva D. (1 September 2015). “High Risk of Diabetes and Neurobehavioral Deficits in Individuals With Surgically Treated Hyperinsulinism” (英語). The Journal of Clinical Endocrinology & Metabolism 100 (11): 4133–4139. doi:10.1210/jc.2015-2539. ISSN 0021-972X. PMC 4702456. PMID 26327482.
- ^ Beltrand, Jacques; Caquard, Marylène; Arnoux, Jean-Baptiste; Laborde, Kathleen; Velho, Gilberto; Verkarre, Virginie; Rahier, Jacques; Brunelle, Francis et al. (2012-02-01). “Glucose Metabolism in 105 Children and Adolescents After Pancreatectomy for Congenital Hyperinsulinism” (英語). Diabetes Care 35 (2): 198–203. doi:10.2337/dc11-1296. ISSN 0149-5992. PMC 3263917. PMID 22190679.
- ^ Avatapalle, Hima Bindu; Banerjee, Indraneel; Shah, Sajni; Pryce, Megan; Nicholson, Jacqueline; Rigby, Lindsey; Caine, Louise; Didi, Mohammed et al. (2013). “Abnormal Neurodevelopmental Outcomes are Common in Children with Transient Congenital Hyperinsulinism”. Frontiers in Endocrinology 4. doi:10.3389/fendo.2013.00060. ISSN 1664-2392. PMC 3657691. PMID 23730298.
- ^ Meissner, T; Wendel, U; Burgard, P; Schaetzle, S; Mayatepek, E (2003-07-01). “Long-term follow-up of 114 patients with congenital hyperinsulinism”. European Journal of Endocrinology: 43–51. doi:10.1530/eje.0.1490043. ISSN 0804-4643.
- ^ Menni, Francesca; de Lonlay, Pascale; Sevin, Caroline; Touati, Guy; Peigné, Catherine; Barbier, Valérie; Nihoul-Fékété, Claire; Saudubray, Jean-Marie et al. (2001-03-01). “Neurologic Outcomes of 90 Neonates and Infants With Persistent Hyperinsulinemic Hypoglycemia” (英語). Pediatrics 107 (3): 476–479. doi:10.1542/peds.107.3.476. ISSN 1098-4275.
- ^ Arnoux, Jean-Baptiste; Verkarre, Virginie; Saint-Martin, Cécile; Montravers, Françoise; Brassier, Anaïs; Valayannopoulos, Vassili; Brunelle, Francis; Fournet, Jean-Christophe et al. (3 October 2011). “Congenital hyperinsulinism: current trends in diagnosis and therapy” (英語). Orphanet Journal of Rare Diseases 6 (1). doi:10.1186/1750-1172-6-63. ISSN 1750-1172. PMC 3199232. PMID 21967988.
- ^ Yau, Daphne; Laver, Thomas W.; Dastamani, Antonia; Senniappan, Senthil; Houghton, Jayne A. L.; Shaikh, Guftar; Cheetham, Tim; Mushtaq, Talat et al. (2020-02-06). Brusgaard, Klaus. ed. “Using referral rates for genetic testing to determine the incidence of a rare disease: The minimal incidence of congenital hyperinsulinism in the UK is 1 in 28,389” (英語). PLOS ONE 15 (2): e0228417. doi:10.1371/journal.pone.0228417. ISSN 1932-6203. PMC 7004321. PMID 32027664.
- ^ Männistö, Jonna M. E.; Jääskeläinen, Jarmo; Otonkoski, Timo; Huopio, Hanna (2021-03-25). “Long-Term Outcome and Treatment in Persistent and Transient Congenital Hyperinsulinism: A Finnish Population-Based Study”. The Journal of Clinical Endocrinology and Metabolism 106 (4): e1542–e1551. doi:10.1210/clinem/dgab024. ISSN 1945-7197. PMC 7993590. PMID 33475139.
- ^ Rosenfeld, Elizabeth; Ganguly, Arupa; De Leon, Diva D. (14 August 2019). “Congenital hyperinsulinism disorders: Genetic and clinical characteristics” (英語). American Journal of Medical Genetics Part C: Seminars in Medical Genetics 181 (4): 682–692. doi:10.1002/ajmg.c.31737. ISSN 1552-4868. PMC 7229866. PMID 31414570.
- ^ Banerjee, I; Skae, M; Flanagan, S E; Rigby, L; Patel, L; Didi, M; Blair, J; Ehtisham, S et al. (1 May 2011). “The contribution of rapid KATP channel gene mutation analysis to the clinical management of children with congenital hyperinsulinism”. European Journal of Endocrinology 164 (5): 733–740. doi:10.1530/EJE-10-1136. ISSN 0804-4643.
- ^ Adzick, N. Scott; De Leon, Diva D.; States, Lisa J.; Lord, Katherine; Bhatti, Tricia R.; Becker, Susan A.; Stanley, Charles A. (18 October 2018). “Surgical treatment of congenital hyperinsulinism: Results from 500 pancreatectomies in neonates and children” (英語). Journal of Pediatric Surgery 54 (1): 27–32. doi:10.1016/j.jpedsurg.2018.10.030. PMC 6339589. PMID 30343978.
- ^ Mazor-Aronovitch, K; Gillis, D; Lobel, D; Hirsch, H J; Pinhas-Hamiel, O; Modan-Moses, D; Glaser, B; Landau, H (1 October 2007). “Long-term neurodevelopmental outcome in conservatively treated congenital hyperinsulinism”. European Journal of Endocrinology 157 (4): 491–497. doi:10.1530/EJE-07-0445. ISSN 0804-4643.
- ^ Salomon-Estebanez, Maria; Flanagan, Sarah E.; Ellard, Sian; Rigby, Lindsey; Bowden, Louise; Mohamed, Zainab; Nicholson, Jacqueline; Skae, Mars et al. (1 December 2016). “Conservatively treated Congenital Hyperinsulinism (CHI) due to K-ATP channel gene mutations: reducing severity over time” (英語). Orphanet Journal of Rare Diseases 11 (1): 163. doi:10.1186/s13023-016-0547-3. ISSN 1750-1172. PMC 5133749. PMID 27908292.
- ^ Flanagan, Se; Kapoor, Rr; Banerjee, I; Hall, C; Smith, Vv; Hussain, K; Ellard, S (5 May 2011). “Dominantly acting ABCC8 mutations in patients with medically unresponsive hyperinsulinaemic hypoglycaemia” (英語). Clinical Genetics 79 (6): 582–587. doi:10.1111/j.1399-0004.2010.01476.x. ISSN 0009-9163. PMC 3375476. PMID 20573158.
- ^ Pinney, Sara E.; MacMullen, Courtney; Becker, Susan; Lin, Yu-Wen; Hanna, Cheryl; Thornton, Paul; Ganguly, Arupa; Shyng, Show-Ling et al. (2008-08-01). “Clinical characteristics and biochemical mechanisms of congenital hyperinsulinism associated with dominant KATP channel mutations” (英語). Journal of Clinical Investigation 118 (8): 2877–2886. doi:10.1172/JCI35414. ISSN 0021-9738. PMC 2441858. PMID 18596924.
- ^ Kapoor, R. R.; Flanagan, S. E.; James, C. T.; McKiernan, J.; Thomas, A. M.; Harmer, S. C.; Shield, J. P.; Tinker, A. et al. (15 June 2011). “Hyperinsulinaemic hypoglycaemia and diabetes mellitus due to dominant ABCC8/KCNJ11 mutations” (英語). Diabetologia 54 (10): 2575–2583. doi:10.1007/s00125-011-2207-4. ISSN 0012-186X. PMC 3168751. PMID 21674179.
- ^ McGlacken-Byrne, Sinéad M; Mohammad, Jasmina Kallefullah; Conlon, Niamh; Gubaeva, Diliara; Siersbæk, Julie; Schou, Anders Jørgen; Demirbilek, Huseyin; Dastamani, Antonia et al. (2022-04-01). “Clinical and genetic heterogeneity of HNF4A/HNF1A mutations in a multicentre paediatric cohort with hyperinsulinaemic hypoglycaemia”. European Journal of Endocrinology 186 (4): 417–427. doi:10.1530/EJE-21-0897. ISSN 0804-4643.
- ^ Yau, Daphne; Colclough, Kevin; Natarajan, Anuja; Parikh, Ruchi; Canham, Natalie; Didi, Mohammed; Senniappan, Senthil; Banerjee, Indraneel (20 April 2020). “Congenital hyperinsulinism due to mutations in HNF1A” (英語). European Journal of Medical Genetics 63 (6): 103928. doi:10.1016/j.ejmg.2020.103928.
- ^ Lord, Katherine; Radcliffe, Jerilynn; Gallagher, Paul R.; Adzick, N. Scott; Stanley, Charles A.; De León, Diva D. (1 September 2015). “High Risk of Diabetes and Neurobehavioral Deficits in Individuals With Surgically Treated Hyperinsulinism” (英語). The Journal of Clinical Endocrinology & Metabolism 100 (11): 4133–4139. doi:10.1210/jc.2015-2539. ISSN 0021-972X. PMC 4702456. PMID 26327482.
- ^ Avatapalle, Hima Bindu; Banerjee, Indraneel; Shah, Sajni; Pryce, Megan; Nicholson, Jacqueline; Rigby, Lindsey; Caine, Louise; Didi, Mohammed et al. (2013). “Abnormal Neurodevelopmental Outcomes are Common in Children with Transient Congenital Hyperinsulinism”. Frontiers in Endocrinology 4. doi:10.3389/fendo.2013.00060. ISSN 1664-2392. PMC 3657691. PMID 23730298.
- ^ a b c d Pasquini, Tai L. S.; Mesfin, Mahlet; Schmitt, Jennifer; Raskin, Julie (2022-06-02). “Global Registries in Congenital Hyperinsulinism”. Frontiers in Endocrinology 13: 876903. doi:10.3389/fendo.2022.876903. ISSN 1664-2392. PMC 9201947. PMID 35721728.
- ^ Banerjee, Indraneel; Raskin, Julie; Arnoux, Jean-Baptiste; De Leon, Diva D.; Weinzimer, Stuart A.; Hammer, Mette; Kendall, David M.; Thornton, Paul S. (2022-02-19). “Congenital hyperinsulinism in infancy and childhood: challenges, unmet needs and the perspective of patients and families” (英語). Orphanet Journal of Rare Diseases 17 (1): 61. doi:10.1186/s13023-022-02214-y. ISSN 1750-1172. PMC 8858501. PMID 35183224.
- ^ Banerjee, Indraneel; Forsythe, Lynette; Skae, Mars; Avatapalle, Hima Bindu; Rigby, Lindsey; Bowden, Louise E.; Craigie, Ross; Padidela, Raja et al. (2016-02-09). “Feeding Problems Are Persistent in Children with Severe Congenital Hyperinsulinism”. Frontiers in Endocrinology 7. doi:10.3389/fendo.2016.00008. ISSN 1664-2392. PMC 4747152. PMID 26903946.
- ^ Worth, Chris; Hall, Caroline; Wilson, Sarah; Gilligan, Niamh; O'Shea, Elaine; Salomon-Estebanez, Maria; Dunne, Mark; Banerjee, Indraneel (2020-03-18). “Delayed Resolution of Feeding Problems in Patients With Congenital Hyperinsulinism”. Frontiers in Endocrinology 11: 143. doi:10.3389/fendo.2020.00143. ISSN 1664-2392. PMC 7093368. PMID 32256453.
- ^ Chen, Suet Ching; Dastamani, Antonia; Pintus, Donatella; Yau, Daphne; Aftab, Sommayya; Bath, Louise; Swinburne, Craig; Hunter, Lindsey et al. (14 September 2019). “Diazoxide‐induced pulmonary hypertension in hyperinsulinaemic hypoglycaemia: Recommendations from a multicentre study in the United Kingdom” (英語). Clinical Endocrinology 91 (6): 770–775. doi:10.1111/cen.14096. ISSN 0300-0664.
- ^ Banerjee, I.; Salomon-Estebanez, M.; Shah, P.; Nicholson, J.; Cosgrove, K. E.; Dunne, M. J. (23 September 2018). “Therapies and outcomes of congenital hyperinsulinism-induced hypoglycaemia”. Diabetic Medicine: A Journal of the British Diabetic Association 36 (1): 9–21. doi:10.1111/dme.13823. ISSN 1464-5491. PMC 6585719. PMID 30246418.
- ^ Herrera, Adriana; Vajravelu, Mary Ellen; Givler, Stephanie; Mitteer, Lauren; Avitabile, Catherine M; Lord, Katherine; De León, Diva D (2018-12-01). “Prevalence of Adverse Events in Children With Congenital Hyperinsulinism Treated With Diazoxide” (英語). The Journal of Clinical Endocrinology & Metabolism 103 (12): 4365–4372. doi:10.1210/jc.2018-01613. ISSN 0021-972X. PMC 6207144. PMID 30247666.
- ^ Beltrand, Jacques; Caquard, Marylène; Arnoux, Jean-Baptiste; Laborde, Kathleen; Velho, Gilberto; Verkarre, Virginie; Rahier, Jacques; Brunelle, Francis et al. (2012-02-01). “Glucose Metabolism in 105 Children and Adolescents After Pancreatectomy for Congenital Hyperinsulinism” (英語). Diabetes Care 35 (2): 198–203. doi:10.2337/dc11-1296. ISSN 0149-5992. PMC 3263917. PMID 22190679.
- ^ Arya, Ved Bhushan; Senniappan, Senthil; Demirbilek, Huseyin; Alam, Syeda; Flanagan, Sarah E.; Ellard, Sian; Hussain, Khalid (2014-05-19). Brusgaard, Klaus. ed. “Pancreatic Endocrine and Exocrine Function in Children following Near-Total Pancreatectomy for Diffuse Congenital Hyperinsulinism” (英語). PLoS ONE 9 (5): e98054. doi:10.1371/journal.pone.0098054. ISSN 1932-6203. PMC 4026387. PMID 24840042.
- ^ a b c d Thornton, Paul S.; Stanley, Charles A.; De Leon, Diva D. (2022). “Congenital Hyperinsulinism: An Historical Perspective” (英語). Hormone Research in Paediatrics 95 (6): 631–637. doi:10.1159/000526442. ISSN 1663-2818.
- ^ Stanley, C. A.; Baker, L. (1976). “Hyperinsulinism in infants and children: diagnosis and therapy”. Advances in Pediatrics 23: 315–355. ISSN 0065-3101. PMID 795282.
- ^ Pagliara, Anthony S.; Karl, Irene E.; Haymond, Morey; Kipnis, David M. (March 1973). “Hypoglycemia in infancy and childhood. Part I” (英語). The Journal of Pediatrics 82 (3): 365–379. doi:10.1016/S0022-3476(73)80109-X.
- ^ Pagliara, Anthony S.; Karl, Irne E.; Haymond, Morey; Kipnis, David M. (April 1973). “Hypoglycemia in infancy and childhood. Part II” (英語). The Journal of Pediatrics 82 (4): 558–577. doi:10.1016/S0022-3476(73)80581-5.
- ^ a b Stanley, Charles A. (1 March 2016). “Perspective on the Genetics and Diagnosis of Congenital Hyperinsulinism Disorders” (英語). The Journal of Clinical Endocrinology & Metabolism 101 (3): 815–826. doi:10.1210/jc.2015-3651. ISSN 0021-972X. PMC 4803157. PMID 26908106.
- ^ Kane, Charlotte; Shepherd, Ruth M.; Squires, Paul E.; Johnson, Paul R.V.; James, Roger F.L.; Milla, Peter J.; Aynsley-Green, Albert; Lindley, Keith J. et al. (1 December 1996). “Loss of functional KATP channels in pancreatic β–cells causes persistent hyperinsulinemic hypoglycemia of infancy” (英語). Nature Medicine 2 (12): 1344–1347. doi:10.1038/nm1296-1344. ISSN 1078-8956.
- ^ Dunne, Mark J.; Kane, Charlotte; Shepherd, Ruth M.; Sanchez, Jorge A.; James, Roger F.L.; Johnson, Paul R.V.; Aynsley-Green, Albert; Lu, Shan et al. (1997-03-06). “Familial Persistent Hyperinsulinemic Hypoglycemia of Infancy and Mutations in the Sulfonylurea Receptor” (英語). New England Journal of Medicine 336 (10): 703–706. doi:10.1056/NEJM199703063361005. ISSN 0028-4793.
- ^ Glaser, Benjamin; Kesavan, Prebakaran; Heyman, Mozhgan; Davis, Elizabeth; Cuesta, Antonio; Buchs, Andreas; Stanley, Charles A.; Thornton, Paul S. et al. (1998-01-22). “Familial Hyperinsulinism Caused by an Activating Glucokinase Mutation” (英語). New England Journal of Medicine 338 (4): 226–230. doi:10.1056/NEJM199801223380404. ISSN 0028-4793.
- ^ Stanley, Charles A.; Lieu, Yen K.; Hsu, Betty Y.L.; Burlina, Alberto B.; Greenberg, Cheryl R.; Hopwood, Nancy J.; Perlman, Kusiel; Rich, Barry H. et al. (1998-05-07). “Hyperinsulinism and Hyperammonemia in Infants with Regulatory Mutations of the Glutamate Dehydrogenase Gene” (英語). New England Journal of Medicine 338 (19): 1352–1357. doi:10.1056/NEJM199805073381904. ISSN 0028-4793.
- ^ Rosenfeld, Elizabeth; De León, Diva D. (2023-03-28). “Bridging the gaps: recent advances in diagnosis, care, and outcomes in congenital hyperinsulinism” (英語). Current Opinion in Pediatrics Publish Ahead of Print. doi:10.1097/MOP.0000000000001243. ISSN 1040-8703.
- ^ Hewat, Thomas I.; Johnson, Matthew B.; Flanagan, Sarah E. (7 July 2022). “Congenital Hyperinsulinism: Current Laboratory-Based Approaches to the Genetic Diagnosis of a Heterogeneous Disease”. Frontiers in Endocrinology 13. doi:10.3389/fendo.2022.873254. ISSN 1664-2392. PMC 9302115. PMID 35872984.
- ^ Verkarre, V; Fournet, J C; de Lonlay, P; Gross-Morand, M S; Devillers, M; Rahier, J; Brunelle, F; Robert, J J et al. (1998-10-01). “Paternal mutation of the sulfonylurea receptor (SUR1) gene and maternal loss of 11p15 imprinted genes lead to persistent hyperinsulinism in focal adenomatous hyperplasia.” (英語). Journal of Clinical Investigation 102 (7): 1286–1291. doi:10.1172/JCI4495. ISSN 0021-9738. PMC 508975. PMID 9769320.
- ^ Otonkoski, Timo; Näntö-Salonen, Kirsti; Seppänen, Marko; Veijola, Riitta; Huopio, Hanna; Hussain, Khalid; Tapanainen, Päivi; Eskola, Olli et al. (January 2006). “Noninvasive diagnosis of focal hyperinsulinism of infancy with [18F-DOPA positron emission tomography”]. Diabetes 55 (1): 13–18. ISSN 0012-1797. PMID 16380471.
- ^ Raskin, Julie; Pasquini, Tai L. S.; Bose, Sheila; Tallis, Dina; Schmitt, Jennifer (2022). “Congenital Hyperinsulinism International: A Community Focused on Improving the Lives of People Living With Congenital Hyperinsulinism”. Frontiers in Endocrinology 13. doi:10.3389/fendo.2022.886552. ISSN 1664-2392. PMC 9097272. PMID 35573986.
- ^ Ng, Sze May; Dearman, Sarah; Fisher, Mark; Mushtaq, Talat; Randell, Tabitha (2023-02-09). “Paediatric Society and Hyperinsulinism Charity National Surveys on CGM Access for Patients With Recurrent Hypoglycaemia”. Journal of the Endocrine Society 7 (4): bvad021. doi:10.1210/jendso/bvad021. ISSN 2472-1972. PMC 9942542. PMID 36824585.
- ^ “HI Global Registry”. www.higlobalregistry.org. 2023年6月25日閲覧。
関連文献
[編集]- Hoyme, Louanne Hudgins; Toriello, Helga V.; Enns, Gregory M.; Hoyme, H. Eugene (2014) (英語). Signs and symptoms of genetic disease : a handbook. Oxford: Oxford University Press. ISBN 9780199930975
- (英語) Care of the newborn a handbook for primary care. Philadelphia: Lippincott Williams & Wilkins. (2005). ISBN 9780781755856
