塩化セリウム(III)
| 塩化セリウム(III) | |
|---|---|

| |
|

|
Cerium(III) chloride | |
別称 Cerous chloride | |
| 識別情報 | |
| CAS登録番号 | 7790-86-5 |
| PubChem | 24636 |
| ChemSpider | 23038 |
| UNII | TH8E3IE00V?, 188BE3J495 (7水和物) |
| EC番号 | 232-227-8 |
| ChEBI | |
| Gmelin参照 | 1828 |
| |
| |
| 特性 | |
| 化学式 | CeCl3 |
| モル質量 | 246.48 g/mol(無水) 372.58 g/mol(7水和物) |
| 外観 | 微細白色粉末 |
| 密度 | 3.97 g/cm3 |
| 融点 |
817 °C, 1090 K, 1503 °F |
| 沸点 |
1727 °C, 2000 K, 3141 °F |
| 水への溶解度 | 100 g/100 ml |
| 溶解度 | アルコールに可溶 |
| 磁化率 | +2490.0·10−6 cm3/mol |
| 構造 | |
| 結晶構造 | 六方晶(UCl3型)、hP8 |
| 空間群 | P63/m, No. 176 |
| 配位構造 | 四角面三冠三角柱形 (9配位) |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H315, H318, H319, H335, H400, H410 |
| Pフレーズ | P261, P264, P271, P273, P280, P302+352, P304+340, P305+351+338, P310, P312, P321, P332+313, P337+313, P362 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| その他の陰イオン | 酸化セリウム(III) フッ化セリウム(III) 臭化セリウム(III) ヨウ化セリウム(III) |
| その他の陽イオン | 塩化ランタン(III) 塩化プラセオジム(III) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化セリウム(III)(えんかせりうむ(III)、化学式CeCl3)は、セリウムと塩素の化合物である。白色の吸湿性を持つ塩であり、湿度の高い空気に曝されると速やかに水を吸収して水和物を形成する。水和物は様々な組成持ちうるが、7水和物CeCl3·7H2Oが知られている。水に溶解性が高く、(無水物の時は)エタノールおよびアセトンに可溶である[1]。
無水CeCl3の調製
[編集]水和物のみを単純に急速加熱すると少量の加水分解が起こりうる[2]。
有用な形態の無水CeCl3は、真空中で何時間もかけて7水和物を140 °Cまで注意深く徐々に加熱することで調製することができる[1][3][4]。これは加水分解で生じた少量のCeOClを含むかどうかは分からないが、有機リチウムやグリニャール試薬と共に使用するのに適している。純粋な無水CeCl3は高真空下で4から6等量の塩化アンモニウムと共に水和物を400 °Cまでゆっくりと加熱するか[2][5][6][7]、過剰の塩化チオニルと共に3時間加熱する[2][8] ことによって得られる。また無水物は金属セリウムと塩化水素から調製することもできる[9][10]。これは高真空下で高温昇華によって大抵精製される。
使用
[編集]塩化セリウム(III) は、フリーデル・クラフツ・アシル化に使われるルイス酸であるトリフルオロメタンスルホン酸セリウム(III) といった他のセリウム塩の調製のための出発物質として使うことができる。また、それ自身がルイス酸として使用される(例えばフリーデル・クラフツ・アルキル化における触媒として[11])。
α,β-不飽和カルボニル化合物のルーシェ還元[12]は有機合成において人気のある手法となっており、CeCl3·7H2Oが水素化ホウ素ナトリウムと組み合わせて使用される。例えば、カルボンはアリルアルコール1のみを与え、飽和アルコール2は形成されない。CeCl3なしでは、1と2の混合物が形成される。
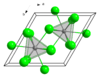
有機合成におけるもう1つの重要な利用法はケトンのアルキル化である。単純な有機リチウム試薬を使用するとエノラートが形成されてしまう。例えば、化合物3はCeCl3が存在しないとエノラートを単に形成すると予想されるが、CeCl3が存在すると速やかなアルキル化が起こる[3]。
脚注
[編集]- ^ a b Paquette, L. A. (1999). Coates, R. M.; Denmark, S. E.. eds. Handbook of Reagents for Organic Synthesis: Reagents, Auxiliaries and Catalysts for C-C Bond Formation. New York: Wiley. ISBN 0-471-97924-4
- ^ a b c Edelmann, F. T.; Poremba, P. (1997). Herrmann, W. A.. ed. Synthetic Methods of Organometallic and Inorganic Chemistry. VI. Stuttgart: Georg Thieme Verlag. ISBN 3-13-103021-6
- ^ a b Johnson, C. R.; Tait, B. D. (1987). “A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds”. Journal of Organic Chemistry 52 (2): 281–283. doi:10.1021/jo00378a024. ISSN 0022-3263.
- ^ Dimitrov, Vladimir; Kostova, Kalina; Genov, Miroslav (1996). “Anhydrous cerium(III) chloride — Effect of the drying process on activity and efficiency”. Tetrahedron Letters 37 (37): 6787–6790. doi:10.1016/S0040-4039(96)01479-7.
- ^ Taylor, M. D.; Carter, P. C. (1962). “Preparation of anhydrous lanthanide halides, especially iodides”. Journal of Inorganic and Nuclear Chemistry 24 (4): 387–391. doi:10.1016/0022-1902(62)80034-7.
- ^ Kutscher, J.; Schneider, A. (1971). “Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden”. Inorg. Nucl. Chem. Lett. 7 (9): 815. doi:10.1016/0020-1650(71)80253-2.
- ^ Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements. New York: Pergamon Press. ISBN 0-08-022056-8
- ^ Freeman, J. H.; Smith, M. L. (1958). “The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride”. Journal of Inorganic and Nuclear Chemistry 7 (3): 224–227. doi:10.1016/0022-1902(58)80073-1.
- ^ Druding, L. F.; Corbett, J. D. (1961). “Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide”. Journal of the American Chemical Society 83 (11): 2462–2467. doi:10.1021/ja01472a010. ISSN 0002-7863.
- ^ Corbett, J. D. (1973). “Reduced Halides of the Rare Earth Elements”. Rev. Chim. Minérale 10: 239.
- ^ Mine, Norioki; Fujiwara, Yuzo; Taniguchi, Hiroshi (1986). “Trichlorolanthanoid (LnCl3)-catalyzed Friedel-Crafts alkylation reactions”. Chemistry Letters 15 (3): 357–360. doi:10.1246/cl.1986.357.
- ^ Luche, Jean-Louis; Rodriguez-Hahn, Lydia; Crabbé, Pierre (1978). “Reduction of natural enones in the presence of cerium trichloride”. Journal of the Chemical Society, Chemical Communications (14): 601–602. doi:10.1039/C39780000601.
推薦文献
[編集]- CRC Handbook of Chemistry and Physics (58th edition), CRC Press, West Palm Beach, Florida, 1977.
- Anwander, R. (1999). Kobayashi, S.. ed. Lanthanides: Chemistry and Use in Organic Synthesis. Berlin: Springer-Verlag. pp. 10–12