ヘモレオロジー
ヘモレオロジー(英: hemorheology) または 血液レオロジー (英: blood rheology)とは、血液とその構成要素(血漿や血球など)の流体としての性質を研究するレオロジーの一分野である。血液の適切な組織灌流は、血液の流動学的性質が適正な範囲内にあることにより得られる。これら流動学的性質の変動は疾患の病態生理において重要な役割を果たしている[1]。血液の粘度を決定する要因は、血漿の粘度、ヘマトクリット、そして赤血球の力学的性質である。赤血球は、その変形能と凝集能の観点から,力学的に特有の振る舞いを示すことで知られている[2]。そのため、血液は非ニュートン流体として振る舞う。
非ニュートン流体としての血液の性質を示すものとして、血液の粘度は剪断速度(ずり速度)に応じて変わる。心臓の最大収縮期のように剪断速度が高い状況では血液の粘度は下がり、一方拡張末期で血流速度が下がると血液の粘度は上昇する。それ故、血液は剪断減粘性を持つ流体であると言える。
血液の粘性
[編集]血液の粘性は血液が流れる際の抵抗や粘着性を表す指標である。この生物物理学的性質は、血流の血管壁に対する摩擦や、静脈還流量、心拍出に要する心臓の仕事量、そして体内の各組織や臓器への酸素運搬の効率などを決定する重要な要因となり、更にこれらの心血管系の機能が、血管抵抗、前負荷、後負荷、そして組織灌流にそれぞれ直接関係することになる。
血液の粘性を決定する最も主要な要因はヘマトクリット、赤血球変形能、赤血球凝集能、そして血漿の粘度である。血漿の粘度はその含水率と血漿中に含まれる高分子要素により決定される。即ち、血漿蛋白質の濃度とその蛋白質の種類に影響されることになる[3]。しかし、実際血液の粘性に最も強い影響を与えるのはヘマトクリットである。例えばヘマトクリットが1上昇しただけで、粘度は4%上昇する[2]。この関係はヘマトクリットの上昇に伴い更に鋭敏になり、多血症の場合のようにヘマトクリットが60%から70%程度まで上昇すると、[4] 血液の粘度は水の10倍程になり、血管内を流れる血流は抵抗の上昇のために著明に遅延することになる[5]。その結果として、組織への酸素運搬効率の低下に繋がる[6]。血液の粘性に影響を与えるその他の要因は温度がある。温度が下降すると粘度は増加するため、低体温症の際には循環障害を起こすことがある。
臨床との関連
[編集]血漿の粘度の上昇は冠動脈疾患や末梢血管疾患の病態の進行に相関する[3][4]。また従来から提唱されてきた多くの心血管系リスク因子と心血管イベントに与える影響はそれぞれ全血の粘度と相関がある。高血圧、トータルコレステロール、LDL-コレステロール、中性脂肪、カイロミクロン、VLDL-コレステロール、糖尿病、そしてメタボリックシンドローム、肥満、喫煙、男性、また加齢などの因子は全て血液粘度に相関がある。一方HDL-コレステロールは血液粘度に対し負の相関がある。貧血は血液粘度を減少させ、結果として心不全に繋がることがある[7]。
正常範囲
[編集]単位を Pa・s とすると、血液粘度の正常範囲は37℃で 3 × 10−3 から 4 × 10−3であり[8]、CGS単位系ではそれぞれ 3 〜 4 センチポアズ(cP)である。以下の式でμは粘度、ρは密度、νは動粘度を表す。
血液粘度の測定は粘度計を用いる。様々な剪断速度の条件において測定可能な回転粘度計などを用いて測定出来る[9]。
血液の粘弾性
[編集]粘弾性は、心臓が血液を全身に拍出する際に、赤血球の変形により蓄えられる弾性エネルギーに由来する血液の特性である。心臓から血液に伝達されたエネルギーは、一部は弾性体としての細胞に蓄えられ、また別の一部は粘性として散逸し、残ったエネルギーが血液の運動エネルギーとなる。心拍動を考慮に入れることにより弾性の寄与が明瞭になり、血液を純粋な粘性流体として捉える考え方は不適切であることが分かる。血液は通常の流体とは異なり、より正確に言うと弾性体としての細胞の懸濁液(もしくはゾル)として記述することが出来る。
赤血球は血液の体積の約半分を占め、弾性を有する。この弾性が血液の粘弾性に対して最も大きく寄与している。正常範囲のヘマトクリットでも赤血球の占める割合が大きいため、血球は他の近傍の血球との相互作用無しには移動もしくは変形することが出来ない。計算によると(A. Burton[10])、通常の状態で赤血球の(変形を考慮しない場合の)最大の体積の割合は58%である。赤血球同士の間のスペースが限られているため、血液が流れるためには細胞間の相互作用が重要な役割を果たす。この相互作用と血球の凝集能は血液の粘弾性に対する大きな寄与因子となっている。また赤血球の変形・凝集はその配置や方向が血流の影響を受けており、血液の粘弾性に寄与する第三の主要な因子として関連している[11][12]。
血液の粘弾性に寄与するその他の因子として、血漿の粘度と組成、温度、流速や剪断速度がある。これらの要素が相まって、人間の血液の粘弾性、非ニュートン流体、そしてチキソトロピーといった特性を構成している[13]。
赤血球は静止しているか剪断速度が非常に小さい時にエネルギー的に起こりやすい反応として、凝集して積み重なる傾向がある(連銭形成)。凝集する誘引となるのは細胞表面の荷電基とフィブリノゲン・グロブリンである[14]。この赤血球の凝集の構造は、細胞の変形が最も小さくなるような配列で構成されている。非常に小さい剪断速度のもとでは、血液の粘弾性に与える影響は赤血球の凝集が最も支配的であり、対して変形能の寄与は少ない。剪断速度が増加するにつれて凝集体のサイズは小さくなり、さらに増加すると赤血球は、血漿が間を流れることが出来るような間隙を作り、また他の血球が滑って通過出来るように再配列する。この低値~中間程度の剪断速度の範囲では、血球は近傍の血球が通過できるように小刻みに動く。そして凝集が粘弾性に与える影響は消失し、赤血球の変形能の寄与が増加し始める。剪断速度が大きくなると、赤血球は伸展・変形し、血流の方向に従って並ぶようになる。この時血漿により分離された血球の層が形成され、血球の層が血漿の層の上を滑走し、血液はより流れやすくなる。粘性・弾性は減少し、血液の粘弾性に与える影響は赤血球の変形能が支配的となる。
Maxwell モデル
[編集]小さい立方体状の体積を占める血液を仮定する(図1)。心拍動による外力の影響と、境界からの剪断力を受けるものとする。
この立方体の変形は次の二つの要素が考えられる:
- 可塑的な弾性変形
- 粘性によるエネルギーを受けることによる滑り
外力が消失すると、弾性変形は元に戻るが滑脱した分は戻らない。このため、非定常流においては弾性変形の部分だけが顕在化して見える。定常流では、滑り量は増加し続けるが、時間変化しない定常的な外力は弾性変形に寄与しない。

外力が加わった時の血液の評価に必要な力学的パラメーターは以下の様に表される。
- 剪断応力:
- 剪断歪み:
- 剪断速度:
心臓の拍動をシミュレートするために正弦波形で変化する流れを仮定する。粘弾性体が時間変化する流れに晒され、その位相 φ は τ と γ の間で変動する。φ = 0 の時は応力と歪みの位相が同じであるため純粋な弾性体であり、φ = 90° の時は歪みの位相が応力に対し90°遅れているため、純粋な粘性体である。粘弾性体の位相は0°から90°の間のいずれかである。
正弦波で表される時間変化は eiωt に比例する。故に応力、歪み、剪断速度はそれぞれ、f を周波数、角周波数を ω = 2πf として、以下のように記述される。
- 剪断応力:
- 剪断歪み:
- 剪断速度:
ここで τ′ は粘性応力、τ′′ は弾性応力である。 複素粘性率 は複素剪断応力と複素剪断速度の比を取ることで得られる:[15]
同様に、 複素動的弾性率 G は複素剪断応力と複素剪断歪みの比を取ることで得られる。
複素貯蔵弾性率を G′, 複素損失弾性率を G′′ とすると、
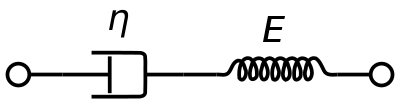
粘弾性体のMaxwellモデルは血液の粘弾性を表現するのによく用いられる。外力に対して応答の速いばねと応答の遅いダッシュポットを直列に接続したモデルである。このモデルを解析することによって複素粘性率をダッシュポット定数とばね定数で表すことが出来る。
Oldroyd-B モデル
[編集]血液の粘弾性の構成モデルとしてよく用いられるものの一つに Oldroyd-B モデルがある。低剪断速度における赤血球の凝集と分散による剪断減粘性を特徴付けるOldroyd-Bの非ニュートン流体モデルには様々なバリエーションがある。ここでは運動量方程式、全応力テンソルと組み合わせた3次元の Oldroyd-B モデルを考える[16]。血液の粘性 μ(h, d) が血管の半径 d とヘマトクリット h の関数で表される非ニュートン流体を仮定する。Oldroyd-B モデルでは剪断応力テンソル B と配向応力テンソル A の関係が以下の様に与えられる:
ここで D/Dt は物質微分、V は流体の速度、C1, C2, g, γ は定数である。S と B は次のように定義される:
赤血球の粘弾性
[編集]
赤血球は血流と血管の双方からの激しい機械的刺激に晒されており、その流動学的性質は微小循環環境の中で生物学的機能を行使するために重要である[17]。赤血球自身の粘弾性体としての力学的性質を調べるために様々な手法が取られてきた:
これらの手法は赤血球の変形能を剪断弾性率、曲げ弾性率、面積弾性率の観点から調べるものである[19]が、粘弾性を調査することは不可能であった。そこで他の手法として光音響測定が採用された。これは単一パルスレーザーを用いて組織の中で光音響信号を発生させて減衰時間を測定するものである。線形粘弾性理論によれば減衰時間は粘性/弾性比に等しいため、これにより粘弾性を調べることが出来る[20]。
その他、細胞表面に強磁性ビーズを結合させ、磁気ねじり血球計算法により赤血球の時間依存反応を調べることで粘弾性を評価する手法も用いられた[21]。
Ts(t) は単位ビーズの体積あたりの力学的トルクであり、以下の式で与えられる:
ここで H は与えられたねじれ磁場であり、θ は元の磁化方向に対するビーズの磁気モーメントの角度、そして c はビーズを粘度が既知の流体中に置きねじれ磁場をかけることにより求められる定数である。
複素動的弾性率 G を用いて応力歪み関係を表すと、
- 貯蔵弾性率:
- 損失弾性率:
σ0 と ε0 は応力と歪みの大きさを表し、φ は位相差である。

上記の関係から、トルクの時間変化をグラフ化することにより図3のようなループが得られる。図は d を変位として、横軸 Ts(t) と縦軸 d(t) のグラフを表す。ループにより囲まれる領域の面積 A は1サイクルあたりのエネルギー損失にあたる。
以上より、位相角 φ 、貯蔵弾性率、損失弾性率が以下のように求められる:
図3に現れているヒステリシスが赤血球の粘弾性を示している。これが細胞内のATP濃度により制御される細胞膜分子の代謝活性と関連しているかどうかは不明である。赤血球の粘弾性の特性の背後にある機序を理解するためにはこれらの相互作用を更に詳細に研究する必要がある。
血管の影響
[編集]生体内での血液の粘弾性を考察するには、動脈、毛細血管、静脈の影響も考慮に入れる必要がある。血液の粘性は大血管で血流に大きな影響を与えるが、一方赤血球の弾性変形能による弾性は細動脈や毛細血管における影響が強い[22]。動脈壁における脈波伝播を理解するためには、局所の血行力学と血管壁の剪断応力勾配が重要である。動脈壁の組織は異方性と不均質性を持っており、異なる生体力学的特性を持った多重構造から成っているため、動脈の血流に対する力学的影響を理解することを困難にする要因になっている。[23]。
構成式
[編集]血液の剪断応力と剪断速度の関係は実験的に測定され、構成式により表される。複雑な血液のマクロ流動学的な振る舞いを考えれば、種々の流動学的変数(ヘマトクリットや剪断速度など)の効果を記述するのに単一のモデルでは表現できない可能性も考えられる。実際に、実験的データのカーブフィッティングや特定の流動学的モデルに基づくものなど、様々なアプローチによる構成式が存在する。
- ニュートン流体モデル
- 全ての剪断速度で粘度が一定であるモデル。このモデルは高い剪断速度 () かつ血管径が血球より遥かに大きい場合において適用可能である[24]。
- ビンガム流体モデル
- 赤血球の低い剪断速度での凝集を考慮に入れたモデル。降伏応力の閾値付近では弾性体のように振る舞う。
- アインシュタインモデル
- μ0 は懸濁流体のニュートン粘度、k は粒子の形状に依存する定数、H は粒子の体積の割合。この構成式は粒子の占める体積割合が小さい懸濁流体に適用出来る。アインシュタインは球状粒子の場合は k = 2.5 であることを示した。
- Cassonモデル
- a と b は定数。剪断速度が非常に小さい時は b が剪断応力に寄与する。実際の血液での実験データでは、単一の定数 a, b の組み合わせでは剪断速度の全範囲でフィットしないが、剪断速度の範囲を分割して複数の定数の組み合わせを当てはめることにより良好な再現性が得られる。
- Quemadaモデル
- k0, k∞, γc は定数。この構成式は広範囲の剪断速度での血液データを当てはめたものである。
関連項目
[編集]脚注
[編集]- ^ Baskurt, OK; Hardeman M, Rampling MW, Meiselman HJ (2007). Handbook of Hemorheology and Hemodynamics. Amsterdam, Netherlands: IOS Press. p. 455. ISBN 1586037714. ISSN 0929-6743
- ^ a b Baskurt OK, Meiselman HJ (2003). “Blood rheology and hemodynamics”. Seminars in Thrombosis and Haemostasis 29: 435–450. doi:10.1055/s-2003-44551. PMID 14631543.
- ^ a b Késmárky G, Kenyeres P, Rábai M, Tóth K (2008). “Plasma viscosity: a forgotten variable”. Clin. Hemorheol. Microcirc. 39 (1-4): 243–6. PMID 18503132.[リンク切れ]
- ^ a b Tefferi A (May 2003). “A contemporary approach to the diagnosis and management of polycythemia vera”. Curr. Hematol. Rep. 2 (3): 237–41. PMID 12901345.
- ^ Lenz C, Rebel A, Waschke KF, Koehler RC, Frietsch T (2008). “Blood viscosity modulates tissue perfusion: sometimes and somewhere”. Transfus Altern Transfus Med 9 (4): 265–272. doi:10.1111/j.1778-428X.2007.00080.x. PMC 2519874. PMID 19122878.
- ^ Kwon O, Krishnamoorthy M, Cho YI, Sankovic JM, Banerjee RK (February 2008). “Effect of blood viscosity on oxygen transport in residual stenosed artery following angioplasty”. J Biomech Eng 130 (1): 011003. doi:10.1115/1.2838029. PMID 18298179.
- ^ Jeong, Seul-Ki, et al. (April 2010). “Cardiovascular risks of anemia correction with erythrocyte stimulating agents: should blood viscosity be monitored for risk assessment?”. Cardiovascular Drugs and Therapy 24 (2): 151–60. doi:10.1007/s10557-010-6239-7. PMID 20514513.
- ^ Viscosity. The Physics Hypertextbook. by Glenn Elert
- ^ Baskurt OK, Boynard M, Cokelet GC, et al (2009). “New Guidelines for Hemorheological Laboratory Techniques”. Clinical Hemorheology and Microcirculation 42 (2): 75–97. doi:10.3233/CH-2009-1202. PMID 19433882.
- ^ A. Burton (1965). Physiology and Biophysics of Circulation. Chicago (USA): Year Book Medical Publisher Inc.. p. 53
- ^ G. Thurston and Nancy M. Henderson (2006). “Effects of flow geometry on blood Viscoelasticity”. Biorheology 43: 729–746. PMID 17148856.
- ^ G. Thurston (1989). “Plasma Release – Cell Layering Theory for Blood Flow”. Biorheology 26: 199–214. PMID 2605328.
- ^ G. Thurston (1979). “Rheological Parameters for the Viscosity, Viscoelasticity, and thixotropy of Blood”. Biorheology 16 (3): 149–162. PMID 508925.
- ^ L. Pirkl and T. Bodnar, Numerical Simulation of Blood Flow Using Generalized Oldrroyd-B Model, European Conference on Computational Fluid Dynamics, 2010
- ^ T. How, Advances in Hemodynamics and Hemorheology, Vol. 1, JAI Press LTD., 1996, 1–32.
- ^ R. Bird, R. Armstrong, O. Hassager, Dynamics of Polymeric Liquids; Fluid Mechanic, 1987, 2, 493–496
- ^ M. Mofrad, H. Karcher, and R. Kamm, Cytoskeletal mechanics: models and measurements, 2006, 71-83
- ^ V. Lubarda and A. Marzani, Viscoelastic response of thin membranes with application to red blood cells, Acta Mechanica, 2009, 202, 1–16
- ^ D. Fedosov, B. Caswell, and G. Karniadakis, Coarse-Grained Red Blood Cell Model with Accurate Mechanical Properties, Rheology and Dynamics, 31st Annual International Conference of the IEEE EMBS, Minneapolis, Minnesota, 2009
- ^ J. Li, Z. Tang, Y. Xia, Y. Lou, and G. Li, Cell viscoelastic characterization using photoacoustic measurement, Journal of Applied Physics, 2008, 104
- ^ M. Marinkovic, K. Turner, J. Butler, J. Fredberg, and S. Suresh, Viscoelasticity of the Human Red Blood Cell, American Journal of Physiology - Cell Physiology 2007, 293, 597-605.
- ^ A. Ündar, W. Vaughn, and J. Calhoon, The effects of cardiopulmonary bypass and deep hypothermic circulatory arrest on blood viscoelasticity and cerebral blood flow in a neonatal piglet model, Perfusion 2000, 15, 121–128
- ^ S. Canic, J. Tambaca, G. Guidoboni, A. Mikelic, C Hartley, and D Rosenstrauch, Modeling Viscoelastic Behavior of Arterial Walls and their Interaction with Pulsatile Blood Flow, Journal of Applied Mathematics, 2006, 67, 164–193
- ^ Fung, Y.C. (1993). Biomechanics: mechanical properties of living tissues (2. ed. ed.). New York, NY: Springer. ISBN 9780387979472















![{\displaystyle S+\gamma \left[{\frac {DS}{Dt}}-\Delta V\cdot S-S\cdot {(\Delta V)}^{T}\right]=\mu (h,d)\left[B+\gamma \left({\frac {DB}{Dt}}-\Delta V\cdot B-B\cdot {(\Delta V)}^{T}\right)\right]-gA+C_{1}\left(gA-{\frac {C_{2}I}{\mu (h,d)^{2}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3831dced9bb1d3f7ab7e680931a46882db0817cd)













