塩化トリス(ビピリジン)ルテニウム(II)
| 塩化トリス(ビピリジン)ルテニウム(II) | |
|---|---|

| |

| |

| |
別称 Ru-bpy Ruthenium-tris(2,2’-bipyridyl) dichloride | |
| 識別情報 | |
| CAS登録番号 | 14323-06-9 (無水物) |
| RTECS番号 | VM2730000 |
| 特性 | |
| 化学式 | C30H24N6Cl2Ru·6H2O |
| モル質量 | 640.53 g/mol (無水物) 748.62 g/mol (六水和物) |
| 外観 | 赤色固体 |
| 融点 |
>300 ℃ |
| 水への溶解度 | 水に微溶; アセトンに可溶 |
| 構造 | |
| 分子の形 | 八面体 |
| 双極子モーメント | 0 D |
| 危険性 | |
| 主な危険性 | mildly toxic |
| Rフレーズ | none |
| Sフレーズ | S22 S24/25 |
| 関連する物質 | |
| 関連物質 | Ruthenium trichloride 2,2'-bipyridine |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化トリス(ビピリジン)ルテニウム(II)は、[Ru(bpy)3]2+で表される錯体の塩化物塩である。 六水和物が赤色の結晶として得られる。塩化物イオンは、PF6- 等の他の陰イオンで置換できるが,物質の性質は[Ru(bpy)3]2+に大きく依存している。
合成法および構造[編集]

塩化トリス(ビピリジン)ルテニウム(II)は、 三塩化ルテニウムの水溶液を2,2'-ビピリジンで処理することにより調製さできる。 この反応では、Ru(III)はRu(II)に還元する必要があり、次亜リン酸が還元剤として常用される。 [1]
[Ru(bpy)3]2+は八面体型で、3つのビピリジル配位子(bpy)と錯体中心に低スピンで電子配置がd6であるRu(II)イオンによって構成される。 D 3 対称性を有するキラルな錯体であり, 速度論的に安定なエナンチオマーへと分解する。 エネルギー的に最も低い三重項励起状態では、分子はより低いC 2対称性を示すと考えられている。これは、励起電子が主に一つのビピリジル配位子に局在するためである。 [2] [3]
[Ru(bpy)3 ] 2+の光化学的特性[編集]
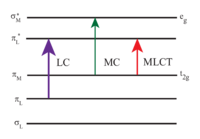
[Ru(bpy)3]2+は紫外線と可視光線を吸収する。[Ru(bpy)3]Cl2の水溶液は、452±3 nmに強いMLCT吸収(14,600 M -1cm -1の減衰係数)を示すため,オレンジ色を呈する。 285 nmでは、π *←π遷移と350 nm付近の弱い遷移(dd遷移)に相当する吸収バンドも存在する。[4] 本錯体の光吸収による励起状態は比較的長寿命で,アセトニトリル溶媒中にて 890 ナノ秒、水溶媒中にて650ナノ秒を示す。[5] 298Kの空気飽和水中での量子収率は2.8%で、発光の最大波長は620 nmである。 [6] 励起状態が長寿命化している原因は,基底状態は一重項状態であるが,励起状態では三重項状態をとるという禁制遷移であること及び、分子構造が電荷分離を可能とする構造であることが考えられる。
多くの分子の励起状態で見られるように、[Ru(bpy)3]2+の三重項励起状態は、基底状態よりも強い酸化特性と還元特性の両方を備えています。 この性質は、励起状態がbpy・-ラジカルアニオンを配位子としたRu3+錯体であるとすることによって説明がつく。 つまり、[Ru(bpy)3]2+の光化学的性質は、 電子と正孔の分離も伴う光反応デバイスと似ている。 [7]
[Ru(bpy)3]2+は、水の酸化と還元の両方における光増感剤としての利用が検討されている。 光子を吸収すると、[Ru(bpy)3]2+は、前述の三重項状態になる。この状態を[Ru(bpy)3]2+ *と表記する。 この化学種は、bpy配位子にある電子をペルオキソ二硫酸 (S2O82- )などの犠牲酸化剤に渡す。 その結果生じる[Ru(bpy)3]3+は強力な酸化剤であり、 助触媒を介してH2OをO2とH+に酸化する。[8] あるいは、[Ru(bpy)3]2+ *を還元剤として利用することで、リサイクル可能な電子キャリアであるメチルビオロゲンを還元し、 白金触媒にてH+を還元することもできる。 この過程を触媒サイクルとして機能させるには、 EDTA4-またはトリエタノールアミンなどの犠牲還元剤によってRu(III)をRu(II)に還元する必要がある。
[Ru(bpy)3]2+の誘導体は多数存在する。[9] [10] これらの錯塩は、生体診断、太陽光発電、および有機発光ダイオード等への利用が検討されているが、商品化には至っていない。 その中で、光学化学センサーへの応用が、最も成功した分野であると考えられる。 [11]
[Ru(bpy)3]2+と光酸化還元触媒[編集]
[Ru(bpy)3]2+触媒と可視光を用いた光酸化還元触媒は、有機合成における手段の1つになっている。 [12] 2008年以降、結合形成反応への利用が盛んになっている。 [13] [14] [15] [16]
安全性[編集]
金属ビピリジン錯体および関連するフェナントロリン錯体は、 インターカレーション剤として作用しうるため、一般に生理活性を示す。
引用[編集]
- ^ Broomhead J. A.; Young C. G. (1990). Tris(2,2'-bipyridine)Ruthenium(II) Dichloride Hexahydrate. 28. 338–340. doi:10.1002/9780470132593.ch86. ISBN 9780470132593
- ^ Yeh, Alvin T.; Charles V. Shank; James K. McCusker (2000). “Ultrafast Electron Localization Dynamics Following Photo-Induced Charge Transfer”. Science 289 (5481): 935–938. doi:10.1126/science.289.5481.935. PMID 10937993.
- ^ Thompson, David W.; Ito, Akitaka; Meyer, Thomas J. (30 June 2013). “[Ru(bpy)3]2+* and other remarkable metal-to-ligand charge transfer (MLCT) excited states”. Pure and Applied Chemistry 85 (7): 1257–1305. doi:10.1351/PAC-CON-13-03-04.
- ^ Kalyanasundaram, K. (1982). “Photophysics, photochemistry and solar energy conversion with tris(bipyridyl)ruthenium(II) and its analogues”. Coordination Chemistry Reviews 46: 159–244. doi:10.1016/0010-8545(82)85003-0.
- ^ Montalti, Marco; Alberto Cedi; Luca Prodi; M. Teresa Gandolfi (2006). Handbook of Photochemistry (3rd ed.). 6000 Broken Sound Prkway NW, Suite 200 Boca Raton, FL: CRC press Taylor & Francis Group. pp. 379–404. ISBN 978-0-8247-2377-4
- ^ Nakamaru, Katsumi (1982). “Synthesis, luminescence quantum yields, and lifetimes of trischelated ruthenium(II) mixed-ligand complexes including 3,3'-dimethy1-2,2'-bipyridyl”. Bulletin of the Chemical Society of Japan 55 (9): 2697. doi:10.1246/bcsj.55.2697.
- ^ A. J. Bard; M. A. Fox (1995). “Artificial Photosynthesis: Solar Splitting of Water to Hydrogen and Oxygen”. Acc. Chem. Res. 28 (3): 141–145. doi:10.1021/ar00051a007.
- ^ M. Hara; C. C. Waraksa; J. T. Lean; B. A. Lewis; T. E. Mallouk (2000). “Photocatalytic Water Oxidation in a Buffered Tris(2,2'-bipyridyl)ruthenium Complex-Colloidal IrO2 System”. J. Phys. Chem. A 104 (22): 5275–5280. doi:10.1021/jp000321x.
- ^ A. Juris; V. Balzani; F. Barigelletti; S. Campagna; P. Belser; A. von Zelewsky (1988). “Ru(II) polypyridine complexes - photophysics, photochemistry, electrochemistry, and chemiluminescence”. Coord. Chem. Rev. 84: 85–277. doi:10.1016/0010-8545(88)80032-8.
- ^ S. Campagna; F. Puntoriero; F. Nastasi; G. Bergamini & V. Balzani (2007). Photochemistry and photophysics of coordination compounds: ruthenium. Topics in Current Chemistry. 280. 117–214. doi:10.1007/128_2007_133. ISBN 978-3-540-73346-1
- ^ G. Orellana & D. Garcia-Fresnadillo (2004). Environmental and Industrial Optosensing with Tailored Luminescent Ru(II) Polypyridyl Complexes. 1. 309–357. doi:10.1007/978-3-662-09111-1_13. ISBN 978-3-642-07421-9
- ^ F. Teply (2011). “Photoredox catalysis by [Ru(bpy)3]2+ to trigger transformations of organic molecules. Organic synthesis using visible-light photocatalysis and its 20th century roots”. ChemPlusChem 76 (7): 859–917. doi:10.1135/cccc2011078.
- ^ D. A. Nicewicz; D. W. C. MacMillan (2008). “Merging photoredox catalysis with organocatalysis: The direct asymmetric alkylation of aldehydes”. Science 322 (5898): 77–80. doi:10.1126/science.1161976. PMC 2723798. PMID 18772399.
- ^ J. M. R. Narayanam; C. R. J. Stephenson (2011). “Visible light photoredox catalysis: applications in organic synthesis”. Chem. Soc. Rev. 40 (1): 102–113. doi:10.1039/b913880n. PMID 20532341.
- ^ T. P. Yoon; M. A. Ischay; J. Du (2010). “Visible light photocatalysis as a greener approach to photochemical synthesis”. Nat. Chem. 2 (7): 527–532. doi:10.1038/nchem.687. PMID 20571569.
- ^ Romero, Nathan A.; Nicewicz, David A. (10 June 2016). “Organic Photoredox Catalysis”. Chemical Reviews 116 (17): 10075–10166. doi:10.1021/acs.chemrev.6b00057. PMID 27285582.
