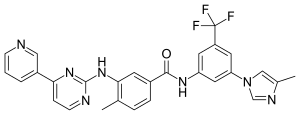
ニロチニブ
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Tasigna |
| Drugs.com | monograph |
| MedlinePlus | a608002 |
| ライセンス | EMA:リンク、US FDA:リンク |
| 胎児危険度分類 | |
| 法的規制 | |
| 投与経路 | Oral |
| 薬物動態データ | |
| 生物学的利用能 | 30%[1] |
| 血漿タンパク結合 | 98%[1] |
| 代謝 | Hepatic (mostly CYP3A4-mediated)[1] |
| 半減期 | 15-17 hours[1] |
| 排泄 | Faeces (93%)[1] |
| 識別 | |
| CAS番号 |
641571-10-0(base) |
| ATCコード | L01XE08 (WHO) |
| PubChem | CID: 644241 |
| DrugBank |
DB04868 |
| ChemSpider |
559260 |
| UNII |
F41401512X |
| KEGG |
D08953 |
| ChEBI |
CHEBI:52172 |
| ChEMBL |
CHEMBL255863 |
| PDB ligand ID | NIL (PDBe, RCSB PDB) |
| 化学的データ | |
| 化学式 | C28H22F3N7O |
| 分子量 | 529.5245 g/mol |
| |
ニロチニブ (Nilotinib)は、分子標的治療薬のチロシンキナーゼ阻害薬の一つであり、塩酸塩一水和物がイマチニブ耐性の慢性骨髄性白血病の治療に用いられる[2]。商品名タシグナ。開発コードAMN107。
効能・効果[編集]

ニロチニブが承認されたのは、米国FDAで2007年10月29日[3]、欧州EMAで2009年9月29日[4]、英国MHRAで2007年11月19日[5]、豪州TGAで2008年1月17日[6]、日本厚生労働省で2009年1月21日[7]であった。
欧米での効能・効果はフィラデルフィア染色体陽性(Ph+)の慢性骨髄性白血病である[1]。日本での効能・効果は「慢性期または移行期の慢性骨髄性白血病」[8]である。
2006年6月、第I相臨床試験が実施され、ニロチニブの忍容性と、標準治療薬であるイマチニブ耐性慢性骨髄性白血病への有効性が確認された[9]。当該試験では5ヶ月のニロチニブ投与により、イマチニブ抵抗性を示す患者の92%で白血球数が正常化した[10]。
その他の効能・効果[編集]
ニロチニブは低用量でパーキンソン病、アルツハイマー型認知症、筋萎縮性側索硬化症、認知症、ハンチントン病に奏効する[11](2018年1月の時点で米国で第II相の二重盲検テストによる治験が進行中)。
消化管間質腫瘍(GIST)の第一選択薬としての第III相臨床試験は独立モニタリング委員会の勧告により2011年4月11日に中止された。中間解析でイマチニブ(標準治療薬)に対する優越性が確認できなかったからである[12]。
禁忌・警告[編集]
QT延長症候群、低カリウム血症、低マグネシウム血症、妊婦、妊娠希望者、授乳婦、ガラクトース・乳糖不耐症の患者に対して禁忌を設定している国がある[1][6]が、日本で禁忌に設定されているのは「過敏症の既往歴のある患者」と「妊婦または妊娠している可能性のある婦人」のみである[8]。
日本で警告欄に表記されている項目は心血管障害(QT間隔延長と心タンポナーデ)と一般的な事項(緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。等)であるが、海外では下記の項目が警告欄に設定されている場合もある[1]。
- 骨髄抑制
- 腫瘍崩壊症候群
- 肝障害
- 肝炎の既往
- 膵炎の確認のため血中リパーゼ測定を定期的に実施する事
- 胃全摘除患者
- 妊娠していないことを確認する事
肝機能が低下している患者に投与する場合には、用量を減量し、肝機能をモニタリングする必要がある[13]。日本の添付文書では肝機能の他に血液系、膵機能、QT間隔延長について減量基準が記載されている[8]。
副作用[編集]
ニロチニブは心毒性を持つことが米国の添付文書で黒枠警告されている[14][15]ほか、日本でも警告欄に「QT間隔延長」と「心タンポナーデによる死亡」が記載されている[8]。他にもニロチニブは抗がん剤によく見られる多くの副作用を持つ。頭痛、倦怠感、悪心・嘔吐・下痢・便秘などの消化器症状、筋肉痛、関節痛、潮紅などの皮膚症状、インフルエンザ様症状、血球数減少である。他に特徴的な副作用として、高血圧、様々な不整脈、QT延長などの心血管症状を呈する。その他にも、電解質やグルコース代謝に影響する[3]。肺に対する副作用はイマチニブやダサチニブよりも発現頻度が低いが、肺胞出血を発現した事例が報告されている[16]。
重大な副作用として記載されているものは、
- 汎血球減少(0.5%)、好中球減少(14.7%)、白血球減少(9.3%)、血小板減少(21.4%)、貧血(11.9%)、
- QT間隔延長(2.5%)、心筋梗塞(1.2%)、狭心症(1.4%)、心不全(0.3%)、心膜炎(0.2%)、末梢動脈閉塞性疾患(1.0%)、脳梗塞、一過性脳虚血発作(0.3%)、
- 高血糖(7.5%)、頭蓋内出血、消化管出血(0.2%)、後腹膜出血、
- 肝炎(0.2%)、肝機能障害(5.1%)、黄疸(0.7%)、膵炎(2.2%)、
- 肺炎(0.5%)、敗血症(0.2%)、胸水(0.5%)、肺水腫、心嚢液貯留(0.3%)、鬱血性心不全、心タンポナーデ(0.2%)、
- 間質性肺疾患(0.2%)、脳浮腫、消化管穿孔、腫瘍崩壊症候群
である[8]。
相互作用[編集]
ニロチニブは肝トランスポーターOATP1B1およびOATP1B3の基質である。ニロチニブがOATP1B1およびOATP1B3に結合する事で肝排泄が妨げられ、トランスポーターを介した薬剤間相互作用が発生する[13]。ニロチニブはOATP1B1阻害作用を持つがOATP1B3阻害作用はない[17]。ニロチニブはCYP3A4で代謝されるので、グレープフルーツ等のCYP3A4阻害薬ならびにCYP3A4誘導薬はニロチニブと相互作用する[1]。柘榴やスターフルーツとも相互作用するとの報告がある。
作用機序[編集]
ニロチニブはフィラデルフィア染色体由来のBCR-ABLキナーゼ[18]のほか、KIT、Lck、EPHA3、EPHA8、DDR1、DDR2(英語版)、PDGFRB、MAPK11、ZAKを阻害する[19]。
出典[編集]
- ^ a b c d e f g h i “Tasigna (nilotinib) dosing, indications, interactions, adverse effects, and more”. Medscape Reference. WebMD. 2014年1月25日閲覧。
- ^ “Cancer Drug Information: Nilotinib”. 2014年12月30日閲覧。
- ^ a b “Complete Nilotinib information from Drugs.com”. Drugs.com. 2014年1月25日閲覧。
- ^ “Tasigna : EPAR - Product Information” (PDF). European Medicines Agency. Novartis Europharm Ltd. (2013年10月18日). 2014年1月25日閲覧。
- ^ “Tasigna 150mg Hard Capsules - Summary of Product Characteristics (SPC)”. electronic Medicines Compendium. Novartis Pharmaceuticals UK Ltd (2013年9月9日). 2014年1月25日閲覧。
- ^ a b “TASIGNA nilotinib” (PDF). TGA eBusiness Services. 21 October 2013. 2014年1月25日閲覧。
- ^ “抗悪性腫瘍剤「タシグナカプセル200 mg」の製造販売承認を取得” (2009年1月21日). 2014年12月30日閲覧。
- ^ a b c d e “タシグナカプセル150mg/タシグナカプセル200mg 添付文書” (2016年8月). 2016年11月5日閲覧。
- ^ Kantarjian H et al.; Giles, Francis; Wunderle, Lydia; Bhalla, Kapil; O'Brien, Susan; Wassmann, Barbara; Tanaka, Chiaki; Manley, Paul et al. (2006). “Nilotinib in imatinib-resistant CML and Philadelphia chromosome-positive ALL”. N Engl J Med 354 (24): 2542–51. doi:10.1056/NEJMoa055104. PMID 16775235.
- ^ “Patients with treatment-resistant leukemia achieve high responses to Tasigna (nilotinib) in first published clinical trial results”. MediaReleases (Novartis). (2006年6月14日) 2009年8月4日閲覧。
- ^ http://medicalxpress.com/news/2013-05-cancer-drug-build-up-toxic-brain.html
- ^ http://www.novartis.com/newsroom/media-releases/en/2011/1504991.shtml
- ^ a b Khurana V, Minocha M, Pal D, Mitra AK (March 2014). “Role of OATP-1B1 and/or OATP-1B3 in hepatic disposition of tyrosine kinase inhibitors.”. Drug Metabol Drug Interact. 0 (0): 1–11. doi:10.1515/dmdi-2013-0062. PMID 24643910.
- ^ “FDA Approves Tasigna for Treatment of Philadelphia Chromosome Positive Chronic Myeloid Leukemia”. U.S. Food and Drug Administration. (2007年10月30日) 2009年8月4日閲覧。
- ^ “Prescribing information for Tasigna (nilotinib) Capsules” (PDF). NDA 022068. U.S. FDA (2007年10月29日). 2009年8月4日閲覧。
- ^ Donatelli, Christopher, Daych Chongnarungsin, and Rendell Ashton. "Acute respiratory failure from nilotinib-associated diffuse alveolar hemorrhage." Leukemia & Lymphoma 0 (2014): 1-6.
- ^ Khurana V, Minocha M, Pal D, Mitra AK (May 2014). “Inhibition of OATP-1B1 and OATP-1B3 by tyrosine kinase inhibitors.”. Drug Metabol Drug Interact. 0 (0): 1–11. doi:10.1515/dmdi-2014-0014. PMID 24807167.
- ^ Weisberg E, Manley P, Mestan J, Cowan-Jacob S, Ray A, Griffin JD (June 2006). “AMN107 (nilotinib): a novel and selective inhibitor of BCR-ABL”. Br. J. Cancer 94 (12): 1765–9. doi:10.1038/sj.bjc.6603170. PMC 2361347. PMID 16721371.
- ^ Manley, PW; Drueckes, P; Fendrich, G; Furet, P; Liebetanz, J; Martiny-Baron, G; Mestan, J; Trappe, J et al. (2010). “Extended kinase profile and properties of the protein kinase inhibitor nilotinib”. Biochimica et Biophysica Acta 1804 (3): 445–53. doi:10.1016/j.bbapap.2009.11.008. PMID 19922818.
外部リンク[編集]
- 医薬製品「タシグナ」(nilotinib)の日本語情報サイト
- 「ニロチニブ塩酸塩水和物」(独立行政法人 医薬品医療機器総合機構)
- 米国内の医薬製品TASIGNA(nilotinib)の情報サイト(英語)
- ニロチニブ承認情報 Scientific Narrative
- Highlights of Prescription information Nilotinib (August 2007) Novartis Pharmaceuticals Corporation (USA)
- Summary of Product Characteristics Nilotinib (November 2007) Novartis AG (Europe)
- Georgetown Announces Phase II Clinical Trial of Nilotinib for Parkinson’s Disease(Feb 27, 2017)
- Georgetown University の Nilotinibの医療研究発表リスト
