アフラトキシンB1
| アフラトキシンB1 | |
|---|---|
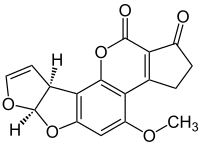 (–)-アフラトキシンB1の化学構造
| |
 アフラトキシンB1の3次元構造
| |
(6aR,9aS)-2,3,6a,9a-Tetrahydro-4-methoxy-1H,11H-cyclopenta[c]furo[3',2':4,5]furo[2,3-h][1]benzopyran-1,11-dione | |
別称 NSC 529592 | |
| 識別情報 | |
| CAS登録番号 | 1162-65-8 |
| PubChem | 14403 |
| ChemSpider | 13758 |
| ChEMBL | CHEMBL1697694 |
| |
| |
| 特性 | |
| 化学式 | C17H12O6 |
| モル質量 | 312.27 g mol−1 |
| 危険性 | |
| 主な危険性 | 猛毒 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アフラトキシンB1(aflatoxin B1)は、アスペルギルス・フラバスやアスペルギルス・パラシチクスなどの真菌類によって産生される毒素アフラトキシンの一種であり、アフラトキシンの中で最も毒性の高い物質である。非常に強力な発がん性があり、実験動物の半数に発がんが認められるTD50は、ラットにおいて0.0032 mg/kg/dayである[1]。ただしその発がん性の強さは動物種によって違いがあり、ラットやサルなどは他の種よりも感受性がかなり高いとされている[2]。ヒトの肝細胞癌の発生に関与し[3]、動物においては変異原性[4]、催奇性 [5]、免疫毒性[6]などが認められる。アフラトキシンB1はラッカセイ、トウモロコシ、綿実粕などのさまざまな食品、穀物、動物飼料などの汚染物質になり得[7][8]、その汚染の検出や分析には薄層クロマトグラフィー(TLC)、高速液体クロマトグラフィー(HPLC)、質量分析(MS)、ELISAなどが用いられる[9]。アフラトキシンB1の許容レベルは国連食糧農業機関(FAO)によって定められており、その濃度は2003年において、食品中で1–20 µg/kg、食用牛飼料中で5–50 µg/kgである[10]。
暴露源[編集]
アフラトキシンB1の暴露源は、ヒトにおいては汚染された食品が主である[11]。アフラトキシンB1の産生は高温で多湿な環境で促進されるため、東南アジア、南米、サハラ以南のアフリカなどで保存された食品が汚染されやすい[12]。なお、職業的な曝露は養豚業[13]および養鶏業[14]において報告されている。
病理[編集]
アフラトキシンB1は、ヒトにおいては経口からの摂取が主であるが、皮膚も透過し得る。そしてそれが重大な健康上のリスクにつながる可能性がある[15]。アフラトキシンB1の毒性に対して最も感受性が高い臓器は肝臓であり、動物実験における病変には、肝臓重量の低下[16]、肝細胞の空胞化[17]、肝細胞癌 [18]などがある。また肝細胞の肥大、脂肪肝、壊死、出血、肝線維症、結節の再生、胆管の増殖や過形成なども認められる[19]。
Aspergillus flavus[編集]
Aspergillus flavusは世界中に分布するマユハキタケ科(Trichocomaceae)の真菌である。このカビは土壌中に生育し、死んだ植物や動物性物質で生活するが、浮遊分生子によって空気を通じて広がる[20]。この真菌は長い分岐した菌糸に成長し、トウモロコシやラッカセイを含む膨大な数の食料源上で生存できる[21]。菌とその生産物はヒトを含む数多くの種に対して病原性を持つ[20]。その生産物アフラトキシン類の毒性は本項の初めから終わりまで言及されているが、Aspergillus flavus自身もアスペルギルス症によって病原性を発揮する。この感染は免疫力が低下した患者の肺で主に起こるが、皮膚やその他の器官においても感染は起こりうる[22]。多くのカビと異なり、Aspergillus flavusは熱い、乾燥した条件を好む。37 °C (99 °F)で最適成長を示すことがヒトでの病原性に寄与している[20]。
生合成経路[編集]
アフラトキシンB1は特化した脂肪酸合成酵素(FAS)とポリケチド合成酵素(PKS)に由来する。これらは共にノルソロリン酸合成酵素として知られる。生合成はFASによるヘキサン酸の合成に始まり、これは次に反復型I型PKCのためのスターターユニットとなる[23][24][25]。PKSは7つのマロニルCoA伸長ユニットをヘキサン酸へ付加し、C20ポリケチド化合物を作る。PKCはこのポリケチドをある特定の方法で環化し、アントラキノンのノルソルリン酸を形成する。レダクターゼが次にノルソルリン酸側鎖上のケトンの還元を触媒し、アベランチン(averantin)を得る[23][24][25]。アベランチンは2つの異なる酵素、ヒドロキシラーゼとアルコールデヒドロゲナーゼによってアベルフィン(averufin)へと変換される。これは、アベランチンの側鎖の酸化と環化を触媒し、アベルフィンのケタールを形成する。
この時点以降、アフラトキシンB1の生合成経路はかなり複雑になり、いくつかの大きな骨格変化が起きる。ほとんどの生合成酵素は特徴付けされておらず、いくつかの未知の中間体が存在する可能性がある[23]。しかしながら、分かっているのはアベルフィンがP450酵素、AvfAによって(バイヤー・ビリガー酸化の形式で)酸化されることである。これによりエーテル環が開き、転位により酢酸ベルシコナール(versiconal acetat)が形成される。次に、エステラーゼEstAがこの酢酸エステルの加水分解を触媒し、ベルシコナールに1級アルコールが形成される[23][25]。ベルシコロリンA(versicolorin A)中のアセタールはベルシコナール側鎖の環化から形成され、これはまずVERBシンターゼによって触媒され、次にVerB(デサチュラーゼ)がベルシコロリンBを還元してジヒドロビスフランが形成される[23][25]。
ベルシコロリンAのデメチルステリグマトシスチンへの変換を触媒する酵素は2つ以上存在する。オキシダーゼのAflNとレダクターゼのAflMである。これらの酵素は分子状酸素と2つのNADPHを使ってアントラキノン骨格の水酸基の1つを脱水し、分子状酸素を使ってキニン骨格を開く[23][25]。開環段階においてアルデヒドが形成されると、酸化されカルボン酸となり、続いて脱炭酸が起こり閉環してデメチルステリグマトシスチンで見られる6員環エーテル環系が形成される。次の2段階は2つの異なるメチル基転移酵素、OmtBおよびOmtAによるデメチルステリグマトシスチンのキサントン部位上の2つのヒドロキシ基のS-アデノシルメチオニン(SAM)によるメチル化である[23][25]。これによってO-メチルステリグマトシスチンが得られる。最終段階において、O-メチルステリグマトシスチン中の芳香環の酸化開裂と1炭素の欠失が起こる。これは酸化還元酵素OrdAによって触媒される[23][25]。次に、最後の再環化が起こりアフラトキシンB1が形成される。
発がん性の機構[編集]
アフラトキシンB1は強力な遺伝毒性肝がん誘発物質であり、その曝露は、特にB型肝炎ウイルスの同時感染した時に肝細胞癌腫、肝腫瘍の発生と強く関係している[18]。これらの作用はがん抑制遺伝子p53の249番目のコドンのグアニン残基の変異[26]ならびにがん原遺伝子rasの12および13番目のコドンの複数のグアニン残基の変異を主に介しているように見える[27][28]。アフラトキシンB1はまずシトクロムP450によって反応性の高い求電子分子種であるアフラトキシンB1-8,9-exo-エポキシドへと代謝されるはずである[18]。この活性体は次にDNA塩基残基間にインターカレートし、グアニン残基との付加体、主にアフラトキシンB1-N7-Gua、を形成する。これらの付加体は次にDNA主鎖から取り除かれ、脱プリン部位が形成される。これらの付加体と変化はDNAに傷を付け、DNA複製に際して反対鎖に不適合塩基の挿入が引き起こされる。高いアフラトキシン曝露を受けた地域の最大44%の肝細胞癌腫が、この毒素で見られる特徴的な変異であるp53の249番目のコドンでのGC → TA塩基転換を有していた[28]。
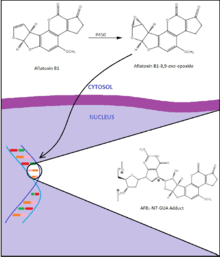
アフラトキシンの曝露された個人の肝細胞癌腫の有病率はB型肝炎ウイルスの同時感染により増加する。ある研究は、尿中のアフラトキシンバイオマーカーを持つ個人は正常な集団よりも肝細胞癌腫に罹患するリスクが3倍大きいと見積っている。B型肝炎ウイルスに感染している者は4倍のリスク、バイオマーカーとウイルスの両方を持っている者は60倍のリスクを見積られた[29][28]。
毒性[編集]
複数のアフラトキシンB1の毒性研究が様々な動物種について行われている[30]。
- 急性毒性
- アフラトキシンB1の経口投与でのLD50範囲はほとんどの動物種について0.3-17.9 mg/kg体重と見積られている[31]。例えば、アフラトキシンB1の経口投与でのLD50は雌のラットで17.9 mg/kg体重、雄のラットで7.2 mg/kg体重と見積られている。雄のラットでは、アフラトキシンB1の腹腔内投与でのLD50は6.0 mg/kg体重と見積られている[32]。症状は食欲不振、不快感、微熱などである[33]。
- 亜急性毒性
- 動物でのアフラトキシンB1の亜急性毒性は中程度から深刻な肝臓損傷を示した。例えばサルでは、亜急性毒性研究は門脈炎症と脂肪変化を示した[34]。
- 慢性毒性
- ニワトリにおけるアフラトキシンB1の慢性毒性研究は肝ミクロソーム局在性シトクロムP450濃度の減少、餌消費量の低下、体重増加量の低下を示した[35]。
- 亜慢性毒性
- 魚類におけるアフラトキシンB1の亜慢性毒性研究は、前がん病変やそれと当時に鰓、膵臓、腸、脾臓における変化を示した[36]。
- 遺伝毒性
- 3-5 µmol/Lの用量のアフラトキシンB1によるヒト肝細胞処理はアフラトキシンB1-DNA付加物の形成、8-ヒドロキシグアニン損傷、DNA損傷が得られた[37]。
- 発がん性
- アフラトキシンB1の発がん性(肝細胞癌腫の発生)はラット研究で報告されている[38]。
- 胚性毒性
- アフラトキシンB1によるニワトリのファブリキウス嚢の胚死亡および胚発生障害が報告されている[39]。
- 催奇形性
- ウサギにおけるアフラトキシンB1の催奇形作用には、胎児重量の低下、下垂手、拡大した眼窩、尾椎の形成不全、小眼球症、心血管異常、レンズ核変性などが報告されている[40]。
- 免疫毒性
- 魚類における研究は、アフラトキシンB1が血清総グロブリンの減少、殺菌活性の減少を含む顕著な免疫抑制作用を持つことが示された[41]。
リスク管理および規制[編集]
アフラトキシンB1曝露は、田畑や収穫後の取り扱い、貯蔵における作物の汚染防止を目指した指標や、畜産現場において使われる汚染された作物または材料の検出および除染を目指した指標によって最も良く管理される。例えば、単一の微生物種Flavobacterium aurantiacumが使われる生物学的除染がラッカセイおよびトウモロコシからアフラトキシンB1を除去するために使われている[42]。
- アメリカ合衆国
- 米国の食品安全規制は全ての食品においてアフラトキシンB1に対してとその他のアフラトキシン類(B2、G1、G2)と組み合わせて20 μg/kgの最大許容水準を設定している。例外は牛乳で、0.5 μg/kgの最大許容水準が設定されている。一部の動物飼料ではより高い100–300 μg/kgが許容される[43][44]。
- 欧州連合(EU)
- EUはナッツ、乾燥フルーツ、シリアル、香辛料におけるアフラトキシンB1の最大許容水準を2-12 μg/kgの範囲に定めているが、乳児用食品におけるアフラトキシンB1の最大許容水準は0.1 μg/kgに設定されている[42]。EUによる動物飼料中のアフラトキシンB1の最大許容レベルは5-50 μg/kgであり、これらの水準はアメリカ合衆国の値よりもかなり低い[45]。
- FAO/WHO合同食品添加物専門家会議(JECFA)
- FAO/WHO下のJECFAはアフラトキシンB1に対してとその他のアフラトキシン類(B2、G1、G2)と組み合わせて、生のラッカセイでは15 μg/kg、加工ラッカセイでは10 μg/kgの最大許容水準を定めている。それに対してアフラトキシンB1だけでの許容水準は乳牛飼料では5 μg/kgである[46][47]。
注目に値する曝露[編集]
アフラトキシンB1の発見は1960年の夏にイングランドで起きた広範囲のシチメンチョウの死の後のことであった。この未知の病気は当時「Disease X」と命名された。500回の大流行の間、この病気は健康と見られる10万頭を超えるシチメンチョウに及んだと主張されている。広範囲の死は後にラッカセイ粕のAspergillus flavus汚染が原因であることが明らかにされた[48][49]。
1981年のケニアのMachakos地区の複数の病院で汚染されたトウモロコシを摂取した後に20人の患者が急性アフラトキシン中毒で死亡した。全ての患者は肝炎も患っていた[50]。
2004年の春に起きた4,400 bbpに達するトウモロコシのアフラトキシン汚染の発生の後、ケニアの125人が急性肝不全で死亡し、総計で317件が報告された。今日まで、記録された死亡者という点ではこれが最大のアフラトキシン中毒の発生であった[33]。
出典[編集]
- ^ “Summary Table by Chemical of Carcinogenicity Results in CPDB on 1547 Chemicals”. Toxnet. 2018年1月18日閲覧。
- ^ McLean, M (February 1995). “Cellular interactions and metabolism of aflatoxin: an update”. Pharmacology & Therapeutics 65 (2): 163–192. doi:10.1016/0163-7258(94)00054-7. PMID 7540767.
- ^ Kucukcakan, B; Hayrulai-Musliu, Z (15 June 2015). “Challenging Role of Dietary Aflatoxin B1 Exposure and Hepatitis B Infection on Risk of Hepatocellular Carcinoma.”. Open Access Macedonian Journal of Medical Sciences 3 (2): 363–9. doi:10.3889/oamjms.2015.032. PMC 4877883. PMID 27275251.
- ^ Chen, Tao; Heflich, Robert H; Moore, Martha M; Mei, Nan (2009). “Differential mutagenicity of aflatoxin B1in the liver of neonatal and adult mice”. Environmental and Molecular Mutagenesis: NA. doi:10.1002/em.20518.
- ^ Geissler, Francis; Faustman, Elaine M (1988). “Developmental toxicity of aflatoxin B1 in the rodent embryo in vitro: Contribution of exogenous biotransformation systems to toxicity”. Teratology 37 (2): 101. doi:10.1002/tera.1420370203. PMID 3127910.
- ^ Meissonnier GM, Pinton P, Laffitte J, Cossalter AM, Gong YY, Wild CP, Bertin G, Galtier P, Oswald IP (2008). “Immunotoxicity of aflatoxin B1: Impairment of the cell-mediated response to vaccine antigen and modulation of cytokine expression”. Toxicology and Applied Pharmacology 231 (2): 142–9. doi:10.1016/j.taap.2008.04.004. PMID 18501398.
- ^ Galvano F., Ritieni A., Piva G., Pietri A. Mycotoxins in the human food chain. In: Diaz D.E., editor. The Mycotoxin Blue Book. Nottingham University Press; Nottingham, UK: 2005. pp. 187–224.
- ^ Azab Rania M., Tawakkol Wael M., Abdel-Rahman M. Hamad, Abou-Elmagd Mohamed K., El-Agrab Hassan M., Refai Mohamed K. (2005). “Detection and estimation of aflatoxin B1 in feeds and its biodegradation by bacteria and fungi”. Egyptian Journal of Natural Toxins 2: 39–56.
- ^ Wacoo, Alex P.; Wendiro, Deborah; Vuzi, Peter C.; Hawumba, Joseph F. (2014). “Methods for Detection of Aflatoxins in Agricultural Food Crops”. J. Appl. Chem. 2014: 1–15. doi:10.1155/2014/706291.
- ^ “Worldwide regulations for mycotoxins in food and feed in 2003. 3. Mycotoxin regulations in 2003 and current developments”. FAO. 2018年1月18日閲覧。
- ^ Coulombe, Roger A. (1993). “Biological Action of Mycotoxins”. J. Dairy Sci. 76 (3): 880–891. doi:10.3168/jds.S0022-0302(93)77414-7. PMID 8463495.
- ^ Kew, MC (2013). “Aflatoxins as a cause of hepatocellular carcinoma”. J. Gastrointestin. Liver Dis. 22 (3): 305–310. PMID 24078988.
- ^ Viegas, Susana; Veiga, Luísa; Figueredo, Paula; Almeida, Ana; Carolino, Elisabete; Sabino, Raquel; Veríssimo, Cristina; Viegas, Carla (2013). “Occupational Exposure to Aflatoxin B1 in Swine Production and Possible Contamination Sources”. J. Toxicol. Environ. Health A 76 (15): 944. doi:10.1080/15287394.2013.826569.
- ^ Viegas, Susana; Veiga, Luisa; Malta-Vacas, Joana; Sabino, Raquel; Figueredo, Paula; Almeida, Ana; Viegas, Carla; Carolino, Elisabete (2012). “Occupational Exposure to Aflatoxin (AFB1) in Poultry Production”. J. Toxicol. Environ. Health A 75 (22–23): 1330. doi:10.1080/15287394.2012.721164.
- ^ Boonen, Jente; Malysheva, Svetlana V.; Taevernier, Lien; Diana Di Mavungu, José; De Saeger, Sarah; De Spiegeleer, Bart (2012). “Human skin penetration of selected model mycotoxins”. Toxicology 301 (1–3): 21–32. doi:10.1016/j.tox.2012.06.012. PMID 22749975.
- ^ Fernández, Antonio; Ramos, Juan José; Sanz, María del Carmen; Saez, Teófilo; Luco, Daniel Fernández de (1996). “Alterations in the Performance, Haematology and Clinical Biochemistry of Growing Lambs Fed with Aflatoxin in the Diet”. J. Appl. Toxicol. 16 (1): 85–91. doi:10.1002/(SICI)1099-1263(199601)16:1<85::AID-JAT315>3.0.CO;2-T. PMID 8821681.
- ^ Espada, Y.; Domingo, M.; Gomez, J.; Calvo, M.A. (1992). “Pathological lesions following an experimental intoxication with aflatoxin B1 in broiler chickens”. Res. Vet. Sci. 53 (3): 275–279. doi:10.1016/0034-5288(92)90127-N. PMID 1465501.
- ^ a b c Larsson P, Busk L, Tjälve H (1994). “Hepatic and extrahepatic bioactivation and GSH conjugation of aflatoxin B1 in sheep”. Carcinogenesis 15 (5): 947–55. doi:10.1093/carcin/15.5.947. PMID 8200100.
- ^ Patterson D.S.P. (1977). “Aflatoxin and related compounds: Introduction”. In Wyllie T.D., Morehouse L.G.. Mycotoxic Fungi, Mycotoxins, Mycotoxicoses, an Encyclopaedic Handbook. 1st. Vol. 1.. New York, NY, USA: Marcel Dekker Inc.. pp. 131–135. ISBN 978-0824765507
- ^ a b c Hedayati, M. T.; Pasqualotto, A. C.; Warn, P. A.; Bowyer, P.; Denning, D. W. (2007-01-01). “Aspergillus flavus: human pathogen, allergen and mycotoxin produce”. Microbiology 153 (6): 1677–1692. doi:10.1099/mic.0.2007/007641-0.
- ^ “Aspergillus flavus :: Center for Integrated Fungal Research”. www.cifr.ncsu.edu. 2017年5月8日閲覧。
- ^ “Definition of Aspergillosis | Aspergillosis | Types of Fungal Diseases | Fungal Diseases | CDC” (英語). www.cdc.gov. 2017年5月8日閲覧。
- ^ a b c d e f g h Dewick, P.M. (2009). Medicinal Natural Products: A Biosynthetic Approach (3rd ed.). Wiley. pp. 122–4. ISBN 0470742798
- ^ a b “Aflatoxin biosynthetic pathway: elucidation by using blocked mutants of Aspergillus parasiticus”. Arch. Biochem. Biophys. 178 (1): 285–92. (January 1977). doi:10.1016/0003-9861(77)90193-x. PMID 836036.
- ^ a b c d e f g “Clustered pathway genes in aflatoxin biosynthesis”. Appl. Environ. Microbiol. 70 (3): 1253–62. (March 2004). PMC 368384. PMID 15006741.
- ^ (us), National Center for Biotechnology Information (1998-01-01). The p53 tumor suppressor protein. National Center for Biotechnology Information (US)
- ^ Fernández-Medarde, Alberto; Santos, Eugenio (2017-05-08). “Ras in Cancer and Developmental Diseases”. Genes & Cancer 2 (3): 344–358. doi:10.1177/1947601911411084. ISSN 1947-6019. PMC 3128640. PMID 21779504.
- ^ a b c Semela, Maryann (2001). “The chemistry and biology of aflatoxin B1: from mutational spectrometry to carcinogenesis”. Carcinogenesis 22: 535–545.
- ^ Ross, R. K.; Yuan, J. M.; Yu, M. C.; Wogan, G. N.; Qian, G. S.; Tu, J. T.; Groopman, J. D.; Gao, Y. T. et al. (1992-04-18). “Urinary aflatoxin biomarkers and risk of hepatocellular carcinoma”. Lancet 339 (8799): 943–946. doi:10.1016/0140-6736(92)91528-g. ISSN 0140-6736. PMID 1348796.
- ^ Gerald N. Wogan (1966). “Chemical Nature and Biological Effects of the Aflatoxins”. Bacteriol Rev. 30 (2): 460-470. PMC 441006. PMID 5327461.
- ^ Agag, B. I. (2004). “Mycotoxins in foods and feeds: 1-Aflatoxins”. Ass. Univ. Bull. Environ. Res. 7 (1): 173-205.
- ^ Butler W. H. (1964). “Acute Toxicity of Aflatoxin B1 in Rats”. Br J Cancer 18 (4): 756–762. doi:10.1038/bjc.1964.87.
- ^ a b Azziz-Baumgartner, Eduardo; Lindblade, Kimberly; Gieseker, Karen; Rogers, Helen Schurz; Kieszak, Stephanie; Njapau, Henry; Schleicher, Rosemary; McCoy, Leslie F. et al. (2005-01-01). “Case-Control Study of an Acute Aflatoxicosis Outbreak, Kenya, 2004”. Environmental Health Perspectives 113 (12): 1779–1783. doi:10.1289/ehp.8384. JSTOR 3436751.
- ^ Tulpule P. G., Madhavan T. V., Gopalan C. (1964). “Effect of feeding aflatoxin in young monkeys”. Lancet 1: 962.
- ^ Dalvi, R. R; McGowan, C (1984). “Experimental Induction of Chronic Aflatoxicosis in Chickens by Purified Aflatoxin B1 and Its Reversal by Activated Charcoal, Phenobarbital, and Reduced Glutathione”. Poultry Science 63 (3): 485. doi:10.3382/ps.0630485. PMID 6425817.
- ^ Sahoo PK, Mukherjee SC, Nayak SK, Dey S (2001). “Acute and subchronic toxicity of aflatoxin B1 to rohu, Labeo rohita (Hamilton)” (PDF). Indian J. Exp. Biol. 39 (5): 453-458. PMID 11510129.
- ^ Gursoy-Yuzugullu, Ozge; Yuzugullu, Haluk; Yilmaz, Mustafa; Ozturk, Mehmet (2011). “Aflatoxin genotoxicity is associated with a defective DNA damage response bypassing p53 activation”. Liver International 31 (4): 561. doi:10.1111/j.1478-3231.2011.02474.x. PMID 21382167.
- ^ Newberne Paul M., Wogan Gerald N. (1968). “Sequential Morphologic Changes in Aflatoxin B1 Carcinogenesis in the Rat”. Cancer Res 28: 770–781.
- ^ Sur, E; Celik, İ (2003). “Effects of aflatoxin B1on the development of the bursa of Fabricius and blood lymphocyte acid phosphatase of the chicken”. British Poultry Science 44 (4): 558. doi:10.1080/00071660310001618352. PMID 14584846.
- ^ Wangikar, P.B; Dwivedi, P; Sinha, N; Sharma, A.K; Telang, A.G (2005). “Effects of aflatoxin B1 on embryo fetal development in rabbits”. Food and Chemical Toxicology 43 (4): 607. doi:10.1016/j.fct.2005.01.004. PMID 15721209.
- ^ Sahoo, P.K.; Mukherjee, S.C. (2001). “Immunosuppressive effects of aflatoxin B1 in Indian major carp (Labeo rohita)”. Comparative Immunology, Microbiology and Infectious Diseases 24 (3): 143–149. doi:10.1016/S0147-9571(00)00017-5. PMID 11440188.
- ^ a b Richard Lawley (2013年2月1日). “AFLATOXINS”. Food Safety Watch. 2017年7月6日時点のオリジナルよりアーカイブ。2018年1月19日閲覧。
- ^ “Contamination issues, technology”. J. Am. Oil Chem. Soc. 66 (10): a1402–a1408. (1989). doi:10.1007/BF02661958.
- ^ Park, Douglas L.; Liang, Bailin (1993). “Perspectives on aflatoxin control for human food and animal feed”. Trends Food Sci. Technol. 4 (10): 334–342. doi:10.1016/0924-2244(93)90104-I.
- ^ EEC (1991). EEC Council Directive 91/126/EEC. Amending the annexes to Council Directive 74/63/EEC on undesirable substances and products in animal nutrition. Off. J. Eur. Commun., No. L 60.
- ^ FAO/WHO (1990). FAO/WHO Standards Programme. Codex Alimentarius Commission, Alinorm 91/29.
- ^ FAO/WHO (1992). FAO/WHO Standards Programme. Codex Alimentarius Commission, Alinorm 93/12.
- ^ Wannop, C. C. (1961-01-01). “The Histopathology of Turkey "X" Disease in Great Britain”. Avian Diseases 5 (4): 371–381. doi:10.2307/1587768. JSTOR 1587768.
- ^ Richard, John L. (2008-01-01). “Discovery of Aflatoxins and Significant Historical Features”. Toxin Reviews 27 (3–4): 171–201. doi:10.1080/15569540802462040. ISSN 1556-9543.
- ^ Ngindu Augustine (1982). “OUTBREAK OF ACUTE HEPATITIS CAUSED BY AFLATOXIN POISONING IN KENYA” (英語). The Lancet 319 (8285): 1346–1348. doi:10.1016/S0140-6736(82)92411-4 2017年5月8日閲覧。.
