塩分濃度
塩分濃度(えんぶんのうど、英語: Salinity(サリニティ))は水に溶けている塩の量。塩化ナトリウムだけでなく、硫酸マグネシウム、硫酸カルシウム、炭酸水素塩などの塩類を含めて言うことが多い。オーストラリアや北アメリカではSalinityの語が土壌に含まれる塩分を指すことも多い。
定義
| 水の塩分濃度 | |||
|---|---|---|---|
| 淡水 | 汽水 | 食塩水 | 塩水(ブライン) |
| < 0.05 % | 0.05 – 3 % | 3 – 5 % | > 5 % |
| < 0.5 ‰ | 0.5 – 30 ‰ | 30 – 50 ‰ | > 50 ‰ |
水中の塩分濃度の指標として、水中に溶けている陰イオンの中で最も濃度が高いハロゲン化合物、特に塩化物の濃度に着目することも多く、これをハリニティ(halinity)と言う。なお、「halo-」は「塩の」「海の」を表す接頭語であり、塩分濃度と同じ意味で使われることも多い。
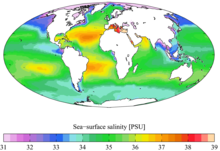
世界の海水の塩分濃度を色で表すと(冒頭図参照)、同じ塩分濃度の場所が等高線のように現れる。この「等高線」を等塩分線(isohale)と呼ぶ。
塩分濃度は、水に溶解している塩分(正確には溶解している固形物質全て)の量である[2]。水1リットルに溶けている量を意味する場合と、水1kgに溶けている量を表す場合とがあり、値にそれほど大きな違いは無いが、正確な値が必要な場合にはその区別に注意する必要がある。
海洋学では伝統的に、塩分濃度を海水1キログラムに塩分が何グラム溶けているかで表す(これを絶対塩分という)。つまり、単位はg/kgまたはパーミル(‰)である。(パーミルの単位記号に「ppt」parts per thousandを使うことも多いが、現在ではpptは1兆分の1を意味するparts per trillionの意味で使われることが多いので注意。)そのほか伝統的には、物理化学では溶媒1キログラムに溶けている溶質が何グラム溶けているか(g/kg 溶媒)、分析化学では溶液1リットルに溶質が何グラム溶けているか(g/L 溶液)で表すことが多かった[3]。海洋学では塩分の「分」の文字に「濃度」の意味が含まれていることから「塩分濃度」という言葉を使っておらず、塩分または塩濃度という言葉を使っている。
定義の歴史
昔は塩分濃度を硝酸銀滴定、あるいは蒸発残渣の量で求めることが多かったが、これはいずれも手数がかかり、正確に測定するのも難しかった。1960年代になって液体用の電気伝導率計が発達したため、それ以降しばらくはコペンハーゲンの研究所が濃度を測定した海水「コペンハーゲン水」(Copenhagen water)を標準海水として、それとの電気伝導率の比較で求めることが多くなった(標準海水の塩分濃度は従来どおり硝酸銀滴定で求めた)[3][4]。
1978年、海洋学者は標準海水の代わりに、塩化カリウムの標準液を作り、それとの電気伝導率の比率で表すことを提案した。この値をPractical Salinity Scale (PSS) という。単位はパーミル(つまり無次元数)である[5][6]。パーミルの代わりに単位PSU(Practical Salinity Unit、日本語では実用塩分単位という。単位はつかない)を使うこともあるが、正式なものではない[3]。
塩分濃度で見た水の区分
| 海水区分 | |
| >300 | -------------------- |
| hyperhaline(超塩層) | |
| 60 - 80 | -------------------- |
| metahaline(高塩層) | |
| 40 | -------------------- |
| mixoeuhaline(混合塩層) | |
| 30 | -------------------- |
| polyhaline(多塩層) | |
| 18 | -------------------- |
| mesohaline(中間塩層) | |
| 5 | -------------------- |
| oligohaline(少塩層) | |
| 0.5 | -------------------- |
海水の塩分濃度は大体が30~35パーミルであるが、内陸には海水よりも塩分濃度が濃い水、薄い水がある。塩分の濃淡を表す区分方法はいろいろあるが、よく使われるものの一つにhaline(塩分量)がある。halineの区分に日本語の定訳は無いが、海水と同じ30~35パーミルの水をeuhaline sea(同塩海)、これよりも薄い0.5~30パーミルの水(いわゆる汽水)をmixohaline sea(混合塩海)、36~40パーミルの水をmetahaline sea(高塩海)と呼ぶ。右の表は1959年に定義され、1972年にPorにより修正された[7]ヴェニス系と呼ばれる区分である[8]。
塩分濃度が季節を通じて海水とほぼ同じ水はhomoiohaline(類似塩層)と呼ばれる。homoiohalineの湖は、海と常に繋がっている場合がほとんどである。これに対して塩分濃度が変化する水はpoikilohaline(乱鹹層 らんかんそう)と呼ばれ、その塩分濃度は0.5から300超までさまざまである。poikilohalineが生物環境に与える影響は大きい[9]。塩分の変化は1年ごとの周期を持っていたり、それよりも長期であったりとさまざまである。
周囲への影響
塩分濃度の大小は、周りに住む生物にとって重要である。まず、陸上植物に影響する。植物に影響するのは地表の水溜りだけではなく、地下水もである。塩分濃度が高い環境に適している植物は、塩生植物と呼ばれている。また、極端に高い塩分濃度で生きられる生物は極限環境微生物と呼ばれ、とりわけ好塩菌が重要である。また、塩分濃度が大きく変化しても生きていける生物は好塩性 (euryhaline) であると言われる。
人間が飲用に使う場合、水から塩分を取り除くのは非常に困難であり、コストがかかる。この意味でも塩分濃度は重要である。
関連項目
- 淡水
- 海水
- 塩害
- 熱塩循環 中深層での海流の動き
- 海水淡水化
- Soil salinity control 土壌の塩分量調整
- Sodium Adsorption Ratio カルシウムイオン、マグネシウムイオンに対するナトリウムイオンの比率
- en:Stenohaline 塩分濃度変化に弱い生物
- en:Euryhaline 塩分濃度変化に強い生物
参考文献
- ^ World Ocean Atlas 2005.
- ^ 中村泰男 海水の物性と水塊分布
- ^ a b c 角皆静男 海水の塩分の定義と単位
- ^ Lewis, E.L. (1980). The Practical Salinity Scale 1978 and its antecedents. IEEE J. Ocean. Eng., OE-5(1): 3-8.
- ^ Unesco (1981a). The Practical Salinity Scale 1978 and the International Equation of State of Seawater 1980. Tech. Pap. Mar. Sci., 36: 25 pp.
- ^ Unesco (1981b). Background papers and supporting data on the Practical Salinity Scale 1978. Tech. Pap. Mar. Sci., 37: 144 pp.
- ^ Por, F. D. (1972). Hydrobiological notes on the high-salinity waters of the Sinai Peninsula. Mar. Biol., 14(2): 111–119.
- ^ Venice system (1959). The final resolution of the symposium on the classification of brackish waters. Archo Oceanogr. Limnol., 11 (suppl): 243–248.
- ^ Dahl, E. (1956). Ecological salinity boundaries in poikilohaline waters. Oikos, 7(I): 1–21.
- Mantyla, A.W. 1987. Standard Seawater Comparisons updated. J. Phys. Ocean., 17: 543-548.
- 中内清文 英和海洋辞典 一部の訳語
