RPE65
RPE65(retinal pigment epithelium-specific 65 kDa protein)またはレチノイドイソメロヒドロラーゼ(英: retinoid isomerohydrolase)は、脊椎動物の視覚サイクルの酵素であり、ヒトではRPE65遺伝子によってコードされる[5][6]。RPE65は、網膜色素上皮(RPE、光受容細胞に栄養を供給する上皮細胞層)で発現しており、光シグナル伝達の過程でall-trans-レチニルエステルから11-cis-レチノールへの変換を担う[7]。その後、11-cis-レチノールは光受容細胞での視色素の再生に利用される[8][9]。RPE65は、カロテノイドオキシゲナーゼファミリーに属する[8]。
機能[編集]
RPE65は脊椎動物の視覚サイクルに重要な酵素であり、網膜色素上皮に存在する。また、桿体細胞と錐体細胞にも存在する[10]。11-cis-レチナールからall-trans-レチナールへの光異性化は光シグナル伝達経路を開始し、脳はこの経路を介して光を検知する。All-trans-レチノールは光活性を持たないため、オプシンと再び結合して活性型の視色素を形成するまでに、11-cis-レチナールへ再変換される必要がある[8][11]。RPE65はall-trans-レチニルエステルを11-cis-レチノールへ変換することで、光異性化を逆転させる。RPE65の最も一般的なエステル基質は、パルミチン酸レチノールである。視覚サイクルを完結するためには、All-trans-レチノールからレチニルエステル(RPE65の基質)への酸化とエステル化、そして11-cis-レチノールから11-cis-レチナール(光活性のある視色素の構成要素)への酸化を行う、他の酵素も必要である[8][9]。
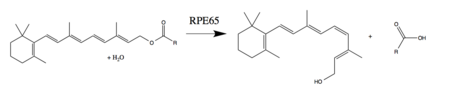
RPE65は、酵素の基質やエステルの加水分解に関与しているかどうかに関する過去の議論のため、レチノールイソメラーゼやレチノイドイソメラーゼと呼ばれることもある。
構造[編集]
RPE65は2つの対称的な、酵素反応的には独立したサブユニットからなる二量体である。各サブユニットの活性部位は7枚の羽根を持つβプロペラ構造を持ち、4つのヒスチジンが補因子として鉄(II)イオンを結合している[9][12]。この構造モチーフは、研究が行われているカロテノイドオキシゲナーゼファミリーの酵素の間で共通している。RPE65は網膜上皮細胞で滑面小胞体の膜に強固に結合している[8]。
活性部位[編集]
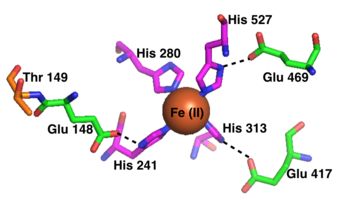
RPE65の活性部位には、4つのヒスチジン(His180、His241、His313、His527)に結合したFe(II)の補因子が存在する。4つのヒスチジンはそれぞれβプロペラ構造の異なる羽根に位置している。4つのヒスチジンのうち3つの近傍にはグルタミン酸残基(Glu148、Glu417、Glu469)が配位しており、補因子の鉄に対するヒスチジンの八面体型配置での結合を補助していると考えられている[13]。活性部位を囲むPhe103、Thr147、Glu148はカルボカチオン中間体の安定化を助け、13-cis-レチノールと比較して11-cis-レチノールに対する立体選択性を高めている[9]。
反応物や生成物は、疎水性のトンネルを通って活性部位に出入りしていると考えられる。このトンネルは、基質となる脂質を直接吸収するために脂質膜に向かって開いていると考えられる。もう1つのより小さなトンネルも活性部位に達しているが、レチノイドの反応物や生成物を輸送するには狭すぎるため、水分子の経路となっていると考えられる[9][13]。
膜との相互作用[編集]
RPE65は、滑面小胞体の膜に強固に結合している。滑面小胞体は脂質であるレチノイドのプロセシングに関与するため、網膜色素上皮の細胞には非常に豊富に存在する。構造研究からは、RPE65はその疎水性表面と脂質膜内部との相互作用によって、滑面小胞体の膜に部分的に埋め込まれていることが示されている。このことは、RPE65の可溶化に界面活性剤が必要であることからも支持される。RPE65の疎水性表面の大部分(109–126番残基)は両親媒性のαヘリックスを形成しており、タンパク質の膜に対する親和性に寄与していると考えられる。また、内在性のRPE65ではCys112はパルミトイル化されており、RPE65の疎水性表面が膜に埋め込まれていることのさらなる裏付けとなっている[13]。
RPE65の疎水性表面には、酵素の活性部位へつながる大きなトンネルの入り口が存在する。このチャネルが疎水性表面に存在することと、RPE65は脂質二重層から基質を直接吸収する能力が実証されていることも、RPE65は膜に部分的に埋め込まれていることを支持している[8]。
保存性[編集]
RPE65は、ゼブラフィッシュ、ニワトリ、マウス、カエル、ヒトなど幅広い脊椎動物から単離されている[8][14][15]。その構造は種間で高度に保存されており、特にβプロペラと推定膜結合領域で保存性が高い。ヒトとウシのRPE65のアミノ酸配列の差異は1%未満である[13]。βプロペラ構造のヒスチジン残基とそこに結合するFe(II)補酵素は、研究が行われているRPE65のオルソログやカロテノイドオキシゲナーゼファミリーの他のメンバーで100%保存されている[9]。
可溶型RPE65(sRPE65)[編集]
以前、RPE65には膜結合型のmRPE65と可溶型のsRPE65という2つの互換可能な形態が存在することが提唱されていた。この仮説では、Cys231、Cys329、Cys330のパルミトイル化によるsRPE65からmRPE65への可逆的な変換が、視覚サイクルの調節やmRPE65に対する膜親和性の付与に関与していることが示唆されていた[16]。しかしRPE65の結晶構造解析により、これらの残基はパルミトイル化されておらず、分子表面にも露出していないことが示された。また新たな研究では、可溶性RPE65の豊富な存在も確認できなかった。そのため、現在ではこの仮説はほぼ放棄されている[8][13]。
機構[編集]

RPE65によるall-trans-レチニルエステルから11-cis-レチノールへの変換は、SN1反応によるO-アルキル結合の開裂によって触媒される。RPE65によるO-アルキルエステルの開裂、幾何異性化、そして水の付加という組み合わせは、現在の生物学では唯一のものであると考えられている。しかしながら、同様に安定化されたカルボカチオン中間体によるO-アルキルエステルの開裂は有機化学者によって利用されている[9][17]。
O-アルキル開裂[編集]
Fe(II)補因子の助けを借りたエステル結合のO-アルキル開裂は、共役ポリエン鎖によって安定化されたカルボカチオン中間体を生成する。カルボカチオンの非局在化によりポリエン鎖の結合次数は低下し、トランスからシスへの異性化の活性化エネルギーが低下する。Phe103とThr178は異性化したカルボカチオンをさらに安定化し、酵素の立体選択性を担っていると考えられている。異性化後、C15に対する水分子の求核攻撃によってポリエン鎖の共役が回復し、エステル結合の開裂が完了する[9][13]。
代替的なSN2機構の可能性[編集]
他の生化学的なエステル加水分解反応のほぼすべては、アシル炭素でのSN2反応によって行われる。しかし同位体標識研究により、RPE65の最終的な11-cis-レチノール産物の酸素は反応するエステルではなく溶媒に由来するものであることが示されており、O-アルキル開裂機構が支持される[13]。さらにSN2エステル加水分解反応機構では、反応の異性化部分を完了させるために、何らかの求核剤(おそらくシスチン残基)による電子豊富なC11に対する不利なSN2攻撃が必要となる。アルケンに対する求核攻撃はエネルギー的に不利であるだけでなく、活性部位には求核剤として働くシスチン残基は存在しない[8][9]。
臨床的意義[編集]
RPE65遺伝子の変異は、レーバー先天性黒内障2型(LCA2)や網膜色素変性症(RP)と関係している[6][18]。デンマークのLCA患者で最も一般的に検出される変異は、RPE65の変異である[19]。LCA2とRPの患者におけるRPE65の変異の大部分はβプロペラ部分に生じており、タンパク質の適切なフォールディングと補因子の鉄の結合を阻害すると考えられている。プロペラ部分の変異部位として特に一般的なのは、Tyr368とHis182である。また、Arg91の置換も一般的であり、RPE65の膜との相互作用や基質の取り込みに影響を与えることが示されている[13]。
RPE65の機能の完全な喪失はLCAやRPなどの疾患と関係しているが、RPE65の部分的な阻害は加齢黄斑変性(AMD)の治療法として提唱されている。All-trans-レチニルアミン(Ret-NH2)とエミクススタットは、いずれもRPE65を競合的に阻害することが示されている[9]。エミクススタットは現在、AMDの治療薬としてFDAの第3相臨床試験が行われている[9][20]。また、Jean BennettとKatherine A. HighによるRPE65の変異に関する研究によって遺伝性の失明から回復が可能となり、遺伝子疾患に対する遺伝子治療として初めてFDAの承認を受けた(ボレチジーンネパルボベック)。
出典[編集]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000116745 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000028174 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Molecular cloning and expression of RPE65, a novel retinal pigment epithelium-specific microsomal protein that is post-transcriptionally regulated in vitro”. The Journal of Biological Chemistry 268 (21): 15751–7. (Jul 1993). doi:10.1016/S0021-9258(18)82319-5. PMID 8340400.
- ^ a b “Entrez Gene: RPE65 retinal pigment epithelium-specific protein 65kDa”. 2021年7月11日閲覧。
- ^ “Function of the protein RPE65 in the visual cycle”. Nutrition Reviews 63 (3): 97–100. (Mar 2005). doi:10.1111/j.1753-4887.2005.tb00127.x. PMID 15825812.
- ^ a b c d e f g h i “Membrane-binding and enzymatic properties of RPE65”. Progress in Retinal and Eye Research 29 (5): 428–42. (Sep 2010). doi:10.1016/j.preteyeres.2010.03.002. PMC 2903629. PMID 20304090.
- ^ a b c d e f g h i j k “Catalytic mechanism of a retinoid isomerase essential for vertebrate vision”. Nature Chemical Biology 11 (6): 409–15. (Jun 2015). doi:10.1038/nchembio.1799. PMC 4433804. PMID 25894083.
- ^ Tang, Peter H.; Buhusi, Mona C.; Ma, Jian-Xing; Crouch, Rosalie K. (2011-12-14). “RPE65 is present in human green/red cones and promotes photopigment regeneration in an in vitro cone cell model”. The Journal of Neuroscience 31 (50): 18618–18626. doi:10.1523/JNEUROSCI.4265-11.2011. ISSN 1529-2401. PMC 3297673. PMID 22171060.
- ^ “Chemistry of the retinoid (visual) cycle”. Chemical Reviews 114 (1): 194–232. (Jan 2014). doi:10.1021/cr400107q. PMC 3858459. PMID 23905688.
- ^ “Structural approaches to understanding retinal proteins needed for vision”. Current Opinion in Cell Biology 27: 32–43. (Apr 2014). doi:10.1016/j.ceb.2013.11.001. PMC 3971393. PMID 24680428.
- ^ a b c d e f g h “Crystal structure of native RPE65, the retinoid isomerase of the visual cycle”. Proceedings of the National Academy of Sciences of the United States of America 106 (41): 17325–30. (Oct 2009). doi:10.1073/pnas.0906600106. PMC 2765077. PMID 19805034.
- ^ Takahashi, Yusuke; Moiseyev, Gennadiy; Ma, Jian-xing (2014-09-26). “Identification of key residues determining isomerohydrolase activity of human RPE65”. The Journal of Biological Chemistry 289 (39): 26743–26751. doi:10.1074/jbc.M114.558619. ISSN 1083-351X. PMC 4175317. PMID 25112876.
- ^ “Rpe65 is the retinoid isomerase in bovine retinal pigment epithelium”. Cell 122 (3): 449–59. (Aug 2005). doi:10.1016/j.cell.2005.06.042. PMC 2748856. PMID 16096063.
- ^ “Expression, purification, and MALDI analysis of RPE65”. Investigative Ophthalmology & Visual Science 42 (7): 1429–35. (Jun 2001). PMID 11381042.
- ^ Redmond, T. Michael; Poliakov, Eugenia; Kuo, Stephanie; Chander, Preethi; Gentleman, Susan (2010-01-15). “RPE65, visual cycle retinol isomerase, is not inherently 11-cis-specific: support for a carbocation mechanism of retinol isomerization”. The Journal of Biological Chemistry 285 (3): 1919–1927. doi:10.1074/jbc.M109.027458. ISSN 1083-351X. PMC 2804350. PMID 19920137.
- ^ “A dominant mutation in RPE65 identified by whole-exome sequencing causes retinitis pigmentosa with choroidal involvement”. European Journal of Human Genetics 19 (10): 1074–81. (Oct 2011). doi:10.1038/ejhg.2011.86. PMC 3190249. PMID 21654732.
- ^ “Comprehensive genotyping reveals RPE65 as the most frequently mutated gene in Leber congenital amaurosis in Denmark”. European Journal of Human Genetics 24 (7): 1071–1079. (Dec 2015). doi:10.1038/ejhg.2015.241. PMC 5070892. PMID 26626312.
- ^ “Acucela - Retinal Diseases”. acucela.com. 2016年3月1日閲覧。
関連文献[編集]
- タンパク質の構造と機能
- “Characterization of a plasma retinol-binding protein membrane receptor expressed in the retinal pigment epithelium”. The Journal of Biological Chemistry 267 (32): 23035–42. (Nov 1992). doi:10.1016/S0021-9258(18)50052-1. PMID 1331074.
- “A developmentally regulated microsomal protein specific for the pigment epithelium of the vertebrate retina”. Journal of Neuroscience Research 34 (4): 414–25. (Mar 1993). doi:10.1002/jnr.490340406. PMID 8474143.
- “RPE65, the major retinal pigment epithelium microsomal membrane protein, associates with phospholipid liposomes”. Archives of Biochemistry and Biophysics 346 (1): 21–7. (Oct 1997). doi:10.1006/abbi.1997.0276. PMID 9328280.
- 臨床・遺伝学的研究
- “Genetic testing for retinal dystrophies and dysfunctions: benefits, dilemmas and solutions”. Clinical & Experimental Ophthalmology 35 (5): 473–85. (Jul 2007). doi:10.1111/j.1442-9071.2007.01534.x. PMID 17651254.
- “Molecular characterization of the human gene encoding an abundant 61 kDa protein specific to the retinal pigment epithelium”. Human Molecular Genetics 4 (4): 641–9. (Apr 1995). doi:10.1093/hmg/4.4.641. PMID 7633413.
- “The gene for the retinal pigment epithelium-specific protein RPE65 is localized to human 1p31 and mouse 3”. Genomics 20 (3): 509–12. (Apr 1994). doi:10.1006/geno.1994.1212. PMID 8034329.
- “Mutations in RPE65 cause Leber's congenital amaurosis”. Nature Genetics 17 (2): 139–41. (Oct 1997). doi:10.1038/ng1097-139. PMID 9326927.
- “Mutations in RPE65 cause autosomal recessive childhood-onset severe retinal dystrophy”. Nature Genetics 17 (2): 194–7. (Oct 1997). doi:10.1038/ng1097-194. PMID 9326941.
- “Mutations in the RPE65 gene in patients with autosomal recessive retinitis pigmentosa or leber congenital amaurosis”. Proceedings of the National Academy of Sciences of the United States of America 95 (6): 3088–93. (Mar 1998). Bibcode: 1998PNAS...95.3088M. doi:10.1073/pnas.95.6.3088. PMC 19699. PMID 9501220.
- “Promoter analysis of RPE65, the gene encoding a 61-kDa retinal pigment epithelium-specific protein”. Investigative Ophthalmology & Visual Science 39 (3): 637–44. (Mar 1998). PMID 9501877.
- “Autosomal recessive retinal dystrophy associated with two novel mutations in the RPE65 gene”. European Journal of Human Genetics 6 (5): 527–31. (1999). doi:10.1038/sj.ejhg.5200205. PMID 9801879.
- “Identification of RPE65 in transformed kidney cells”. FEBS Letters 452 (3): 199–204. (Jun 1999). doi:10.1016/S0014-5793(99)00606-7. PMID 10386590.
- “Mutation analysis of 3 genes in patients with Leber congenital amaurosis”. Archives of Ophthalmology 118 (4): 538–43. (Apr 2000). doi:10.1001/archopht.118.4.538. PMID 10766140.
- “Four novel mutations in the RPE65 gene in patients with Leber congenital amaurosis”. Human Mutation 18 (2): 164. (Aug 2001). doi:10.1002/humu.1168. PMID 11462243.
- “Retinal dystrophy due to paternal isodisomy for chromosome 1 or chromosome 2, with homoallelism for mutations in RPE65 or MERTK, respectively”. American Journal of Human Genetics 70 (1): 224–9. (Jan 2002). doi:10.1086/338455. PMC 384890. PMID 11727200.
- “Clinical course and visual function in a family with mutations in the RPE65 gene”. Archives of Ophthalmology 120 (1): 55–61. (Jan 2002). doi:10.1001/archopht.120.1.55. PMID 11786058.
- “RPE65 gene: multiplex PCR and mutation screening in patients from India with retinal degenerative diseases”. Journal of Genetics 81 (1): 19–23. (Apr 2002). doi:10.1007/BF02715866. PMID 12357075.
- “A Tyr368His RPE65 founder mutation is associated with variable expression and progression of early onset retinal dystrophy in 10 families of a genetically isolated population”. Journal of Medical Genetics 40 (9): 709–13. (Sep 2003). doi:10.1136/jmg.40.9.709. PMC 1735582. PMID 12960219.






