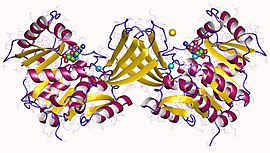
リボキナーゼ
リボキナーゼ(Ribokinase、EC 2.7.1.15)は、以下の化学反応を触媒する酵素である。
- ATP + D-リボース ADP + D-リボース-5-リン酸
従って、この酵素の基質はATP、D-リボースの2つ、生成物はADP、D-リボース-5-リン酸の2つである。
この酵素は転移酵素、特にアルコールを受容体とするホスホトランスフェラーゼに分類される。この酵素の系統名は、ATP:D-リボース 5-ホスホトランスフェラーゼ(ATP:D-ribose 5-phosphotransferase)である。この酵素は、ペントースリン酸経路に関与している。
リボキナーゼは、糖キナーゼのホスホフルクトキナーゼB(PfkB)ファミリーに属する[1]。このファミリー(RKファミリーとも呼ばれる)の他のメンバーには、アデノシンキナーゼ、イノシンキナーゼ、フルクトキナーゼ、1-ホスホフルクトキナーゼが含まれる[1][2][3]。PfkB/RKファミリーは3つの保存された配列モチーフの存在によって同定され、このファミリーのタンパク質の酵素活性は一般的に五価イオンの存在に対する依存性を示す[1][2][4]。PfkBファミリーのタンパク質に独特の性質である、保存されたNXXEモチーフが五価イオン依存性に関係している。リボキナーゼや他のPfkBファミリータンパク質の構造は多くの種で決定されている[5]。アデノシンキナーゼと他のPfkBファミリータンパク質の配列類似性は低いが、タンパク質の構造レベルではきわめて類似している[1]。
構造[編集]
2007年末時点で、7つの構造が解明されている。蛋白質構造データバンクのコードは、1GQT、1RK2、1RKA、1RKD、1RKS、1VM7及び2FV7である。
出典[編集]
- ^ a b c d Park, J.; Gupta, R. S. (2008-09). “Adenosine kinase and ribokinase--the RK family of proteins”. Cellular and molecular life sciences: CMLS 65 (18): 2875–2896. doi:10.1007/s00018-008-8123-1. ISSN 1420-682X. PMID 18560757.
- ^ a b Bork, P.; Sander, C.; Valencia, A. (1993-01). “Convergent evolution of similar enzymatic function on different protein folds: the hexokinase, ribokinase, and galactokinase families of sugar kinases”. Protein Science: A Publication of the Protein Society 2 (1): 31–40. doi:10.1002/pro.5560020104. ISSN 0961-8368. PMC 2142297. PMID 8382990.
- ^ Spychala, J.; Datta, N. S.; Takabayashi, K.; Datta, M.; Fox, I. H.; Gribbin, T.; Mitchell, B. S. (1996-02-06). “Cloning of human adenosine kinase cDNA: sequence similarity to microbial ribokinases and fructokinases”. Proceedings of the National Academy of Sciences of the United States of America 93 (3): 1232–1237. doi:10.1073/pnas.93.3.1232. ISSN 0027-8424. PMC 40062. PMID 8577746.
- ^ Maj, Mary C.; Singh, Bhag; Gupta, Radhey S. (2002-03-26). “Pentavalent ions dependency is a conserved property of adenosine kinase from diverse sources: identification of a novel motif implicated in phosphate and magnesium ion binding and substrate inhibition”. Biochemistry 41 (12): 4059–4069. doi:10.1021/bi0119161. ISSN 0006-2960. PMID 11900549.
- ^ Sigrell, J. A.; Cameron, A. D.; Jones, T. A.; Mowbray, S. L. (1998-02-15). “Structure of Escherichia coli ribokinase in complex with ribose and dinucleotide determined to 1.8 A resolution: insights into a new family of kinase structures”. Structure (London, England: 1993) 6 (2): 183–193. doi:10.1016/s0969-2126(98)00020-3. ISSN 0969-2126. PMID 9519409.