ベント則
この項目「ベント則」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en:Bent's rule) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2019年8月) |
ベント則(ベントそく、英語: Bent's rule)は、分子内の中心原子の混成軌道と置換基の電気陰性度との関係を表す規則である[1][2]。 ヘンリー・ベントはこの規則について次のように記述している[2][3]。
| 「 | 中心原子上の軌道のs性は電気陽性基との結合に集中する傾向がある | 」 |
分子の化学構造は分子の特性や反応性によく関連している。原子価結合法によると分子構造は原子間の共有結合によるものであり、各結合は2つの原子軌道の重なりから成っていて、通常原子軌道は混成するとしている。分子中のpブロック元素の混成軌道はspn(n =1,2,3)で書き表され、更に混成軌道はすべて等価であると仮定される(つまり、n + 1個のspn混成軌道のp性は同じであると仮定される)。この仮定に基づくアプローチは混成軌道が非整数で非等価なp性を持ち得る等原子価混成を認めることによってより正確になり得る。ベント則は原子軌道がどのように構築されるかについて定性的に推定する[4]。ベント則によると分子内において複数の基と結合した中心原子はよりs性の高い軌道が電気陽性基との結合に向けられ、p性のより高い軌道が電気陰性基との結合に向けられるように混成する。分子内のすべての軌道が等価なspn軌道を持つという仮定を除くと、分子構造や結合の強さといった分子の特性をより正確に説明することが可能となり得る[5]。現代的な結合理論とより強い実験による裏付けによって、より簡単に分子構造を説明できるため、原子価殻電子対反発則に代わってベント則が単純な分子構造を持つ分子の説明に用いられるようになった。
ベント則はdブロック元素にも適用可能である。s性のより高い軌道がより共有結合性の高い結合を形成している配位子との結合に向けられるよう混成された金属原子の中心が配置される。同様にd性の高い軌道はより大きなイオン性を持つ結合を形成する基に向けられるとされる[1]。 最近では典型元素間の75種類の結合へのベント則の有効性が検証された[6]。低い周期の大きな原子の間での結合の場合、軌道混成の傾向は電気陰性度と原子軌道の大きさの両方に強く依存する傾向にある。
歴史[編集]
量子力学の初期の発展の直後の1930年代初頭、量子力学の諸理論はポーリング[7]やスレーター[8]、チャールズ・クールソン[9]などの量子力学者により分子構造に適用されだした。特に、ポーリングは原子内のs軌道とp軌道が合わさってsp混成軌道、sp2混成軌道、sp3混成軌道が形成されるという混成の概念を提唱した。混成軌道の概念はメタンのような分子の分子構造を説明するのに大きく貢献した。しかし、1940年代に混成軌道の理論上の分子構造は実際の分子構造と少し異なっていることが明らかになった[10]。特によく知られた例として水分子があげられる。水分子の結合角は、104.5° であるが、混成理論のみでは109.5° となり予想よりも小さくなる。このような不一致を説明するため、混成軌道のs性とp性は等しくないとすることが提唱された。1947年にアーサー・ドナルド・ウォルシュ[10]は炭素の混成軌道と炭素原子に結合した電気陰性基との関係を説明した。そして、1961年にヘンリー・ベントは分子構造と分子の中心にある原子の混成、置換基の電気陰性度の間の関係性を記した著書を出版したのである[2]。
根拠[編集]

共有結合の場合[編集]
ベント則はs軌道がp軌道より低いエネルギーを持つことによって証明される[2]。電気陰性度が異なる元素間での結合は極性を持ち、この結合における電子密度は電気陰性度の高い元素に偏る。炭素-水素結合の電子密度は炭素側に偏るため、フルオロメタンにこの原則を適用するとベント則が正しいことがわかる。この結合における電子のエネルギーは炭素側の電子密度が増加するために炭素原子がつくる混成軌道に大きく依存する。混成軌道のs性が増すと、s軌道はp軌道よりエネルギーが低いために電子のエネルギーは減少する。
一方、フッ素は炭素よりも電気陰性度が高いため、フッ素-炭素結合では電子密度はフッ素側に偏る。このためフッ素-炭素結合における炭素原子の混成の影響は炭素-水素結合と比較すると比較的少なく、フッ素-炭素結合のエネルギーも混成の影響を比較的受けない。また、混成軌道のp性がよりフッ素に偏ることにより、結合エネルギーはあまり増加しない。
等価なsp3軌道を4つの置換基に向ける代わりに、炭素付近の電子密度の増加のために炭素-水素結合にs性が向けられると結合は安定化する。その一方で炭素-フッ素結合では、電子密度がフッ素側に偏るためにs性は低くなり、比較的少量ではあるがエネルギーが増加する。このようにベント則は炭素原子のs性が炭素-水素結合では大きく、フッ素-炭素結合では小さくなるということを表している。
フルオロメタン以外でも中心原子に2つ以上の置換基が結合している分子では同様のことが成り立つ。 ベント則は軌道中の原子のs性が電気陽性基との結合に集中するために分子全体のエネルギーが減少するということを表している。
非結合軌道の場合[編集]
ベント則は非結合性軌道の混成についても拡張することができる。非結合性軌道中の非共有電子対は電子密度が完全に中心原子側に偏っている電気陽性基とみなすことができる。ベント則では占有された非共有性軌道を安定化させるために孤立電子対のある軌道のs性は高くなっているとしている。一方、電子密度が置換基側に偏るために空の非共有性軌道は電気陰性基となる。ベント則は占有軌道ができるだけs性を帯びるように空の非結合性軌道はできるだけp性が大きくなるとしている。
つまり、この性質は孤立電子対を持つ水やアンモニアなどの分子の結合角が孤立電子対を持たないメタンよりも小さくなることや空の非結合性軌道をもつボランやカルボニウムイオンなどの分子が平面構造を持つことを説明している。
ベント則の適用[編集]
ベント則を用いると分子構造と反応性の両方を説明できる。 中心原子の混成が分子のある性質に対しどのような影響を与えるかを定義すると、置換基の電気陰性度からその分子においてベント則が成り立つかを調べることができる。
結合角[編集]
原子価結合法によれば、共有結合は結合に関与する原子の重なり合う原子軌道にある2つの電子で構成され、それらの原子軌道はしばしば混成している。混成軌道の概念を用いることによって例えばメタンの四面体構造やエチレンの平面構造を用いることができる。しかし実際の水分子の結合角は104.5° でアンモニア分子は107° であるが、混成のみを考慮した場合、その結合角は109.5° となるので実際の分子の形状と異なる。以前は価電子が局在化領域にあり、孤立電子対同士は結合電子対より反発が大きいという原子価殻電子対反発則で結合角が説明されていた。
ベント則はこれらの結合角の差異を違った方法で説明したのである。まず炭素原子がsp3, sp2, and sp混成軌道を作り水素原子と結合し、その結合角がそれぞれ109.5°、120°、180° のメタン、エチレン、アセチレンを考える。より高いp性を持つ混成された原子軌道は結合角がより小さくなる。この結果はコールソン理論と同程度厳密で、定量的である。

次に混成軌道同士の結合とその結合角について考える。メチル基はギ酸や酢酸などの分子の酸解離定数を小さくするためにメチル基全体の電気陰性度は水素原子より小さくなる。[2]。
| 分子 | 置換基同士の結合角 |
|---|---|
ジメチルエーテル |
111° |
メタノール |
107-109° |
水 |
104.5° |
二フッ化酸素 |
103.8° |
表に表した各分子は下のものほど置換基の電気陰性度が大きく、また結合角は小さくなる。ベント則によれば置換基の電気陰性度が大きくなるにつれ置換基と結合する炭素原子軌道のp性は大きくなる。ここでも同様にp性が大きくなるほど結合角は小さくなる。原子価殻電子対反発則では、ジメチルエーテルの結合角が109.5°より大きいことを説明できなかった。
混成軌道がすべて等価であるとした場合、酸素原子のs性の強い混成軌道は非共有電子対の方向に向かい、残りのp性の強い混成軌道は水素の方向に向かうため理想的な酸素原子のsp3混成軌道は25%のs性と75%のp性を帯びることとなる。ベント則を用いて水の結合角を予測すると、水分子の水素-酸素-水素の結合角は104.5° となり、酸素-水素結合における酸素原子のsp4.0混成軌道は20%以内のs性と80%以内のp性を帯びている。非共有電子対は電気陽性基のような性質を示しs性が強くなるため、酸素原子の非共有電子対の方向に向かう混成軌道は30%以内のs性と70%以内のp性を帯びたsp2.3混成軌道となる。一方、結合電子対に向かう混成軌道はよりp性を示すようになり、p性の増加は結合同士の結合角を109.5°から減少させる。また、アンモニアにベント則を適用させると窒素の混成軌道の内3つは23%以内のs性を示してsp3.4混成軌道を作り、残り1つの混成軌道は30%以内のs性を示してsp2.1混成軌道を作る。水素-窒素-水素の結合角は107.0° となる。
結合距離[編集]
原子の混成は原子の結合距離にも関与する[2]。結合性軌道のs性が増加すると、σ結合の長さは短くなる。
| 分子 | 炭素-炭素結合の平均結合距離 |
|---|---|
 |
1.54 Å |
 |
1.50 Å |
 |
1.46 Å |
電気陰性基を加えて中心原子の混成状態を変化させると、結合距離を変化させられる。分子がX-A-Yのような構造を持つとき、置換基Xを電気陰性度のより強い原子に変えると、中心原子Aの混成状態が変わり、隣接するA-Yの結合長は短くなる。
| 分子 | 炭素-フッ素結合の平均結合距離 |
|---|---|
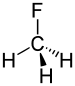 フルオロメタン |
1.388 Å |
 ジフルオロメタン |
1.358 Å |
 トリフルオロメタン |
1.329 Å |
 テトラフルオロメタン |
1.323 Å |
フルオロメタンではフッ素の電気陰性度が水素の電気陰性度よりもかなり高いために炭素原子の水素に向かう軌道のs性は炭素原子のフッ素に向かう軌道のs性より高くなる。ジフルオロメタンでは水素原子は2つとなるため、フッ素に向かう軌道の数が増えて水素に向かう軌道の数が減り、分子全体において水素に向かう軌道が占めるs性の割合が小さくなる。このために炭素-フッ素間の結合距離はフルオロメタンより小さくなる。このように水素原子をフッ素原子に置き換えていくと、次第にs性が増加して結合距離は短くなる。テトラフルオロメタンのs性は25%となり、結合距離は最短となる。
メタンの水素基をクロロ基に置き換えたものでも同様の傾向を示すが、塩素原子はフッ素原子より電気陰性度が小さいため、その影響はフッ素原子に置き換えた場合よりも小さくなる[2]。
| 分子 | 炭素-塩素結合の平均結合距離 |
|---|---|
 クロロメタン |
1.783 Å |
 ジクロロメタン |
1.772 Å |
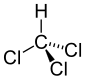 トリクロロメタン |
1.767 Å |
 テトラクロロメタン |
1.766 Å |
立体構造から結合距離を説明しようとするとクロロ基が増えるほど結合距離が長くなることとなるが、実際の結合距離とは逆の傾向を示す。このため、結合距離は結合する原子の大きさよりも結合する原子の電気陰性度がより関与することとなり、立体構造の決定においてはベント則の影響が原子の大きさの影響に優先して関わることとなる。
JCHカップリング定数[編集]
炭素-水素結合のs性を測定する方法の1つに核磁気共鳴分光法で測定された1H−13Cカップリング定数を測定する方法がある。この方法ではJCH値が大きいほどs性が大きくなる[11][12]。特に13C-1Hカップリング定数1J13C-1Hは結合に関与する炭素の混成軌道のs性の値は経験則的にの関係にある。例えば、メタンにおいて炭素-水素結合の純粋なsp3混成軌道は25%のs性を持ち、カップリング定数は500 Hz × 0.25 = 125 Hzとなり、この値は実験値とほぼ一致する。
| 分子 | メチルプロトンのJCH値 |
|---|---|
 メタン |
125 Hz |
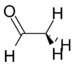 アセトアルデヒド |
127 Hz |
 1,1,1-トリクロロエタン |
134 Hz |
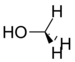 メタノール |
141 Hz |
 フルオロメタン |
149 Hz |
置換基の電気陰性度の増加により、置換基へと向かう軌道のp性は増加する。これにより、メチルプロトンへの結合にs性が残り、JCHカップリング定数は増加する。
誘起効果[編集]
誘起効果もまた、ベント則により説明可能である[13]。誘起効果は共有結合を介した電荷の伝達であり、ベント則は混成の違いにより誘起効果の違いを生む。下の表で示した化合物は下のものほど中心炭素に結合した原子の電気陰性度が大きくなり[14]、またそれに従って中心原子の電子吸引性が増加する。電子求引性は置換基定数によって測られるが、置換基定数はハメット則のσの値とほぼ同じものであり、値が増加するにつれ電子求引性は増加する。 ベント則は置換基の電気陰性度が増加するにつれ、p性はより置換基側に向かい、s性はより結合の間へと向かう。s軌道はp軌道よりも原子核に近いほど電子密度が高くなるため、s性が高まるとC−R結合の電子密度は炭素側に偏る。これにより、中心炭素のR基への電子求引性がより大きくなる[10]。したがって、置換基の電子求引性は隣接する炭素へと移動するため、誘起効果と結果が一致する。
| 置換基 | 置換基定数 |
|---|---|
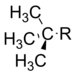 |
−0.30 |
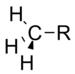 |
0.00 |
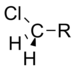 |
1.05 |
 |
1.94 |
 |
2.65 |
証明[編集]
ベント則は原子価結合法よりも多くの情報を与える。 分子軌道法により2原子では共有結合が原子軌道の線形結合で表されることにより近似されるが、原子価結合法でも十分に結合を解釈できる[1]。
原子価結合法によれば、しばしば混成している2原子の重なり合う原子軌道にある2つの電子が共有結合を作っている。原子は必ずしも水素型原子の原子軌道に寄与することによって結合しているとは限らない[7]。 原子が水素型の原子軌道にのみ寄与できる場合、実験的に認められたメタンの四面体構造は炭素の2s軌道と2p軌道の形状によってはできないことを示唆する。このような矛盾のために異なる形状とエネルギーを持つ軌道が干渉して同数の等価な軌道ができるという混成の概念が導入された。例えば、前述したメタンでは1つの2s軌道と3つの2p軌道により、4つの等価なsp3軌道が生成される。軌道の混成により、原子価結合理論による多くの分子の形状と特性の説明ができるようになった。
混成理論では、混成軌道はすべて等価であるとされてきた[15]。すなわち、s軌道とp軌道の混成によって4つの spi3 = 1⁄√4(s + √3pi)軌道または3つの spi2 = 1⁄√3(s + √2pi)軌道または2つの spi = 1⁄√2(s + pi)軌道ができるとしている。軌道の混成では、混成の前後でs軌道とp軌道の寄与の総和は同じであることと混成軌道は互いに直交していることの2条件を満たす必要がある[15]。後者について2つの混成軌道が直交していなければ、定義より軌道同士の重なりは0ではないことを表す。重なりが0ではない軌道の電子は相互作用し、それらの軌道の内の1つが共有結合に関与する場合他の軌道もその結合と相互作用をもつ。しかしこれは結合が2つの電子から成るとする原子価結合法に反する。
そこで、s軌道とp軌道が混成する場合、1つ目の混成軌道が s + √λipiで与えられるとする。ここでpiは結合に向かう軌道を表し、 λiは混成軌道が帯びるp性の寄与を表す。この式は波動関数の加重和を表している。同様に2つ目の混成軌道が s + √λjpjで与えられるとする。ここでpj軌道の向かう方向は任意であるとし、 λjは混成軌道におけるp性の寄与を表す。λjの値とpj軌道の方向は1つ目の混成軌道に対して規格化条件と直交条件を満たすように決定される。混成は2つの規格化された波動関数の和となるため、混成軌道も規格化されている。直交性は2つの混成軌道が別の共有結合に寄与するように決められなければならない。直交する軌道の内積は0にならなければならない。このため2つの混成軌道の内積は次式で表される。
s軌道は規格化されているため、上式第1項の内積はとなる。また、s軌道は pi軌道とpj軌道と直交するため、上式第2項と第3項の内積は0となる。第4項ではωijの角を成す2つの規格化された波動関数の内積は定義よりωijとなる。直交する軌道の内積は0となるため上式はとなる。コールソン理論の式が得られる[15]。
つまり、原子のs軌道とp軌道が任意の方向に混成する時、混成した軌道はすべて直交するため、係数λは上式の条件を満たすこととなる。
ベント則は係数λiの増加により、 s + √λipi混成軌道のp性が増加することを考慮することで上式に適用できる。中心原子Aが置換基Xと置換基Yに結合し、置換基Yの電気陰性度がXより大きい時、原子Aは λX < λYとなるよう混成する。分子の形状を正確に予測するには、ベントの規則を超えるより高度な理論および計算技術が必要であるが、ベント則は分子の形状の説明においてヒューリスティクスな方法である。
脚注[編集]
- ^ a b c Weinhold, F.; Landis, C. L. (2005), Valency and Bonding: A Natural Donor-Acceptor Perspective (1st ed.), Cambridge: Cambridge University Press, ISBN 978-0-521-83128-4
- ^ a b c d e f g Bent, H. A. (1961), “An appraisal of valence-bond structures and hybridization in compounds of the first-row elements”, Chem. Rev. 61 (3): 275–311, doi:10.1021/cr60211a005
- ^ 俣野 善博, 近藤 和弘, 村上 泰興, 河内 敦「十字路」『有機合成化学協会誌』第59巻第9号、2001年、904頁、doi:10.5059/yukigoseikyokaishi.59.904。
- ^ Foster, J. P.; Weinhold, F. (1980), “Natural hybrid orbitals”, J. Am. Chem. Soc. 102 (24): 7211–7218, doi:10.1021/ja00544a007
- ^ Alabugin, I. V.; Bresch S.; Gomes, G. P. (2015). “Orbital Hybridization: a Key Electronic Factor in Control of Structure and Reactivity”. J. Phys. Org. Chem. 28: 147–162. doi:10.1002/poc.3382.
- ^ Alabugin, I. V.; Bresch S.; Manoharan, M. (2014). “Hybridization Trends for Main Group Elements and Expanding the Bent’s Rule Beyond Carbon: More than Electronegativity”. J. Phys. Chem. A 118: 3663– 3677. doi:10.1021/jp502472u.
- ^ a b Pauling, L. (1931), “The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules”, J. Am. Chem. Soc. 53 (4): 1367–1400, doi:10.1021/ja01355a027
- ^ Slater, J. C. (1931), “Directed Valence in Polyatomic Molecules”, Phys. Rev. 37 (5): 481–489, Bibcode: 1931PhRv...37..481S, doi:10.1103/PhysRev.37.481
- ^ Coulson, C. A. (1961), Valence (2nd ed.), Oxford: Clarendon Press
- ^ a b c Walsh, A. D. (1947), “The properties of bonds involving carbon”, Discuss. Faraday Soc. 2: 18–25, doi:10.1039/DF9470200018
- ^ Muller, N.; Pritchard, D. E. (1959), “C13 in Proton Magnetic Resonance Spectra. I. Hydrocarbons”, J. Chem. Phys. 31 (3): 768–771, Bibcode: 1959JChPh..31..768M, doi:10.1063/1.1730460
- ^ Muller, N.; Pritchard, D. E. (1959), “C13 in Proton Magnetic Resonance Spectra. II. Bonding in Substituted Methanes”, J. Chem. Phys. 31 (6): 1471–1476, Bibcode: 1959JChPh..31.1471M, doi:10.1063/1.1730638
- ^ Bent, H. A. (1960), “Distribution of atomic s character in molecules and its chemical implications”, J. Chem. Educ. 37 (12): 616–624, Bibcode: 1960JChEd..37..616B, doi:10.1021/ed037p616
- ^ Taft Jr., R. W. (1957), “Concerning the Electron—Withdrawing Power and Electronegativity of Groups”, J. Chem. Phys. 26 (1): 93–96, Bibcode: 1957JChPh..26...93T, doi:10.1063/1.1743270
- ^ a b c Coulson, C. A. (1961), Valence (2nd ed.), Oxford: Clarendon Press, pp. 203–5 Non–equivalent hybrids


![{\displaystyle {\begin{aligned}\langle s+{\sqrt {\lambda _{i}}}p_{i}\mid s+{\sqrt {\lambda _{j}}}p_{j}\rangle &=\langle s\mid s\rangle +{\sqrt {\lambda _{i}}}\langle s\mid p_{i}\rangle +{\sqrt {\lambda _{j}}}\langle s\mid p_{j}\rangle +{\sqrt {\lambda _{i}\lambda _{j}}}\langle p_{i}\mid p_{j}\rangle \\[4pt]&=1+0+0+{\sqrt {\lambda _{i}\lambda _{j}}}\cos \omega _{ij}=1+{\sqrt {\lambda _{i}\lambda _{j}}}\cos \omega _{ij}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/adeec3f9562f7fb7ae3ce5f8800bd09b8b736da2)


