ティラピアレイクウイルス
| ティラピアレイクウイルス | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分類 | ||||||||||||||||||||||||
|
ティラピアレイクウイルス(英: Tilapia lake virus, Tilapia tilapinevirus、略称: TiLV)は、天然・養殖ティラピアに感染する一本鎖マイナス鎖RNAウイルスである[1]。ティラピネウイルス属(Tilapinevirus)に属する唯一の種であり、またティラピネウイルス属もアムヌーンウイルス科(Amnoonviridae)の唯一の属である[2]。このウイルスは2014年にイスラエルのガリラヤ湖でティラピアの漁獲量が大幅に低下した際に発見と同定が行われ[3]、これまでアジア、アフリカ、南アメリカのさまざまな地域で記録されている[1]。
分類
[編集]ティラピアレイクウイルスは一本鎖マイナス鎖RNAウイルスであり[3]、ボルティモア分類体系では第V群に属する。
構造
[編集]電子顕微鏡解析により、ティラピアレイクウイルスはエンベロープを持つ直径55–100 nmの正二十面体型粒子であることが明らかにされている[1]。ウイルス構造に関するそれ以上の情報は得られていないが、TiLVはオルソミクソ様ウイルスとして記載されており[4]、表面の糖タンパク質やらせん形のヌクレオカプシドなど、他の球形オルソミクソウイルスと同様の構造的特徴を持っている可能性がある[5]。
ゲノム
[編集]RNAゲノムは10個の断片に分節化されており、それぞれのオープンリーディングフレーム(ORF)に10種類のタンパク質がコードされている[6]。ゲノムの全長は10.323 kbであり、10個の断片の長さは465から1,641ヌクレオチドである[4]。その中で最大の断片はC型インフルエンザウイルスのPB1サブユニットとの相同性がわずかにみられる。残りの9つの断片には既知の他のウイルスとの相同性はみられないが、ゲノム構成は他のオルソミクソウイルスと共通している[3]。世界中のさまざまなティラピア集団由来のTiLVの比較ゲノム解析からは、ゲノム断片には地理的影響を受けた遺伝的多様性がみられることが指摘されている[7]。TiLVの全ての断片の5'末端と3'末端のノンコーディング領域には共通した13ヌクレオチドが存在し、この特徴は他のオルソミクソウイルスであるイサウイルスやトゴトウイルスと類似している[4]。
複製サイクル
[編集]接着と進入
[編集]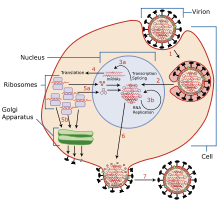
TiLV特異的な複製サイクルに関する情報は限られているが、オルソミクソウイルス科と関連があることが知られている。典型的なオルソミクソウイルス科のウイルスの表面にはいくつかの糖タンパク質が存在し、標的細胞膜のシアル酸受容体を認識して結合する[8]。標的細胞は受容体依存性エンドサイトーシスによってウイルスを細胞内へ輸送し、エンドソームの酸性化を開始する[9]。この酸性化はウイルス糖タンパク質のコンフォメーション変化を引き起こし、ウイルスエンベロープとエンドソーム膜との融合が開始される。膜融合が完了すると、ウイルスゲノム、補助タンパク質、RNA依存性RNAポリメラーゼが宿主細胞の細胞質に放出される[9]。
複製と転写
[編集]TiLVゲノムの転写は核内で行われることがin situハイブリダイゼーションによって明らかにされており、このことはオルソミクソウイルスと共通している[4]。オルソミクソウイルスのヌクレオカプシドは核へ輸送され、そこでウイルス酵素による転写が行われてウイルスmRNAが産生される[10]。キャップ配列は転写時に宿主細胞のmRNAから取られ(キャップスナッチング)、ウイルスmRNAに結合する。その結果、ウイルスRNAは核外へ移行できるようになり、細胞質へ戻って宿主のリボソームによってタンパク質へ翻訳される[10]。TiLVの5'末端と3'末端のノンコーディング領域には類似した13ヌクレオチドが存在し、二次構造を形成することで塩基対形成、複製、転写、ウイルスRNAの詰め込みを可能にしている[11]。さらに、TiLVのゲノム断片の全ての5'末端には短い(3–5塩基)ウリジン配列が存在する。この短い配列はオルソミクソウイルスの多くに存在する5–7塩基のウリジン配列と類似しており、この部位でウイルスのポリメラーゼがスタッタリングを起こすことでポリ(A)テールが付加される[4]。
組み立てと放出
[編集]オルソミクソウイルスの糖タンパク質は細胞膜へ移行し、そこでウイルスRNAを宿主細胞外へ輸送するため球形の出芽部を形成する。出芽部は宿主の因子の助けも借りながら閉じられ、ウイルス由来の物質は宿主細胞を去る[12]。
宿主との相互作用
[編集]培養細胞においては、感染した細胞は大きな細胞変性効果(CPE)を示し、細胞に構造的変化が生じる[3]。明確かつ急速なCPEはE-11細胞株で主にみられ、脳や肝臓由来の細胞株はTiLVの伝播の許容性が極めて高いことが示されている[1][3]。感染症例ではシンシチウムの形成が記載されており、隣接する感染細胞が融合して多核細胞が形成される。この種のシンシチウムは膨潤したミトコンドリアによって特徴づけられる[7]。感染したティラピアの肝細胞は膨潤し解離しており[7]、自然感染または実験的に感染させた魚類の脾臓と肝臓の双方で黄色から褐色の色素(MMC)の蓄積が細胞質にみられる[3]。さらに実験的感染例では、浮腫、くも膜や軟膜の限局性出血、白質と灰白質の双方で毛細血管のうっ血など、脳の組織病変が観察されている[3]。
TiLVの実験的感染で観察される組織病変は、自然界でのアウトブレイクで観察されるものと類似している[3]。自然界でのアウトブレイクは、不活発(lethargy)、変色、眼の異常、皮膚の斑点、消化管の潰瘍によって特徴づけられる[3]。病変が観察される主な器官は、脳、眼、肝臓である。感染した魚では、角膜の混濁や眼球の突出、脱鱗や立鱗、変色、出血などの皮膚のびらん、腹部の膨満といった肉眼的病変が観察される[3][11]。現時点ではTiLVに対するワクチンは存在せず、致死率は80%以上である[3]。
トロピズム
[編集]TiLVの病理は主に眼、脳、肝臓の組織に影響を及ぼすことが知られている[3]。一部の研究では、TiLVは筋肉の結合組織、腎臓、脾臓、心臓への指向性を示す可能性もあることが示唆されている[7]。ウイルスのトロピズムは地理的位置によって規定されているようである。イスラエルのティラピアに関する実験室的研究では、不活発、眼の病変、皮膚のびらんが野生と養殖の双方で記載されており、変色も養殖ティラピアに広くみられるTiLVの徴候である[3]。エジプトの一部の養魚場のTiLV感染魚では出血斑、脱鱗、開放創、変色、鰭の腐敗が観察されているが、その一部はエロモナスが共感染したものである[13]。エクアドルで観察されたティラピアも変色がみられ、さらに眼球突出、腹部の膨満、立鱗、鰓色蒼白化がみられる[14]。ペルーのティラピアでは眼球突出と潰瘍が伴っている[15]。タイでは、皮膚のうっ血、びらん、変色、異常行動、不活発、食欲不振、蒼白化、貧血、眼球突出、腹部膨満が症状として観察されている[6][7]。インドでは、自然感染したティラピアでは皮膚のびらんと脱鱗がみられ、実験室条件下で感染させた魚では眼球突出、腹部膨満、立鱗の症状を示す[16]。フィリピンのTiLV症例では、腹部膨満と眼球突出が記載されている[17]。
関係する疾患
[編集]TiLVと養殖魚類の他のウイルス性疾患との関係についてはほとんど知られていないが、伝染性サケ貧血ウイルス、伝染性造血器壊死症ウイルス、ウイルス性出血性敗血症ウイルスは養殖魚類の疾患や死の一般的な要因となっている[6]。伝染性サケ貧血ウイルス、インフルエンザウイルス、トゴトウイルスは、転写を可能にする塩基対形成を行うヌクレオチド配列の構成から、TiLVと同様の複製機構を有すると考えられている[4]。ティラピアに限定すると、ティラピアイリドウイルスが深刻な疾患や大量死の原因となることが知られている唯一の重要なウイルス性病原体である[18]。ティラピアのウイルス性疾患の原因となる他の病原体には、ベータノダウイルスやヘルペス様ウイルスがある[6]。
伝播と防除
[編集]ウイルスは生きた病魚との同居や導入による直接的な水平伝播によって伝染することが知られており、ウイルスは新鮮なティラピアや保存されたティラピアからも検出される[19][20]。水産物と関係したTiLVの生物物理学的性質やリスクに関する情報は限定的であるが、TiLVは眼、脳、肝臓に最も高濃度で存在し、そのため固体や液体の排泄物も汚染されている可能性が高いことが研究から示唆されている[19]。現在のところ、垂直伝播の証拠は得られていない[19]。
養殖場や漁場間での生きたティラピアの移動の制限、そして衛生慣行の維持や用具の消毒は、新たな種へのウイルス疾患の拡大を防ぐと考えられている。感染が発覚した養魚場内でウイルスの拡大を防ぐ方法に関するエビデンスは、現在のところ得られていない[19]。
重要性
[編集]TiLVの拡大は、商業的にも生態学的にも世界規模で影響を与えている。世界中でのティラピアの取引は年間約450万トン、75億ドルの規模であり、大きな経済的影響を及ぼしている[4]。ティラピア産業はアメリカ合衆国を主要な輸入国として、中国、エジプト、タイ、フィリピン、インドネシア、ラオス、コスタリカ、コロンビア、エクアドル、ホンジュラスで多くの雇用を抱えている[4]。また、ティラピアは藻類、蚊や一般的な生息地環境の管理に有用であり、生態系にとっても非常に重要である[4]。
出典
[編集]- ^ a b c d “Tilapia lake virus: a threat to the global tilapia industry?”. Reviews in Aquaculture. (2018). doi:10.1111/raq.12254.
- ^ “Virus Taxonomy: 2018b Release” (英語). International Committee on Taxonomy of Viruses (ICTV) (February 2019). 14 March 2019閲覧。
- ^ a b c d e f g h i j k l m “Identification of a novel RNA virus lethal to tilapia”. Journal of Clinical Microbiology 52 (12): 4137–46. (December 2014). doi:10.1128/JCM.00827-14. PMC 4313277. PMID 25232154.
- ^ a b c d e f g h i “Characterization of a Novel Orthomyxo-like Virus Causing Mass Die-Offs of Tilapia”. mBio 7 (2): e00431-16. (April 2016). doi:10.1128/mBio.00431-16. PMC 4959514. PMID 27048802.
- ^ “Medical Definition of ORTHOMYXOVIRIDAE” (英語). www.merriam-webster.com. 2019年3月12日閲覧。
- ^ a b c d “Outbreaks of Tilapia Lake Virus Infection, Thailand, 2015–2016”. Emerging Infectious Diseases 23 (6): 1031–1033. (June 2017). doi:10.3201/eid2306.161278. PMC 5443430. PMID 28518020.
- ^ a b c d e “Emergence of tilapia lake virus in Thailand and an alternative semi-nested RT-PCR for detection.”. Aquaculture 476: 111–8. (July 2017). doi:10.1016/j.aquaculture.2017.04.019.
- ^ “Functional balance between haemagglutinin and neuraminidase in influenza virus infections”. Reviews in Medical Virology 12 (3): 159–66. (May 2002). doi:10.1002/rmv.352. PMID 11987141.
- ^ a b “Chapter 7 - Viruses as Pathogens: Animal Viruses, With Emphasis on Human Viruses”. Viruses: Molecular Biology, Host Interactions and Applications to Biotechnology. Academic Press. (2018). pp. 157–187. doi:10.1016/B978-0-12-811257-1.00007-3. ISBN 9780128112571
- ^ a b Orthomyxoviruses (4th ed.). University of Texas Medical Branch at Galveston. (1996). ISBN 9780963117212. PMID 21413353 2019年3月13日閲覧。
- ^ a b Fenwick, Brad, ed (March 2017). “Detection of Tilapia Lake Virus in Clinical Samples by Culturing and Nested Reverse Transcription-PCR”. Journal of Clinical Microbiology 55 (3): 759–767. doi:10.1128/JCM.01808-16. PMC 5328443. PMID 27974544.
- ^ “Assembly and budding of influenza virus”. Virus Research 106 (2): 147–65. (December 2004). doi:10.1016/j.virusres.2004.08.012. PMC 7172797. PMID 15567494.
- ^ “Detection of Tilapia Lake Virus in Egyptian fish farms experiencing high mortalities in 2015”. Journal of Fish Diseases 40 (12): 1925–1928. (December 2017). doi:10.1111/jfd.12650. PMID 28590067.
- ^ “Syncytial hepatitis of farmed tilapia, Oreochromis niloticus (L.): a case report”. Journal of Fish Diseases 37 (6): 583–9. (June 2014). doi:10.1111/jfd.12142. PMID 23802941.
- ^ “Tilapia lake virus, Peru”. www.oie.int. 2019年3月12日閲覧。
- ^ “Emergence of tilapia lake virus associated with mortalities of farmed Nile tilapia Oreochromis niloticus (Linnaeus 1758) in India.”. Aquaculture 484: 168–74. (February 2018). doi:10.1016/j.aquaculture.2017.11.025.
- ^ “Tilapia Lake Virus (TiLV), Philippines”. www.oie.int. 2019年3月12日閲覧。
- ^ “Tilapia Diseases” (英語). AmeriCulture, Inc. 2019年3月13日閲覧。
- ^ a b c d “Tilapia lake virus (TiLV)—a novel orthomyxo-like virus”. World Organisation for Animal Health (OIE) (February 2018). 12 March 2019閲覧。
- ^ Fenwick, Brad, ed (March 2017). “Detection of Tilapia Lake Virus in Clinical Samples by Culturing and Nested Reverse Transcription-PCR”. Journal of Clinical Microbiology 55 (3): 759–767. doi:10.1128/JCM.01808-16. PMC 5328443. PMID 27974544.
