MLH1
MLH1(MutL homolog 1)は、ヒトでは3番染色体に位置するMLH1遺伝子によってコードされるタンパク質である。一般的に、遺伝性非ポリポーシス大腸がんと関係している。MLH1はマウスや出芽酵母Saccharomyces cerevisiaeなど、他の生物でも研究が行われている。
機能[編集]
MLH1遺伝子は、遺伝性非ポリポーシス大腸がんにおいて高頻度で変異がみられる遺伝子座として同定された[4]。大腸菌Escherichia coliのDNAミスマッチ修復遺伝子であるmutLのヒトホモログである。MutLはミスマッチの認識、鎖の識別、鎖の除去の際のタンパク質間相互作用を媒介する。MLH1の欠陥は、遺伝性非ポリポーシス大腸がんでみられるマイクロサテライト不安定性と関係している[5]。
DNAミスマッチ修復における役割[編集]
MLH1タンパク質は、DNAのミスマッチの修復を開始する一連の段階において協調的に機能する、ヒトでは7つのDNAミスマッチ修復タンパク質の1つである[6]。ミスマッチ修復の欠陥は大腸がんの約13%でみられるが、他のDNAミスマッチ修復タンパク質の欠乏よりもMLH1の欠乏によるものがはるかに高頻度でみられる[7]。ヒトの7つのミスマッチ修復タンパク質は、MLH1、MLH3、MSH2、MSH3、MSH6、PMS1、PMS2である[6]。さらに、EXO1依存的、EXO1非依存的なDNAミスマッチ修復のサブ経路が存在する[8]。
DNAのミスマッチは、ある塩基が他の塩基と不適切に対合した部位、または一方の鎖への短い付加や欠失のために他方の鎖とマッチしない部位で生じる。ミスマッチは多くの場合、DNA複製時のエラーまたは遺伝的組換えの結果生じたものである。こうしたミスマッチの認識と修復は重要であり、正しく行われない場合はマイクロサテライト不安定性や自発的な変異率の上昇(mutator phenotype)が生じる。
MSH2とMSH6のヘテロ二量体がまずミスマッチを認識するが、MSH2とMSH3のヘテロ二量体もこの過程を開始することができる。MSH2-MSH6ヘテロ二量体にMLH1とPMS2からなるヘテロ二量体が結合するが、MLH1とPMS3またはMLH3からなるヘテロ二量体もこれに置き換わることができる。この2組のヘテロ二量体からなるタンパク質複合体がミスマッチの修復の開始を可能にする[6]。
DNAミスマッチ修復タンパク質による開始過程に続いて、DNAポリメラーゼδ、PCNA、RPA、HMGB1、RFC、DNAリガーゼI、さらにはヒストンやクロマチン修飾因子がミスマッチ修復に関与する[9][10]。
がんにおける発現の欠乏[編集]
| がんの種類 | 欠乏の頻度 | 周囲の発がん素地での欠乏の頻度 |
|---|---|---|
| 胃がん | 32%[11][12] | 24%-28% |
| 胃がん(腺窩上皮型) | 74%[13] | 71% |
| カシミール渓谷でみられる高発生率の胃がん | 73%[14] | 20% |
| 食道がん | 73%[15] | 27% |
| 頭頚部扁平上皮がん(HNSCC) | 31%-33%[16][17] | 20%-25% |
| 非小細胞性肺がん(NSCLC) | 69%[18] | 72% |
| 大腸がん | 10%[7] |
エピジェネティックな抑制[編集]
DNA修復不全がみられる散発性がんのうち、DNA修復遺伝子に変異が存在するものはわずかである。DNA修復不全がみられる散発性がんの大部分では、DNA修復遺伝子の発現の低下やサイレンシングを引き起こすエピジェネティックな変化が存在している[19]。上の表に記したようなMLH1の欠乏の大部分は、MLH1遺伝子のプロモーター領域のメチル化によるものである。MLH1の発現を低下させる他のエピジェネティックな機構としては、miR-155の過剰発現によるものである[20]。miR-155の標的はMLH1とMSH2であり、ヒトの大腸がんではmiR-155の発現とMLH1やMSH2の発現との間には逆相関がみられる[20]。
発がん素地における欠乏[編集]
発がん素地(field defect)とは、エピジェネティックな変化または変異によってがんが発生しやすい状態となっている領域のことである。Rubinによって指摘されている通り、がん研究の大部分はin vivoでの明確な腫瘍またはin vitroで分離された腫瘍性病巣に対して行われている[21]。しかし、mutator phenotypeを有するヒト大腸がんでみられる体細胞変異の80%以上は、最終的なクローン増殖の開始以前に生じたものである証拠が存在する[22]。同様に、Vogelsteinらは腫瘍で同定された体細胞変異の半数以上は、前腫瘍段階(発がん素地)において、外観上は正常な細胞の増殖時に生じたものであることを指摘している[23]。
上の表に記されているように、MLH1の欠乏は腫瘍の周囲の発がん素地(組織学的には正常な組織)でもみられる。MLH1のエピジェネティックな発現低下やサイレンシングが行われていても、幹細胞に選択的な利点が生じる可能性は低い。しかし、MLH1の発現の低下や欠如は変異発生率の増加を引き起こし、変異した遺伝子によって選択的利点がもたらされる可能性がある。変異した幹細胞のクローン増殖が引き起こされた際、MLH1遺伝子は選択的に中立またはわずかに有害なパッセンジャー(ヒッチハイカー)変異として保持される。エピジェネティックに抑制されたMLH1遺伝子を持つクローンが存在し続けることでさらなる変異が生み出され続け、その一部から腫瘍が形成される可能性がある。
他のDNA修復遺伝子との協調的な抑制[編集]
がんでは、複数のDNA修復遺伝子が同時に抑制されていることが多い[19]。一例として、40の星細胞腫と非患者の正常な脳組織で27のDNA修復遺伝子のmRNAの発現の比較では、評価された27のDNA修復遺伝子のうち13の遺伝子、MLH1、MLH3、MGMT、NTHL1、OGG1、SMUG1、ERCC1、ERCC2、ERCC3、ERCC4、RAD50、XRCC4、XRCC5はすべて、星細胞腫の3つのグレード(II、III、IV)のすべてで大きくダウンレギュレーションされていた[24]。これら13の遺伝子が低いグレードでも高いグレードでも同様に抑制されていることは、これらの抑制が星細胞腫の初期でも後期でも重要である可能性を示唆している。他の研究では、135の胃がん試料においてMLH1とMGMTの発現は密接に相関しており、MLH1とMGMTの喪失は腫瘍の進行時に同調的に加速しているようである[25]。
減数分裂[編集]
DNAミスマッチ修復に加えて、MLH1タンパク質は減数分裂時の乗換えにも関与している[26]。MLH1はMLH3とヘテロ二量体を形成し、この複合体は卵母細胞の減数第二分裂中期の進行に必要であるようである[27]。メスとオスのMLH1(-/-)変異体マウスは不妊であり、不妊はキアズマのレベルの低下と関係している[26][28]。MLH1(-/-)変異体マウスの精子形成過程では染色体は通常より早く分離することが多く、減数第一分裂での停止が頻繁にみられる[26]。ヒトでは、MLH1遺伝子の一般的な変異は精子の損傷と男性不妊のリスクの上昇と関係している[29]。
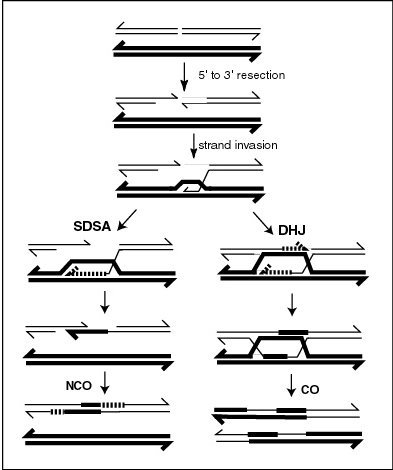
MLH1タンパク質は、減数分裂中の染色体の乗換え部位に局在するようである[26]。減数分裂時の組換えはDNAの二本鎖切断によって開始されることが多い。組換え時には、切断部のDNAの5'末端はresectionと呼ばれる過程で除去される。その後のstrand invasionの過程では、オーバーハングした3'末端は相同染色体のDNAに「侵入」し、Dループが形成される。その後2つの主要な過程のいずれかが起こり、乗換え型または非乗換え型の組換えが行われる(相同組換えを参照)。乗換え型の組換えはダブルホリデイジャンクション中間体の形成を伴う。乗換え型の組換えの完了にはホリデイジャンクションの解消が必要である。
出芽酵母では、マウスと同様、MLH1はMLH3とヘテロ二量体を形成する。減数分裂時の乗換えは、MLH1-MLH3ヘテロ二量体の作用によるホリデイジャンクションの解消が必要である。MLH1-MLH3ヘテロ二量体はエンドヌクレアーゼであり、スーパーコイルを形成した二本鎖DNAに一本鎖切断を形成する[30][31]。MLH1-MLH3はホリデイジャンクションに特異的に結合し、減数分裂時にホリデイジャンクションのプロセシングを行う巨大複合体の一部として作用している可能性がある[30]。MLH1-MLH3ヘテロ二量体(MutLγ)はEXO1、Sgs1(BLMのオルソログ)とともに解消過程を構成し、出芽酵母で乗換えの大部分を形成しする。哺乳類でも同様に機能すると考えられている[32]。
臨床的意義[編集]
相互作用[編集]
MLH1は次に挙げる因子と相互作用することが示されている。
出典[編集]
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000032498 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Entrez Gene: MLH1 mutL homolog 1, colon cancer, nonpolyposis type 2 (E. coli)”. 2020年10月18日閲覧。
- ^ Nikiforova, Marina N.; Nikiforov, Yuri E. (2011) (英語). Diagnostic Immunohistochemistry. Elsevier. pp. 42–57. doi:10.1016/b978-1-4160-5766-6.00006-6. ISBN 978-1-4160-5766-6
- ^ a b c “A review of the clinical relevance of mismatch-repair deficiency in ovarian cancer”. Cancer 113 (4): 733–42. (2008). doi:10.1002/cncr.23601. PMC 2644411. PMID 18543306.
- ^ a b “Immunohistochemical analysis reveals high frequency of PMS2 defects in colorectal cancer”. Gastroenterology 128 (5): 1160–71. (2005). doi:10.1053/j.gastro.2005.01.056. PMID 15887099.
- ^ “Exonuclease 1-dependent and independent mismatch repair”. DNA Repair (Amst.) 32: 24–32. (2015). doi:10.1016/j.dnarep.2015.04.010. PMC 4522362. PMID 25956862.
- ^ “Mechanisms and functions of DNA mismatch repair”. Cell Res. 18 (1): 85–98. (2008). doi:10.1038/cr.2007.115. PMID 18157157.
- ^ “New insights and challenges in mismatch repair: getting over the chromatin hurdle”. DNA Repair (Amst.) 19: 48–54. (2014). doi:10.1016/j.dnarep.2014.03.027. PMC 4127414. PMID 24767944.
- ^ “CpG island methylation of the MLH1, MGMT, DAPK, and CASP8 genes in cancerous and adjacent noncancerous stomach tissues”. Medicina (Kaunas) 49 (8): 361–6. (2013). PMID 24509146.
- ^ “Promoter methylation status of E-cadherin, hMLH1, and p16 genes in nonneoplastic gastric epithelia”. Am. J. Pathol. 161 (2): 399–403. (2002). doi:10.1016/S0002-9440(10)64195-8. PMC 1850716. PMID 12163364.
- ^ “Frequent hypermethylation of the hMLH1 gene promoter in differentiated-type tumors of the stomach with the gastric foveolar phenotype”. Am. J. Pathol. 157 (3): 717–22. (2000). doi:10.1016/S0002-9440(10)64584-1. PMC 1949419. PMID 10980110.
- ^ “Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley”. Asian Pac. J. Cancer Prev. 13 (8): 4177–81. (2012). doi:10.7314/apjcp.2012.13.8.4177. PMID 23098428.
- ^ “Expression characteristics of FHIT, p53, BRCA2 and MLH1 in families with a history of oesophageal cancer in a region with a high incidence of oesophageal cancer”. Oncol Lett 9 (1): 430–436. (2015). doi:10.3892/ol.2014.2682. PMC 4246613. PMID 25436004.
- ^ “Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene”. Am J Otolaryngol 32 (6): 528–36. (2011). doi:10.1016/j.amjoto.2010.11.005. PMID 21353335.
- ^ “Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma”. Otolaryngol Head Neck Surg 141 (4): 484–90. (2009). doi:10.1016/j.otohns.2009.07.007. PMID 19786217.
- ^ “Methylation profiling of archived non-small cell lung cancer: a promising prognostic system”. Clin. Cancer Res. 11 (12): 4400–5. (2005). doi:10.1158/1078-0432.CCR-04-2378. PMID 15958624.
- ^ a b “Epigenetic reduction of DNA repair in progression to gastrointestinal cancer”. World J Gastrointest Oncol 7 (5): 30–46. (2015). doi:10.4251/wjgo.v7.i5.30. PMC 4434036. PMID 25987950.
- ^ a b “Modulation of mismatch repair and genomic stability by miR-155”. Proc. Natl. Acad. Sci. U.S.A. 107 (15): 6982–7. (2010). Bibcode: 2010PNAS..107.6982V. doi:10.1073/pnas.1002472107. PMC 2872463. PMID 20351277.
- ^ Rubin H (March 2011). “Fields and field cancerization: the preneoplastic origins of cancer: asymptomatic hyperplastic fields are precursors of neoplasia, and their progression to tumors can be tracked by saturation density in culture”. BioEssays 33 (3): 224–31. doi:10.1002/bies.201000067. PMID 21254148.
- ^ “Genetic reconstruction of individual colorectal tumor histories”. Proc. Natl. Acad. Sci. U.S.A. 97 (3): 1236–41. (February 2000). Bibcode: 2000PNAS...97.1236T. doi:10.1073/pnas.97.3.1236. PMC 15581. PMID 10655514.
- ^ “Cancer genome landscapes”. Science 339 (6127): 1546–58. (March 2013). Bibcode: 2013Sci...339.1546V. doi:10.1126/science.1235122. PMC 3749880. PMID 23539594.
- ^ “Expression analyses of 27 DNA repair genes in astrocytoma by TaqMan low-density array”. Neurosci. Lett. 409 (2): 112–7. (2006). doi:10.1016/j.neulet.2006.09.038. PMID 17034947.
- ^ “Loss of expression of DNA repair enzymes MGMT, hMLH1, and hMSH2 during tumor progression in gastric cancer”. Gastric Cancer 6 (2): 86–95. (2003). doi:10.1007/s10120-003-0213-z. PMID 12861399.
- ^ a b c d “Involvement of mouse Mlh1 in DNA mismatch repair and meiotic crossing over”. Nat. Genet. 13 (3): 336–42. (1996). doi:10.1038/ng0796-336. PMID 8673133.
- ^ “Comparative analysis of meiotic progression in female mice bearing mutations in genes of the DNA mismatch repair pathway”. Biol. Reprod. 78 (3): 462–71. (2008). doi:10.1095/biolreprod.107.065771. PMID 18057311.
- ^ “Mouse models for human DNA mismatch-repair gene defects”. Trends Mol Med 8 (7): 346–53. (2002). doi:10.1016/s1471-4914(02)02359-6. PMID 12114115.
- ^ “Common variants in mismatch repair genes associated with increased risk of sperm DNA damage and male infertility”. BMC Med 10: 49. (2012). doi:10.1186/1741-7015-10-49. PMC 3378460. PMID 22594646.
- ^ a b “The Saccharomyces cerevisiae Mlh1-Mlh3 heterodimer is an endonuclease that preferentially binds to Holliday junctions”. J. Biol. Chem. 289 (9): 5674–86. (2014). doi:10.1074/jbc.M113.533810. PMC 3937642. PMID 24443562.
- ^ “Mlh1-Mlh3, a meiotic crossover and DNA mismatch repair factor, is a Msh2-Msh3-stimulated endonuclease”. J. Biol. Chem. 289 (9): 5664–73. (2014). doi:10.1074/jbc.M113.534644. PMC 3937641. PMID 24403070.
- ^ “Delineation of joint molecule resolution pathways in meiosis identifies a crossover-specific resolvase”. Cell 149 (2): 334–47. (2012). doi:10.1016/j.cell.2012.03.023. PMC 3377385. PMID 22500800.
- ^ “Turcot syndrome confirmed with molecular analysis”. Eur. J. Neurol. 14 (4): 470–2. (2007). doi:10.1111/j.1468-1331.2006.01669.x. PMID 17389002.
- ^ “BASC, a super complex of BRCA1-associated proteins involved in the recognition and repair of aberrant DNA structures”. Genes Dev. 14 (8): 927–39. (April 2000). doi:10.1101/gad.14.8.927. PMC 316544. PMID 10783165.
- ^ “The Bloom's syndrome protein (BLM) interacts with MLH1 but is not required for DNA mismatch repair”. J. Biol. Chem. 276 (32): 30031–5. (August 2001). doi:10.1074/jbc.M009664200. PMID 11325959.
- ^ “Cleavage of the Bloom's syndrome gene product during apoptosis by caspase-3 results in an impaired interaction with topoisomerase IIIalpha”. Nucleic Acids Res. 29 (15): 3172–80. (August 2001). doi:10.1093/nar/29.15.3172. PMC 55826. PMID 11470874.
- ^ “Direct association of Bloom's syndrome gene product with the human mismatch repair protein MLH1”. Nucleic Acids Res. 29 (21): 4378–86. (November 2001). doi:10.1093/nar/29.21.4378. PMC 60193. PMID 11691925.
- ^ “The interaction of DNA mismatch repair proteins with human exonuclease I”. J. Biol. Chem. 276 (35): 33011–8. (August 2001). doi:10.1074/jbc.M102670200. PMID 11427529.
- ^ “MED1, a novel human methyl-CpG-binding endonuclease, interacts with DNA mismatch repair protein MLH1”. Proc. Natl. Acad. Sci. U.S.A. 96 (7): 3969–74. (March 1999). Bibcode: 1999PNAS...96.3969B. doi:10.1073/pnas.96.7.3969. PMC 22404. PMID 10097147.
- ^ “MSH4 acts in conjunction with MLH1 during mammalian meiosis”. FASEB J. 14 (11): 1539–47. (August 2000). doi:10.1096/fj.14.11.1539. PMID 10928988.
- ^ a b “Interactions of the DNA mismatch repair proteins MLH1 and MSH2 with c-MYC and MAX”. Oncogene 22 (6): 819–25. (February 2003). doi:10.1038/sj.onc.1206252. PMID 12584560.
- ^ “The interacting domains of three MutL heterodimers in man: hMLH1 interacts with 36 homologous amino acid residues within hMLH3, hPMS1 and hPMS2”. Nucleic Acids Res. 29 (8): 1695–702. (April 2001). doi:10.1093/nar/29.8.1695. PMC 31313. PMID 11292842.
- ^ “The interaction of the human MutL homologues in hereditary nonpolyposis colon cancer”. J. Biol. Chem. 274 (10): 6336–41. (March 1999). doi:10.1074/jbc.274.10.6336. PMID 10037723.
関連文献[編集]
- “Clinicopathological relevance of the association between gastrointestinal and sebaceous neoplasms: the Muir-Torre syndrome.”. Hum. Pathol. 26 (4): 422–7. (1995). doi:10.1016/0046-8177(95)90144-2. PMID 7705822.
- “Mismatch repair: mechanisms and relationship to cancer susceptibility.”. Trends Biochem. Sci. 20 (10): 397–401. (1996). doi:10.1016/S0968-0004(00)89087-8. PMID 8533151.
- Mutations predisposing to hereditary nonpolyposis colorectal cancer. Advances in Cancer Research. 71. (1997). 93–119. doi:10.1016/S0065-230X(08)60097-4. ISBN 9780120066711. PMID 9111864
- “Molecular basis of HNPCC: mutations of MMR genes.”. Hum. Mutat. 10 (2): 89–99. (1997). doi:10.1002/(SICI)1098-1004(1997)10:2<89::AID-HUMU1>3.0.CO;2-H. PMID 9259192.
- “Colorectal cancer prevention.”. Current Problems in Cancer 28 (5): 240–64. (2004). doi:10.1016/j.currproblcancer.2004.05.004. PMID 15375803.
- “The role of chemotherapy in microsatellite unstable (MSI-H) colorectal cancer.”. International Journal of Colorectal Disease 22 (7): 739–48. (2007). doi:10.1007/s00384-006-0228-0. PMID 17109103.
- “Microsatellite instability and MLH1 promoter hypermethylation in colorectal cancer”. World J. Gastroenterol. 13 (12): 1767–9. (2007). doi:10.3748/wjg.v13.i12.1767. PMC 4149951. PMID 17465465.
外部リンク[編集]
- FAQs on HNPCC from the National Institute of Health
- GeneReviews/NCBI/NIH/UW entry on Lynch syndrome
- MLH1 protein, human - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)



