檜山カップリング
| 檜山カップリング | |
|---|---|
| 名の由来 | 檜山爲次郎 |
| 種類 | カップリング反応 |
| 識別情報 | |
| Organic Chemistry Portal | hiyama-coupling |
| RSC ontology ID | RXNO:0000193 |
檜山カップリング(ひやまカップリング)とは、パラジウム触媒を用いる、有機ケイ素化合物と有機ハロゲン化合物とのクロスカップリング反応である。1988年に、相模中央化学研究所の檜山爲次郎(現・中央大学教授[1])と畠中康夫(現・大阪市立大学教授[2])によって報告された反応であり[3]、化学選択的かつ位置選択的に炭素-炭素結合を形成することができる。様々な天然物合成に広く応用されている反応である[4] 。
背景
[編集]従来用いられてきた有機金属試薬を用いたクロスカップリング反応に代わるものとして開発された。当初、有機ケイ素試薬は反応性があまり高くないものであるとされてきたが、檜山はフッ化物イオン源を加えて活性化させると、十分な反応性を得ることを発見した[5][6]。この反応性により、パラジウム錯体を用いた際、有機ハロゲン化合物のような求電子性を持つ炭素と反応して炭素‐炭素結合を形成する。
従来カップリング反応に用いられてきた、有機マグネシウム化合物(グリニャール試薬)や有機銅化合物などの有機金属試薬は、反応性が高すぎるために化学選択性や官能基耐性が低いという欠点がある。他の有機金属試薬である有機スズ化合物、有機亜鉛化合物あるいは有機ホウ素化合物は比較的反応性は高くなく、これらを用いればこの問題点は解決される。しかし、有機亜鉛化合物は湿気に敏感、有機スズ化合物は猛毒であり、有機ホウ素化合物は高価であり安定性が低いという問題点がある。
これらと比較して、有機ケイ素化合物は簡単かつ安価で合成でき、安定であり毒性は低く、かつフッ化物イオン源やルイス塩基で活性化すれば有機スズ化合物や有機ホウ素化合物と同等の反応性が得られるため、利用する価値は大きい。活性化された有機ケイ素化合物は、化学選択的かつ位置選択的に有機ハロゲン化合物と反応して炭素‐炭素結合を形成する[3]。
反応機構
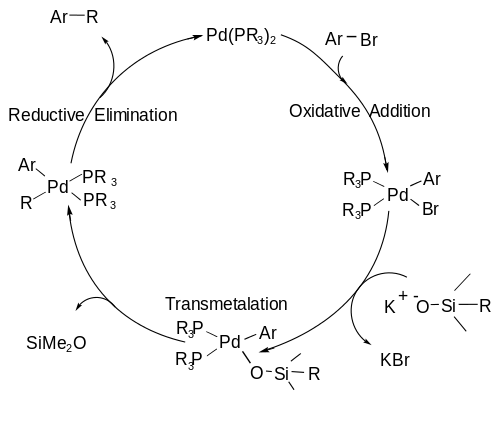
[編集]有機ケイ素試薬は、フッ化物イオン源(TBAFやTASFのような塩)やルイス塩基による求核攻撃を受け、ケイ素の5配位構造となる。この構造は比較的不安定であり、トランスメタル化の際、炭素‐ケイ素結合が開裂する[7]。この、ケイ素の5配位構造をもつ重要な中間体を以下に示す。こちらの中間体の生成はin situで進行し、同時に触媒サイクルが進行する。

触媒サイクルを以下に示す。まず、酸化的付加の段階(下図A)で、有機ハロゲン化合物がパラジウム錯体に付加し、パラジウムの酸化数が0価から2価に変化する。次に、トランスメタル化が起き(下図B)、炭素‐ケイ素結合が開裂し、パラジウム上に2つの炭素配位子が生成する。最後に、還元的脱離により(下図C)、炭素‐炭素結合が生成すると同時に、パラジウムの酸化数が0価に戻り触媒が再生する[8]。

応用
[編集]檜山カップリングはC(sp2)-C(sp3)結合形成だけでなく、C(sp2)-C(sp2)結合形成にも応用できる。ハロゲン化アリール、ハロゲン化ビニル、ハロゲン化アリルを用いた場合に高い収率で反応し、有機ヨウ素化合物を用いた場合に最高の収率を示す。
アメリカの有機化学者である、スコット・デンマークは、檜山カップリングを利用した閉環反応について報告した[9]。

有機ケイ素試薬の代替として、オルガノハロシランを利用した檜山カップリングも同様に開発されている。従来反応性が低かった、豊富に存在しかつ有機ヨウ素化合物より安価で手に入る塩化アリールは、オルガノクロロシランを利用することによりカップリング反応が進行する[10]。
アメリカの有機化学者であるグレゴリー・フーは、ニッケル触媒を用いると、オルガノフルオロシランを用いたカップリング反応において新たな反応性が見出されたことを報告した[11]。第二級ハロゲン化アルキルとのカップリング反応が高収率で進行したのである[12]。

問題点
[編集]檜山カップリングにおいて、有機ケイ素試薬の活性化のためにフッ化物イオン源を用いるが、これにより有機合成において頻繁に用いられるシリル系保護基(シリルエーテル等)をも脱保護してしまうため、適用できる基質が制限されることになる。また、フッ化物イオンは強い塩基性を持っているため、塩基に不安定な保護基や官能基をもつ基質には適用できない。つまり、檜山カップリングの最大の問題点は有機ケイ素試薬の活性化の段階にある。この問題を解決するため、活性化剤の検討や有機ケイ素化合物の検討などの試みがなされ、様々なバリエーションの檜山カップリングが報告されている。
バリエーション
[編集]シラシクロブタンを用いた檜山カップリング
[編集]スコット・デンマークにより、シラシクロブタン環を利用した檜山カップリングが報告されている。フッ化物イオン源にTBAFの3水和物を用いており、下の反応式に示したように、シラノールを経由したのち捕捉される。こちらの中間体をカップリング反応に利用することで、次のカップリング反応の際にフッ化物イオン源を用いなくてもよいという利点がある[13]。

フッ化物イオンを用いない檜山カップリング
[編集]フッ化物イオンの使用により基質適応性が低下するという欠点を克服するため、フッ化物イオンを用いない檜山カップリング反応が報告されている。檜山らはオルガノクロロシランを基質とした際に、水酸化ナトリウムのような塩基が活性化剤として働き、カップリング反応が進行することを見出した[14](下図参照)。また、基質をアルコキシシランに変更することにより、水酸化ナトリウムだけでなく[15]、水のような弱塩基でさえも反応が進行する[16]ことが報告されている。 これらの発見が、後に示す檜山・デンマークカップリング反応の開発へと繋がることになる。

他のフッ化物イオンを用いない檜山カップリング反応としては、ルイス酸添加による方法が挙げられる。この場合、塩基としてK3PO4を加える場合があるが[17]、塩基を添加しなくても反応が進行する例も報告されている[18][19] 。ルイス酸(Ag(I)[18] ,Cu(I)[19]等)を当量添加する場合もあるが、パラジウム触媒と同様のTONで触媒サイクルが進行する場合もある[17]。
檜山・デンマークカップリング
[編集]檜山・デンマークカップリング(Hiyama–Denmark coupling)とは、スコット・デンマークにより改良された檜山カップリングである。有機シラノールと有機ハロゲン化合物とのカップリング反応であり、フッ化物イオンを必要としない。反応式は以下に示す。ブレンステッド塩基が活性化剤として働き、またパラジウムにはホスフィン配位子が配位している[4]。

檜山・デンマークカップリング反応はフッ化物イオンを必要としないため、下に示したような、tert-ブチルジメチルシリル(TBS)基を持つ基質にも適用できる[20]。

檜山・デンマークカップリングの反応機構
[編集]触媒サイクルを以下に示す。当反応の反応機構において5配位のケイ素は必要とせず、速度論的分析によると、触媒サイクルの進行はパラジウムのシラノラート錯体(下図の最も下の位置において示された構造)の生成に依存している。これにより、トランスメタル化の際にPd-O結合が開裂し、2つの炭素配位子がパラジウムに配位する。その後、還元的脱離によりカップリング生成物を得る。Pd-O結合生成における段階が律速段階であり、シラノラート錯体の生成が当反応の重要なポイントとなる[4] 。
関連項目
[編集]脚注
[編集]- ^ member - 檜山研究室
- ^ 畠中 康夫 | 大阪市立大学研究者要覧
- ^ a b Hatanaka, Y.; Hiyama, T. (1988). “Cross-coupling of organosilanes with organic halides mediated by a palladium catalyst and tris(diethylamino)sulfonium difluorotrimethylsilicate”. Journal of Organic Chemistry 53 (4): 918–920. doi:10.1021/jo00239a056.
- ^ a b c Denmark, S. E.; Regens, C. S. (2008). “Palladium-Catalyzed Cross-Coupling Reactions of Organosilanols and Their Salts: Practical Alternatives to Boron- and Tin-Based Methods”. Accounts of Chemical Research 41 (11): 1486–1499. doi:10.1021/ar800037p.
- ^ Hiyama, T.; Obayashi, M.; Mori, I.; Nozaki, H. (1983), “Generation of metal-free silyl anions from disilanes and fluoride catalyst. Synthetic reactions with aldehydes and 1,3-dienes”, The Journal of Organic Chemistry 48: 912, doi:10.1021/jo00154a043
- ^ Fujita, M.; Hiyama, T. (1988), “Erythro-directive reduction of .alpha.-substituted alkanones by means of hydrosilanes in acidic media”, The Journal of Organic Chemistry 53: 5415, doi:10.1021/jo00258a004
- ^ Hiyama, T. (2002), “How I came across the silicon-based cross-coupling reaction”, Journal of Organometallic Chemistry 653: 58, doi:10.1016/s0022-328x(02)01157-9
- ^ Miyaura, N.; Suzuki, A. (1995), “Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds”, Chemical Reviews 95: 2457, doi:10.1021/cr00039a007
- ^ a b Denmark, S. E.; Yang, S.-M. (2002), “Intramolecular Silicon-Assisted Cross-Coupling Reactions: General Synthesis of Medium-Sized Rings Containing a 1,3-cis-cis Diene Unit”, Journal of the American Chemical Society 124: 2102, doi:10.1021/ja0178158
- ^ Gouda, K.-i.; Hagiwara, E.; Hatanaka, Y.; Hiyama, T. (1996), “Cross-Coupling Reactions of Aryl Chlorides with Organochlorosilanes: Highly Effective Methods for Arylation or Alkenylation of Aryl Chlorides”, The Journal of Organic Chemistry 61: 7232, doi:10.1021/jo9611172
- ^ Powell, D. A.; Fu, G. C. (2004), “Nickel-Catalyzed Cross-Couplings of Organosilicon Reagents with Unactivated Secondary Alkyl Bromides”, Journal of the American Chemical Society 126: 7788, doi:10.1021/ja047433c
- ^ Strotman, N. A.; Sommer, S.; Fu, G. C. (2007), “Hiyama Reactions of Activated and Unactivated Secondary Alkyl Halides Catalyzed by a Nickel/Norephedrine Complex”, Angewandte Chemie International Edition 46: 3556, doi:10.1002/anie.200700440
- ^ a b Denmark, S. E.; Wehrli, D.; Choi, J. Y. (2000), “Convergence of Mechanistic Pathways in the Palladium(0)-Catalyzed Cross-Coupling of Alkenylsilacyclobutanes and Alkenylsilanols”, Organic Letters 2: 2491, doi:10.1021/ol006170y
- ^ a b Hagiwara, E.; Gouda, K.-i.; Hatanaka, Y.; Hiyama, T. (1997), “NaOH-Promoted cross-coupling reactions of organosilicon compounds with organic halides: Practical routes to biaryls, alkenylarenes and conjugated dienes”, Tetrahedron Letters 38: 439, doi:10.1016/s0040-4039(96)02320-9
- ^ Shi, S.; Zhang, Y. (2007), “Pd(OAc)2-Catalyzed Fluoride-Free Cross-Coupling Reactions of Arylsiloxanes with Aryl Bromides in Aqueous Medium”, The Journal of Organic Chemistry 72: 5927, doi:10.1021/jo070855v
- ^ Wolf, C.; Lerebours, R. (2004), “Palladium−Phosphinous Acid-Catalyzed NaOH-Promoted Cross-Coupling Reactions of Arylsiloxanes with Aryl Chlorides and Bromides in Water”, Organic Letters 6: 1147, doi:10.1021/ol049851s
- ^ a b Nakao, Y.; Takeda, M.; Matsumoto, T.; Hiyama, T. (2010), “Cross-Coupling Reactions through the Intramolecular Activation of Alkyl(triorgano)silanes”, Angewandte Chemie 122: 4549, doi:10.1002/ange.201000816
- ^ a b Hirabayashi, K.; Mori, A.; Kawashima, J.; Suguro, M.; Nishihara, Y.; Hiyama, T. (2000), “Palladium-Catalyzed Cross-Coupling of Silanols, Silanediols, and Silanetriols Promoted by Silver(I) Oxide”, The Journal of Organic Chemistry 65: 5342, doi:10.1021/jo000679p
- ^ a b Nishihara, Y.; Ikegashira, K.; Hirabayashi, K.; Ando, J.-i.; Mori, A.; Hiyama, T. (2000), “Coupling Reactions of Alkynylsilanes Mediated by a Cu(I) Salt: Novel Syntheses of Conjugate Diynes and Disubstituted Ethynes”, The Journal of Organic Chemistry 65: 1780, doi:10.1021/jo991686k
- ^ a b Denmark, S. E.; Smith, R. C.; Chang, W.-T. T.; Muhuhi, J. M. (2009), “Cross-Coupling Reactions of Aromatic and Heteroaromatic Silanolates with Aromatic and Heteroaromatic Halides”, Journal of the American Chemical Society 131: 3104, doi:10.1021/ja8091449

![The General Scheme for the Hiyama Coupling {\displaystyle {\begin{matrix}{}\\{\ce {{R-SiR''_{3}}+R'-X->[\mathrm {F^{-}} ][{\text{Pd cat.}}]R-R'}}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45686837800f1a0e625c8ab13b8224dd6e26a10e)



