フルクトース-1,6-ビスホスファターゼ
| フルクトース-1,6-ビスホスファターゼ 1 | |
|---|---|
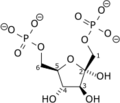
 フルクトース-1,6-ビスホスファターゼとフルクトース-2,6-ビスリン酸の複合体。PDB 3FBP. | |
| 識別子 | |
| 略号 | FBP1 |
| 他の略号 | FBP |
| Entrez | 2203 |
| HUGO | 3606 |
| OMIM | 229700 |
| RefSeq | NM_000507 |
| UniProt | P09467 |
| 他のデータ | |
| EC番号 (KEGG) | 3.1.3.11 |
| 遺伝子座 | Chr. 9 q22.3 |
| フルクトース-1,6-ビスホスファターゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
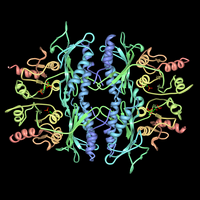
 ウサギ肝臓のフルクトース-1,6-ビスホスファターゼの結晶構造 | |||||||||
| 識別子 | |||||||||
| 略号 | FBPase | ||||||||
| Pfam | PF00316 | ||||||||
| Pfam clan | CL0171 | ||||||||
| InterPro | IPR000146 | ||||||||
| PROSITE | PDOC00114 | ||||||||
| SCOP | 1frp | ||||||||
| SUPERFAMILY | 1frp | ||||||||
| |||||||||
| フルクトース-1,6-ビスホスファターゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||
| 略号 | FBPase_2 | ||||||||
| Pfam | PF06874 | ||||||||
| Pfam clan | CL0163 | ||||||||
| InterPro | IPR009164 | ||||||||
| |||||||||
| フルクトース-1,6-ビスホスファターゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
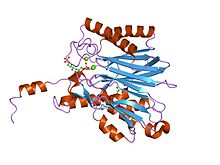 フルクトース-1,6-ビスホスファターゼの結晶構造 | |||||||||
| 識別子 | |||||||||
| 略号 | FBPase_3 | ||||||||
| Pfam | PF01950 | ||||||||
| InterPro | IPR002803 | ||||||||
| SCOP | 1umg | ||||||||
| SUPERFAMILY | 1umg | ||||||||
| |||||||||
フルクトース-1,6-ビスホスファターゼ(Fructose 1,6-bisphosphatase、FBPアーゼ、EC 3.1.3.11)は、同化過程の糖新生やカルビン回路でフルクトース-1,6-ビスリン酸をフルクトース-6-リン酸に変換する酵素である。FBPアーゼの触媒する反応は、解糖系におけるホスホフルクトキナーゼの逆反応である[1][2]。これらの酵素はどちらも一方向しか触媒できず、フルクトース-2,6-ビスリン酸等の代謝産物によって制御されるため、どちらか一方の活性が高くなると、もう一方の活性が低くなる。つまり、フルクトース-2,6-ビスリン酸はFBPアーゼをアロステリック阻害するが、ホスホフルクトキナーゼ-Iを活性化させる。フルクトース-1,6-ビスリン酸は多くの異なる代謝経路に関与し、ほぼ全ての生物で見られる。FBPアーゼは、触媒に金属イオン(Mg2+とMn2+)を必要とし、Li2+に強く阻害される[3]。
ブタのFBPアーゼのフォールディングは、イノシトール-1-ホスファターゼと相同である。イノシトールポリリン酸-1-ホスファターゼ、イノシトール-1-ホスファターゼ、FBPアーゼは、金属イオンに結合し触媒作用に関与していることが示されているAsp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Serのモチーフ配列を共有している。このモチーフは、菌類、細菌、酵母のイノシトール-1-ホスファターゼでも保存されている。これらのタンパク質は、イノシトールシグナル、糖新生、硫酸塩同化、そして恐らくキノン代謝等の様々な代謝経路に関与する。
3つの異なる種類のFBPアーゼのグループ(FBPアーゼI,II,III)が真核生物及び細菌で同定されている[4]。最近まで古細菌では発見されていなかったが、イノシトールモノホスファターゼの活性も持つ4つめの新しいグループのFBPアーゼ(FBPアーゼIV)が最近になって同定された[5]。
また、好熱性古細菌や超好熱性細菌Aquifex aeolicusでは、新しいグループのFBPアーゼ(FBPアーゼV)が発見された[6]。このグループのFBPアーゼは基質特異性が高く、これらの生物の真のFBPアーゼであることが示唆されている[6][7]。二次構造の研究により、FBPアーゼVは、通常の糖ホスファターゼが持つα-β-α-β-αの5層のサンドイッチ構造ではなく、新しいフォールディングであるα-β-β-αの4層構造を持っていることが明らかとなった[7]。触媒部位の側鎖と金属リガンドの配列は、他のFBPアーゼの機構として提案されていた3つの金属イオンによる触媒機構と一致することが発見された。
低GC含量のグラム陽性細菌であるフィルミクテス門の持つFBPアーゼは、他の生物の持つFBPアーゼと配列上の類似性がほとんどない。枯草菌の酵素はアデノシン一リン酸で阻害されるが、ホスホエノールピルビン酸によりこの阻害は解除され、またMn2+イオンに依存する[8][9]。この酵素を欠く変異体は、リンゴ酸やグリセロールのような糖新生成長基質でも生きることができる。
関連項目[編集]
出典[編集]
- ^ Marcus F, Harrsch PB (May 1990). “Amino acid sequence of spinach chloroplast fructose-1,6-bisphosphatase”. Arch. Biochem. Biophys. 279 (1): 151-7. doi:10.1016/0003-9861(90)90475-E. PMID 2159755.
- ^ Marcus F, Gontero B, Harrsch PB, Rittenhouse J (March 1986). “Amino acid sequence homology among fructose-1,6-bisphosphatases”. Biochem. Biophys. Res. Commun. 135 (2): 374-81. doi:10.1016/0006-291X(86)90005-7. PMID 3008716.
- ^ York JD, Ponder JW, Majerus PW (May 1995). “Definition of a metal-dependent/Li(+)-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure”. Proc. Natl. Acad. Sci. U.S.A. 92 (11): 5149-53. doi:10.1073/pnas.92.11.5149. PMC 41866. PMID 7761465.
- ^ Donahue JL, Bownas JL, Niehaus WG, Larson TJ (October 2000). “Purification and characterization of glpX-encoded fructose 1, 6-bisphosphatase, a new enzyme of the glycerol 3-phosphate regulon of Escherichia coli”. J. Bacteriol. 182 (19): 5624-7. PMC 111013. PMID 10986273.
- ^ Stec B, Yang H, Johnson KA, Chen L, Roberts MF (November 2000). “MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1,6-bisphosphatase”. Nat. Struct. Biol. 7 (11): 1046-50. doi:10.1038/80968. PMID 11062561.
- ^ a b Rashid N, Imanaka H, Kanai T, Fukui T, Atomi H, Imanaka T (August 2002). “A novel candidate for the true fructose-1,6-bisphosphatase in archaea”. J. Biol. Chem. 277 (34): 30649-55. doi:10.1074/jbc.M202868200. PMID 12065581.
- ^ a b Nishimasu H, Fushinobu S, Shoun H, Wakagi T (June 2004). “The first crystal structure of the novel class of fructose-1,6-bisphosphatase present in thermophilic archaea”. Structure 12 (6): 949-59. doi:10.1016/j.str.2004.03.026. PMID 15274916.
- ^ Fujita Y, Freese E (June 1979). “Purification and properties of fructose-1,6-bisphosphatase of Bacillus subtilis”. J. Biol. Chem. 254 (12): 5340-9. PMID 221467.
- ^ Fujita Y, Yoshida K, Miwa Y, Yanai N, Nagakawa E, Kasahara Y (August 1998). “Identification and expression of the Bacillus subtilis fructose-1, 6-bisphosphatase gene (fbp)”. J. Bacteriol. 180 (16): 4309-13. PMC 107433. PMID 9696785.
関連文献[編集]
- Berg, Jeremy Mark; John L. Tymoczko, Lubert Stryer (2002). “Glycolysis and Gluconeogenesis”. In Susan Moran (ed.). Biochemistry (5th Edition ed.). 41 Madison Avenue, New York, New York: W. H. Freeman and Company. ISBN 0-7167-3051-0
外部リンク[編集]
- Fructose-1,6-Biphosphatase - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)