「体外式膜型人工肺」の版間の差分
en:Extracorporeal membrane oxygenation (20:19, 21 March 2020 UTC) を翻訳 |
(相違点なし)
|
2020年3月23日 (月) 03:24時点における版
| 体外式膜型人工肺 | |
|---|---|
| 治療法 | |
 | |
| ICD-10-PCS | 5A15223 |
| ICD-9-CM | 39.65 |
| MeSH | 29295 |
| MedlinePlus | 007234 |
体外式膜型人工肺(たいがいしきもけいじんこうはい、Extracorporeal membrane oxygenation, ECMO, エクモ)は、体外生命維持(extracorporeal life support, ECLS)とも呼ばれる技術。 心臓と肺が生命を維持するのに十分な量のガス交換または灌流を提供できない者に対し、長期間、心臓と呼吸の支援を提供する体外技術である。 ECMOの技術は、主に心肺バイパスに由来しており、自然循環の停止により短期間の支援を提供する。
ECMOは、人の体から血液を抜き出し、二酸化炭素を人工的に除去し、 赤血球を酸素化して再び体内に戻す。 一般的に、心肺バイパス術後または重度の心不全および/または肺不全の人の後期治療に使用されるが、現在は特定の施設において心停止の治療として使用されており、ECMOにより循環と酸素供給がサポートされている間、機能停止の根本的な原因の治療を可能にする。
歴史
ECMOは1950年代にジョン・ヘイシャム・ギボンによって最初に開発され、その後C・ウォルトン・リレヘイ(C. Walton Lillehei)によって開発された。 新生児に対し最初の使用は1965年だった[1][2]。
医療用途


ECMOの適応と実践を説明するガイドラインは、 体外生命維持機構 (Extracorporeal Life Support Organization, ELSO)によって公開されている。 ECMOの開始基準は施設によって異なるが、通常、可逆的で従来の管理に反応しない可能性のある急性または重度の心不全または肺不全が含まれる。 ECMOの開始を促す可能性のある臨床的状況の例には、以下が含まれる: [3]
- 吸気酸素濃度(FiO2)、呼気終末陽圧型人工呼吸(positive end-expiratory pressure , PEEP)、呼気と呼気の比率(I:E)を含む、人工呼吸器設定の最適化にもかかわらず、動脈血酸素分圧と吸気酸素濃度比率(PaO2 / FiO2)が100 mmHgを下回る低酸素性呼吸不全
- 動脈血pHが7.20未満の高炭酸ガス呼吸不全
- 難治性心原性ショック
- 心停止
- 心臓手術後の心肺バイパスからの離脱の失敗
- 心臓移植または心室補助装置の配置への架け橋として
- 肺移植への架け橋として
- 敗血症性ショックに対するECMOの利用は、議論の余地があるが、研究が盛んになっている
- 深部体温が28〜24 °Cの低体温 と心臓の不安定性、または深部体温が24°C未満 [4]
心停止または心原性ショックの患者では、生存率と良好な結果が改善されるようだ[5]。
新型コロナウイルス(COVID-19)患者での使用
2020年2月初旬から、中国の医師は、 SARS-CoV-2感染( COVID-19 )に伴う急性ウイルス性肺炎を呈する患者の補助的対処療法として、換気後でも、血中酸素化レベルが低すぎて患者を維持できない場合、ECMOの利用が急増している[6]。最初の報告は、患者の血中酸素飽和度を回復しECMOが利用された重症例の約3%の死亡率を低下させるのに役立つことを示している[7]。
成果
初期の研究では、特に急性呼吸窮迫症候群の状況において、急性呼吸不全の人々に対するECMOの使用による生存の利点が示された[8][9]。 ELSOに管理されている、ECMOを受けた約51,000人は、新生児呼吸不全の75%の生存、小児呼吸不全の56%の生存、および成人呼吸不全の55%の生存の結果を報告している[10] 。他の観察および非対照臨床試験では、50〜70%の生存率が報告されている[11][12]。これらの報告された生存率は、過去の生存率よりも優れている[13][14][15]。ECMOはさまざまな死亡率のさまざまな状況で使用されているが、早期発見は悪化の進行を防ぎ、生存率を高めるための鍵となる[16]。
英国では、veno-venous ECMO(VV ECMO, 静脈脱血-静脈送血 ECMO)の展開は指定されたECMOセンターに集中しており、潜在的にケアを改善し、より良い結果を促進している。
禁忌
ほとんどの禁忌は相対的であり、手順のリスク(他の人に使用できる貴重なリソースを使用するリスクを含む)と潜在的な利益のバランスをとる。 相対的禁忌は次のとおり。
- その人が回復した場合、通常の生活と両立しない状態である
- 生活の質に影響を与える既存の状態( CNS状態、末期悪性腫瘍、抗凝固療法による全身出血のリスク)
- 年齢、体格
- 無益:重症度が重い人、従来の治療を受けている期間が長すぎる人、または致命的な診断を受けている人。
タイプ
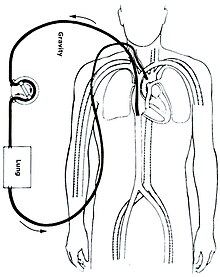

ECMOにはいくつかの形式がある。最も一般的な2つは、静脈脱血-動脈送血(venoarterial, VA)ECMOと静脈脱血-静脈送血(venovenous, VV)ECMOである。 どちらの方法でも、静脈系から取り出した血液は体外で酸素化される。 VA ECMOでは、この血液は動脈系に戻され、VV ECMOでは、血液は静脈系に戻される。 VV ECMOでは、心臓のサポートは提供されない。
静脈脱血-動脈送血
静脈脱血-動脈送血(VA)ECMOでは、静脈カニューレは通常、右または左の大腿静脈に挿入して配置し、動脈カニューレは通常、右または左の大腿動脈に注入して配置する[18]。大腿静脈カニューレの先端は下大静脈と右心房の接合部の近くに維持し、大腿動脈カニューレの先端は腸骨動脈に維持する[18]。成人では、挿入がより簡単であるため、大腿動脈にアクセスすることが推奨される。心肺バイパスがすでに確立されている場合、または緊急の再胸骨切開が行われた場合は、右心房にカニューレ(または三尖弁修復の場合はSVC / IVC)および上行大動脈)にCentral VA ECMOを使用できる[18]。
VA ECMOは、通常、大動脈カニューレによって送達され、逆流に対するポンピングに関連する心臓発作の増加を緩和するため、本来の心機能が最小の場合に用いられる。
静脈脱血-静脈送血
静脈脱血-静脈送血(VV)ECMOでは、カニューレは通常、脱血のために右大腿静脈に、送血のために右頸静脈内に配置される[19]。または、デュアルルーメンカテーテルを右頸静脈内に挿入し、上大静脈および下大静脈から脱血し、右心房に戻す。
開始
ECMOは、その開始、メンテナンス、および中止のトレーニングと経験がある臨床医のみが実行する必要がある。 ECMOの管理は、通常、登録看護師(Registered Nurse)、呼吸療法士(Respiratory Therapist)、または灌流専門医(Perfusionist)によって行われる。 ECMOを開始することが決定したら、 血栓形成により人工肺から凝固するのを防ぐために、患者の静脈内ヘパリンを投与し抗凝固処理をする。 開始前に、ヘパリンを急速静脈内投与し測定して、ACT(Activated clotting time, 活性化凝固時間)が300〜350秒の間であることを確認する。 ACTがこの範囲内にあると、ECMOを開始でき、維持用量としてヘパリン点滴が開始される [20]。
挿管
カニューレは、血管へのアクセスを得るための比較的簡単で一般的な方法であるセルディンガー法 (選択的血管造影法、Seldinger technique)、または外科的切開により経皮的に配置することができる。血流を最大化し、せん断応力を最小化するために、血管に配置できる最大の太さのカニューレが使用される。
心臓手術後の合併症に必要なECMOは、心臓または大血管の適切な房に直接配置できる。 外側開胸による中央カニューレ挿入により、肺移植を待っている患者は、鎮静剤を使用せずに歩き回ることができる[21]。
滴定
カニューレ挿入とECMO回路への接続後、ECMO回路を通る血流の適切な量は、血行動態パラメーターと理学的検査を使用して決定される。 ECMO回路を介した臓器終末灌流の維持の目標は、心臓を通る十分な生理学的血流とバランスが取れており、うっ滞とその後の血栓の形成を防ぐ。
メンテナンス
最初の呼吸および血行動態の目標が達成されると、血流はその速度で維持される。 頻繁な評価と調整は、ECMO回路の静脈肢の血液のオキシヘモグロビン飽和度を直接測定する、連続静脈酸素測定により行われる。
特別な考慮事項
VV ECMOは通常、呼吸不全に使用され、VA ECMOは心不全に使用される。 ECMOの種類ごとに固有の考慮事項があり、管理に影響する。
血流
酸素供給を最適化するために、VV ECMOでは通常、ほぼ最大流量が望まれる。 対照的に、VA ECMO中に使用される流量は、適切な灌流圧と静脈オキシヘモグロビン飽和(排液血液で測定)を提供するのに十分高いが、左心室出力を維持するのに十分な前負荷を提供するのに十分低い必要がある。
利尿
ほとんどの人はECMOを開始すると体液が過剰になるため、ECMOが安定したら積極的な利尿が必要になる。 尿量が不十分な場合は、限外ろ過をECMO回路に簡単に追加できる。 ECMO「チャタリング(chatter)」またはECMO波形の不安定性は、蘇生不足を表し、限外濾過による積極的な利尿の中止を示唆する。
左室モニタリング
左心室の機能は、 後負荷の増加により損なわれる可能性があるため、VA ECMO中に左心室の出力が厳密に監視される[22][23]。
離脱および中止
呼吸不全の患者の場合、X線写真の外観、肺コンプライアンス、動脈オキシヘモグロビン飽和度の改善は、その人がECMOサポートをやめる準備ができていることを示す。 心不全の患者の場合、大動脈拍動性の亢進は左心室出力の改善と相関しており、ECMOのサポートを外す準備ができていることを示す。 すべてのマーカーが良好な状態にある場合、ECMOの血流をゆっくりと減少させ、この間に患者のパラメーターが観察され、患者が変化に耐えられることを確認する。 流量が1分間に2リットル未満の場合、永続的な除去が試みられ、この期間中、患者はカニューレを除去できるまで監視され続ける [24]。
VV ECMO離脱試験
VV ECMOトライアルは、人工肺を通るすべての向流スイープガス(countercurrent sweep gas)を除去することによって実行される。 体外血流は一定のままですが、ガスの移動は発生しない。 それらは数時間観察され、その間、動脈および静脈血液ガスの結果が示すように、ECMOからの適切な酸素化と換気を維持するために必要な人工呼吸器の設定が決定される。
VA ECMO離脱試験
VA ECMOのトライアルでは、ECMO回路が動脈と静脈の肢の間のブリッジを循環できるようにしながら、脱血ラインと送血ラインの両方を一時的にクランプする必要がある。 これにより、ECMO回路内の停滞血液の血栓症が防止される。 さらに、動脈および静脈のラインは、ヘパリン添加生理食塩水で連続的に、または回路からのヘパリン添加血液で断続的に洗い流す必要がある。 一般に、血栓形成のリスクが高いため、VA ECMOトライアルはVV ECMOトライアルよりも期間が短くなる。
合併症
神経学
ECMO治療を受けた成人の一般的な合併症は、脳内出血、くも膜下出血、脳の中で影響を受けやすい領域の虚血性梗塞、低酸素性虚血性脳症、原因不明の昏睡、脳死などの神経損傷である[25]。出血は、ECMOを受けた人の30〜40%で発生し、生命を脅かす可能性がある。出血は、継続的なヘパリン注入が必要であることと血小板機能不全の両方により起こる。 綿密な外科技術、100,000 / mm 3を超える血小板数の維持、および活性化凝固時間の目標値維持により、出血の可能性が減少する [要出典] 。 [ 引用が必要 ]
血液
ヘパリン誘発性血小板減少症 (Heparin-induced thrombocytopenia, HIT)は、ECMOを受けている人々の間でとても一般的で、頻発する。 HITが疑われる場合、通常、ヘパリン注入は、非ヘパリン抗凝固薬に置き換えられる[26]。
大腿動脈および静脈がVA ECMOに使用される場合は常に、下行大動脈に逆行性血流がある。 左室の出力が維持されない場合、血液のうっ血が起こり、血栓症を引き起こす可能性がある [要出典] 。 [ 引用が必要 ]
機械換気
ある研究では、急性呼吸窮迫症候群に対してECMOを受けている患者と従来の換気を受けている患者を比較し、重度の障害を伴わない6ヶ月の生存期間の改善が示されている [27]。
ECMOを支援するブリッジ
VA ECMOで、心機能がECMOから離脱するのに十分に回復しない人は、心室補助装置(ventricular assist device, VAD)または移植につなぐことができる。 カニューレ挿入中に、出血を伴う血管穿孔、動脈解離、遠位虚血、および不正確な位置(たとえば、動脈内に置かれた静脈カニューレ)を含むさまざまな合併症が発生する可能性があるが、これらのイベントは非常にまれに発生する [要出典]。
小児・乳児・新生児
早産児、妊娠32週未満の年齢でECMOを開始した場合、 脳室内出血 (intraventricular hemorrhage, IVH)のリスクが許容できないほど高くなる[28]。
研究
2014年の研究では、第XIIa因子阻害抗体が出血リスクを増加させることなく体外循環の血栓保護を提供することが示された[29] 。新生児動物での実験は、ECMO治療が腸細胞のアポトーシス、 腸粘膜バリアの損傷、および細菌の移動につながる可能性があることを示した。 これは、新生児の全身性炎症反応症候群の重症度を説明できるかもしれない[30]。ECMOはまた、 遺体へ使用することで、 移植臓器の生存率を高めることができると考えられている[31]。
ECMOメーカー
- メドトロニック [32]
- マケ[32]( Getinge Group )
- ソリングループ [32]
- テルモ [32]
- Xenios AG [32] ( フレゼニウスメディカルケア )
国および地域別のECMOの数
| 国/地域 | 大陸 | ECMOを提供している病院の数 | ECMOの数 |
|---|---|---|---|
| 北米 | 264(2019年)[33] | ||
| 北米 | 32(2020年)[34] | ||
| ヨーロッパ | 5(2020年)[35] | 15(2020年) [35] | |
| ヨーロッパ | 0(2020年)[35] | 0(2020年)[36] | |
| ヨーロッパ | 0(2020年)[35] | 0(2020年)[35] | |
| ヨーロッパ | 40(2019年)[37] | ||
| ヨーロッパ | 47(2020年)[38] | ||
| ヨーロッパ | > = 7(2020年)[39] | ||
| ヨーロッパ | 0(2020年)[40] | 0(2020年)[40] | |
| ヨーロッパ | 124 + 17(2020年)[41] | ||
| ヨーロッパ | 16(2020年)[42] | ||
| アジア | 1,412(2020年)[43][44] | ||
| アジア | 約400(2020年)[45] |
脚注
- ^ “Pediatric Extracorporeal Membrane Oxygenation”. 2020年3月23日閲覧。
- ^ Mosier, Jarrod M.; Kelsey, Melissa; Raz, Yuval; Gunnerson, Kyle J.; Meyer, Robyn; Hypes, Cameron D.; Malo, Josh; Whitmore, Sage P. et al. (2015). “Extracorporeal membrane oxygenation (ECMO) for critically ill adults in the emergency department: history, current applications, and future directions”. Critical Care 19: 431. doi:10.1186/s13054-015-1155-7. PMC 4699333. PMID 26672979.
- ^ “General Guidelines for all ECLS Cases”. Extracorporeal Life Support Organization. 2015年4月15日閲覧。
- ^ State of New Hampshire Patient Care Protocols v7. New Hampshire: NH Medical Control Board. (2018). pp. 2.10
- ^ Ouweneel, DM; Schotborgh, JV; Limpens, J; Sjauw, KD; Engström, AE; Lagrand, WK; Cherpanath, TG; Driessen, AH et al. (19 September 2016). “Extracorporeal life support during cardiac arrest and cardiogenic shock: a systematic review and meta-analysis.”. Intensive Care Medicine 42 (12): 1922–1934. doi:10.1007/s00134-016-4536-8. PMC 5106498. PMID 27647331.
- ^ “30 to 39 pct of severe COVID-19 patients discharged from Wuhan hospitals: official - Xinhua | English.news.cn”. www.xinhuanet.com. 2020年2月16日閲覧。
- ^ CDC (2020年2月11日). “2019 Novel Coronavirus (2019-nCoV)” (英語). Centers for Disease Control and Prevention. 2020年2月16日閲覧。
- ^ Peek, GJ; Moore, HM; Moore, N; Sosnowski, AW; Firmin, RK (1997). “Extracorporeal membrane oxygenation for adult respiratory failure”. Chest 112 (3): 759–64. doi:10.1378/chest.112.3.759. PMID 9315812.
- ^ Lewandowski, K.; Rossaint, R.; Pappert, D.; Gerlach, H.; Slama, K.-J.; Weidemann, H.; Frey, D. J. M.; Hoffmann, O. et al. (1997). “High survival rate in 122 ARDS patients managed according to a clinical algorithm including extracorporeal membrane oxygenation”. Intensive Care Medicine 23 (8): 819–35. doi:10.1007/s001340050418. PMID 9310799.
- ^ Paden, Matthew L.; Conrad, Steven A.; Rycus, Peter T.; Thiagarajan, Ravi R. (2017-04-01). “Extracorporeal Life Support Organization Registry International Report 2016”. ASAIO Journal 63 (1): 60–67. doi:10.1097/MAT.0000000000000475. PMID 27984321.
- ^ Hemmila, Mark R.; Rowe, Stephen A.; Boules, Tamer N.; Miskulin, Judiann; McGillicuddy, John W.; Schuerer, Douglas J.; Haft, Jonathan W.; Swaniker, Fresca et al. (2004). “Extracorporeal Life Support for Severe Acute Respiratory Distress Syndrome in Adults”. Annals of Surgery 240 (4): 595–605; discussion 605–7. doi:10.1097/01.sla.0000141159.90676.2d. PMC 1356461. PMID 15383787.
- ^ Brogan, Thomas V.; Thiagarajan, Ravi R.; Rycus, Peter T.; Bartlett, Robert H.; Bratton, Susan L. (2009). “Extracorporeal membrane oxygenation in adults with severe respiratory failure: A multi-center database”. Intensive Care Medicine 35 (12): 2105–14. doi:10.1007/s00134-009-1661-7. PMID 19768656.
- ^ Kolla, S; Awad, SS; Rich, PB; Schreiner, RJ; Hirschl, RB; Bartlett, RH (1997). “Extracorporeal life support for 100 adult patients with severe respiratory failure”. Annals of Surgery 226 (4): 544–64; discussion 565–6. doi:10.1097/00000658-199710000-00015. PMC 1191077. PMID 9351722.
- ^ Rich, PB; Awad, SS; Kolla, S; Annich, G; Schreiner, RJ; Hirschl, RB; Bartlett, RH (1998). “An approach to the treatment of severe adult respiratory failure”. Journal of Critical Care 13 (1): 26–36. doi:10.1016/S0883-9441(98)90026-0. PMID 9556124.
- ^ Ullrich, R; Lorber, C; Röder, G; Urak, G; Faryniak, B; Sladen, RN; Germann, P (1999). “Controlled airway pressure therapy, nitric oxide inhalation, prone position, and extracorporeal membrane oxygenation (ECMO) as components of an integrated approach to ARDS”. Anesthesiology 91 (6): 1577–86. doi:10.1097/00000542-199912000-00007. PMID 10598597.
- ^ Lich, Byran (2004). The Manual of Clinical Perfusion (2nd ed.). Fort Myers, Florida: Perfusion.com. ISBN 978-0-9753396-0-2
- ^ a b Van Meurs, Krisa; Lally, Kevin; Zwischenberger, Joseph B. et al., eds (2005). ECMO: Extracorporeal Cardiopulmonary Support in Critical Care. Ann Arbor: Extracorporeal Life Support Organization. ISBN 978-0-9656756-2-8[要ページ番号]
- ^ a b c Madershahian, Navid; Nagib, Ragi; Wippermann, Jens; Strauch, Justus; Wahlers, Thorsten (2006). “A Simple Technique of Distal Limb Perfusion During Prolonged Femoro-Femoral Cannulation”. Journal of Cardiac Surgery 21 (2): 168–9. doi:10.1111/j.1540-8191.2006.00201.x. PMID 16492278.
- ^ Wang, Dongfang; Zhou, Xiaoqin; Liu, Xiaojun; Sidor, Bill; Lynch, James; Zwischenberger, Joseph B. (2008). “Wang-Zwische Double Lumen Cannula—Toward a Percutaneous and Ambulatory Paracorporeal Artificial Lung”. ASAIO Journal 54 (6): 606–11. doi:10.1097/MAT.0b013e31818c69ab. PMID 19033774.
- ^ Lich, Bryan (2004). The Manual of Clinical Perfusion (2nd ed.). Fort Myers, Florida: Perfusion.com. pp. 143. ISBN 978-0-9753396-0-2
- ^ Chierichetti, M.; Santini, A.; Pagan, F.; Crotti, S.; Lissoni, A.; Gattinoni, L. (2012). “ECMO in nonintubated patients as a bridge to lung transplant: Our experience”. Critical Care 16: P97. doi:10.1186/cc10704.
- ^ Cohen, Gordon; Permut, Lester (2005). “Decision making for mechanical cardiac assist in pediatric cardiac surgery”. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual 8: 41–50. doi:10.1053/j.pcsu.2005.02.004. PMID 15818357.
- ^ Vural, Kerem M. (2008). “Ventricular assist device applications”. Anadolu Kardiyoloji Dergisi 8 (Suppl 2): 117–130. PMID 19028644.
- ^ Lich, Bryan (2004). The Manual of Clinical Perfusion (2nd ed.). Fort Myers, Florida: Perfusion.com. p. 149. ISBN 978-0-9753396-0-2
- ^ Mateen, Farrah J.; Muralidharan, R.; Shinohara, R. T.; Parisi, J. E.; Schears, G. J.; Wijdicks, E. F. (2011). “Neurological Injury in Adults Treated With Extracorporeal Membrane Oxygenation”. Archives of Neurology 68 (12): 1543–9. doi:10.1001/archneurol.2011.209. PMID 21825216.
- ^ Cornell, Timothy; Wyrick, Polly; Fleming, Geoffrey; Pasko, Deborah; Han, Yong; Custer, Joseph; Haft, Jonathan; Annich, Gail (2007). “A Case Series Describing the Use of Argatroban in Patients on Extracorporeal Circulation”. ASAIO Journal 53 (4): 460–3. doi:10.1097/MAT.0b013e31805c0d6c. PMID 17667231.
- ^ “Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial”. Lancet 374 (9698): 1351–63. (Oct 2009). doi:10.1016/S0140-6736(09)61069-2. PMID 19762075.
- ^ Jobe, Alan H. (2004). “Post-conceptional age and IVH in ECMO patients”. The Journal of Pediatrics 145 (2): A2. doi:10.1016/j.jpeds.2004.07.010.
- ^ “A Factor XIIa Inhibitory Antibody Provides Thromboprotection in Extracorporeal Circulation Without Increasing Bleeding Risk.”. Sci. Transl. Med. 6 (222): 222. (Jan 2014). doi:10.1126/scitranslmed.3006804. PMID 24500405.
- ^ MohanKumar K (Feb 2014). “Intestinal epithelial apoptosis initiates gut mucosal injury during extracorporeal membrane oxygenation in the newborn piglet”. Lab. Invest. 94 (2): 150–160. doi:10.1038/labinvest.2013.149. PMC 3946757. PMID 24365747.
- ^ Magliocca, JF; Magee, JC; Rowe, SA; Gravel, MT; Chenault Rh, 2nd; Merion, RM; Punch, JD; Bartlett, RH et al. (2005). “Extracorporeal support for organ donation after cardiac death effectively expands the donor pool”. The Journal of Trauma 58 (6): 1095–101; discussion 1101–2. doi:10.1097/01.ta.0000169949.82778.df. PMID 15995454.
- ^ a b c d e Extracorporeal Membrane Oxygenation (ECMO) Market Set To Excellent Revolutionary Growth By 2025. MarketWatch. February 19, 2020.
- ^ Miracle medical machine ECMO makes heroic rescues, but leaves patients in limbo. USA Today. June 17, 2019.
- ^ Coronavirus outbreak: B.C. health officials confirm 11 new cases of COVID-19 (14:40-). Global News. March 14, 2020.
- ^ a b c d e Coronavirus: England only has 15 beds for worst respiratory cases. The Guardian. February 27, 2020.
- ^ Northern Ireland, Scotland and Wales rank amongst the lowest countries in the developed world for the number of intensive care beds. Slugger O'Toole. March 4, 2020.
- ^ Immer mehr Grippefälle: Eine kleine Maschine am Helios Klinikum kann Leben retten (ドイツ語). Pforzheimer Zeitung. February 18, 2020.
- ^ Walka z koronawirusem. Ile w Polsce jest urządzeń do wspomagania oddychania? (ポーランド語). TVN24. March 12, 2020.
- ^ Få Ecmo-platser för svårt coronasjuka på Nya Karolinska (スウェーデン語). Dagens Nyheter. March 10, 2020.
- ^ a b Mjeku shqiptar në Gjermani: Ka disa kushte për vetizolimin, në Shqipëri nuk ka aparat ECMO, rreziku është i madh (アルバニア語). Ora News. March 12, 2020.
- ^ Голикова заверила, что медики в РФ готовы к любому развитию ситуации с COVID-19 (ロシア語). Department of health of Moscow. March 16, 2020.
- ^ НОВАЯ ИНФЕКЦИОННАЯ БОЛЬНИЦА СМОЖЕТ ПРИ НЕОБХОДИМОСТИ ПРИНЯТЬ ДО 500 ЧЕЛОВЕК (ロシア語). Department of health of Moscow. March 13, 2020.
- ^ 人工呼吸器およびECMO装置の取扱台数等に関する緊急調査 (日本語). Japan Association for Clinical Engineers. March 9, 2020.
- ^ 'Last resort' COVID-19 treatment in short supply at Japan's hospitals. Japan Times. March 12, 2020.
- ^ 疫情关键时刻救命的ECMO:全国只有400台 为何这么少? (中国語). Sina Corp. February 10, 2020
外部リンク
- アメリカ胸部学会、患者教育: ECMOとは? (オンラインPDF)
