乳酸脱水素酵素
ウィキペディアは医学的助言を提供しません。免責事項もお読みください。 |
| 乳酸脱水素酵素 A | |
|---|---|
 | |
| 識別子 | |
| 略号 | LDHA |
| Entrez | 3939 |
| HUGO | 6535 |
| OMIM | 150000 |
| RefSeq | NM_005566 |
| UniProt | P00338 |
| 他のデータ | |
| EC番号 (KEGG) | 1.1.1.27 |
| 遺伝子座 | Chr. 11 p15.4 |
| 乳酸脱水素酵素 B | |
|---|---|
| 識別子 | |
| 略号 | LDHB |
| Entrez | 3945 |
| HUGO | 6541 |
| OMIM | 150100 |
| RefSeq | NM_002300 |
| UniProt | P07195 |
| 他のデータ | |
| EC番号 (KEGG) | 1.1.1.27 |
| 遺伝子座 | Chr. 12 p12.2-12.1 |
| 乳酸脱水素酵素 C | |
|---|---|
| 識別子 | |
| 略号 | LDHC |
| Entrez | 3948 |
| HUGO | 6544 |
| OMIM | 150150 |
| RefSeq | NM_002301 |
| UniProt | P07864 |
| 他のデータ | |
| EC番号 (KEGG) | 1.1.1.27 |
| 遺伝子座 | Chr. 11 p15.5-15.3 |
乳酸脱水素酵素(にゅうさんだっすいそこうそ、Lactate Dehydrogenase: LDH)は、植物および動物を含む多くの有機体に存在する酵素である。乳酸脱水素酵素には4種の異なる種が存在する。2種はシトクロムc依存型で、D-乳酸(D-乳酸デヒドロゲナーゼ (シトクロム):EC 1.1.2.4)またはL-乳酸(L-乳酸デヒドロゲナーゼ (シトクロム):EC 1.1.2.3)のそれぞれに作用する。残りの2種はNAD(P)-依存型酵素で、D-乳酸(D-乳酸デヒドロゲナーゼ:EC 1.1.1.28)またはL-乳酸(L-乳酸デヒドロゲナーゼ:EC 1.1.1.27)のそれぞれに作用する。本稿では主にNAD(P)-依存型 L-乳酸脱水素酵素について述べる。
反応
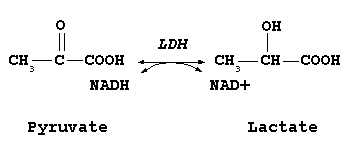
乳酸脱水素酵素は乳酸とピルビン酸を相互変換を触媒する。そのとき、NADHとNAD+の相互変換も同時に起こる。ピルビン酸の乳酸への変換は、酸素が欠乏または供給不足のとき(嫌気呼吸時)に起こる解糖系の最終反応である。この逆反応が肝臓のコリ回路において行われる。乳酸の濃度が高くなると酵素はフィードバック抑制を示し、ピルビン酸の乳酸への変換率が減少する。
機能
この節の加筆が望まれています。 |
ほとんどの組織や臓器に分布する酵素で、分子量13.5万の心筋型のH(B)と、骨格筋型のM(A)と称される2種類のサブユニットから成る4量体である。
また嫌気的なM型と好気的なH型の4量体であり、嫌気性解糖系の最終段階である乳酸 ⇔ ピルビン酸の反応を触媒する酵素である。
分布
生体内では肝臓、心筋、骨格筋、脾臓、腎臓などに分布をしている。 また、細胞内では細胞質基質に存在している。
検査
LDHは逸脱酵素として知られ、臨床検査では重要な検査項目のひとつである。
血中濃度の上昇はAST、ALTなどとともに肝障害を示唆する。 ただ、それ以外の面では心筋梗塞、溶血、感染症などでも上昇がみられ非常に非特異的であるため診断の参考としての有用性はあまり高くない。 ただし、単独で上昇しているとしたら悪性リンパ腫をはじめとした悪性腫瘍がかくれている可能性を考えるべきである。 総じて、スクリーニング(精密検査必要者のふるい分け)のための検査項目と言える。
LDHの中には5種類のアイソザイム(働きが同等で構造の違う酵素)が存在するため、精査の際にはこの内訳を分析することが臨床上有意義となる場合がある。
出典
- IUBMB entry for 1.1.1.27(英語)
- BRENDA references for 1.1.1.27 (英語)
- PubMed references for 1.1.1.27(英語)
- PubMed Central references for 1.1.1.27(英語)
- Google Scholar references for 1.1.1.27(英語)
外部リンク
- IUBMB entry for 1.1.1.27(英語)
- KEGG entry for 1.1.1.27(英語)
- BRENDA entry for 1.1.1.27(英語)
- NiceZyme view of 1.1.1.27(英語)
- EC2PDB: PDB structures for 1.1.1.27(英語)
- PRIAM entry for 1.1.1.27(英語)
- PUMA2 entry for 1.1.1.27(英語)
- IntEnz: Integrated Enzyme entry for 1.1.1.27(英語)
- MetaCyc entry for 1.1.1.27(英語)
- Atomic-resolution structures of enzymes belonging to this class(英語)
