ジチオラン
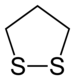
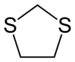
| 上: 1,2-ジチオラン 下: 1,3-ジチオラン | |
|---|---|
|
|
|

|
Dithiolane | |
別称 1,2-Dithiolane, 1,3-dithiolane | |
| 識別情報 | |
| PubChem | (1,2): 79045(1,3): 20970 |
| ChemSpider | (1,2): 71377 |
| ChEBI |
|
| |
| 特性 | |
| 化学式 | C3H6S2 |
| モル質量 | 106.21 g mol−1 |
| 関連する物質 | |
| 関連物質 | Ethane-1,2-dithiol |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ジチオラン (dithiolane) とは、シクロペンタンのメチレン基 (CH2) が2個スルフィド基 (-S-) に置き換わった有機硫黄化合物。あるいはその骨格を持つ誘導体の総称。硫黄が置き換わった位置により、1,2-ジチオランと1,3-ジチオランの異性体がある。
1,2-ジチオラン[編集]
1,2-ジチオラン構造は環状のジスルフィドで、α-リポ酸の部分構造として現れる。また、アスパラギン酸[1]のような一部の天然物中に含まれる[2]。
α-リポ酸は、金、モリブデン、タングステンなど多くの金属と強い親和性を持つ[3]。その他の1,2-ジチオランは、金ナノ粒子や遷移金属ジカルコゲン化物(MoS2やWS2)などのナノマテリアルに関連している[4][5][6]。
海洋の環形動物Lumbriconereis heteropoda から得られたイソメ毒[7]は、ニコチン性アセチルコリン受容体を遮断する事から、チオシクラムやカルタップ等の殺虫剤の原型となった[8]。
-
イソメ毒(Nereistoxin)
1,3-ジチオラン[編集]
1,3-ジチオラン構造は環状のジチオアセタールであり、カルボニル基の保護基として重要である。カルボニル化合物をルイス酸触媒のもと 1,2-エタンジチオールと縮合させると 1,3-ジチオランとすることができ、酸や塩基、還元剤や求核剤に対して耐性を持たせられる。脱保護は硝酸銀などの酸化剤を用いる[9]。

脚注[編集]
- ^ Pelchat, M. L.; Bykowski, C.; Duke, F. F.; Reed, D. R. (2011). “Excretion and perception of a characteristic odor in urine after asparagus ingestion: A psychophysical and genetic study”. Chemical Senses 36 (1): 9–17. doi:10.1093/chemse/bjq081. PMC 3002398. PMID 20876394.
- ^ Teuber, Lene (1990). “Naturally Occurring 1,2-Dithiolanes and 1,2,3-Trithianes. Chemical and Biological Properties”. Sulfur Reports 9 (4): 257–333. doi:10.1080/01961779008048732.
- ^ “Lipoic acid”. Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis (2019年1月1日). 2020年8月27日閲覧。
- ^ Bilewicz, Renata; Więckowska, Agnieszka; Kruszewski, Marcin; Stępkowski, Tomasz; Męczynska-Wielgosz, Sylwia; Cichowicz, Grzegorz; Piątek, Piotr; Załubiniak, Dominika et al. (2018-04-18). “Towards potent but less toxic nanopharmaceuticals – lipoic acid bioconjugates of ultrasmall gold nanoparticles with an anticancer drug and addressing unit” (英語). RSC Advances 8 (27): 14947–14957. doi:10.1039/C8RA01107A. ISSN 2046-2069.
- ^ Vallan, Lorenzo; Canton-Vitoria, Ruben; Gobeze, Habtom B.; Jang, Youngwoo; Arenal, Raul; Benito, Ana M.; Maser, Wolfgang K.; D’Souza, Francis et al. (2018-10-17). “Interfacing Transition Metal Dichalcogenides with Carbon Nanodots for Managing Photoinduced Energy and Charge-Transfer Processes”. Journal of the American Chemical Society 140 (41): 13488–13496. doi:10.1021/jacs.8b09204. hdl:10442/16257. ISSN 0002-7863. PMID 30222336.
- ^ Tagmatarchis, Nikos; Ewels, Christopher P.; Bittencourt, Carla; Arenal, Raul; Pelaez-Fernandez, Mario; Sayed-Ahmad-Baraza, Yuman; Canton-Vitoria, Ruben (2017-06-05). “Functionalization of MoS 2 with 1,2-dithiolanes: toward donor-acceptor nanohybrids for energy conversion” (英語). NPJ 2D Materials and Applications 1 (1): 13. doi:10.1038/s41699-017-0012-8. ISSN 2397-7132.
- ^ 坂井道彦 (05 1966). “Studies on the Insecticidal Action of Nereistoxin, 4-N, N-dimethylamino-1, 2-dithiolane : II. Symptomatology” (英語). 防虫科学 (防虫科学研究所) 31 (2): 53-61. ISSN 0006-5420. NAID 120004397965.
- ^ Casida, John E.; Durkin, Kathleen A. (2013). “Neuroactive Insecticides: Targets, Selectivity, Resistance, and Secondary Effects”. Annual Review of Entomology 58: 99–117. doi:10.1146/annurev-ento-120811-153645. PMID 23317040.
- ^ Greene, T. W.; Wuts, P. G. Protecting Groups in Organic Syntheses 3rd ed., Wiley, 1999, ISBN 9780471160199, doi:10.1002/0471220574.



