「ペプチドワクチン」の版間の差分
削除された内容 追加された内容
m bot: 解消済み仮リンク腫瘍関連抗原を内部リンクに置き換えます |
英語版 Peptide vaccine の 2022-02-13T18:25:06(UTC)版を翻訳して全面的に書き換え タグ: サイズの大幅な増減 ビジュアルエディター |
||
| 1行目: | 1行目: | ||
'''ペプチドワクチン'''({{Lang-en-short| |
'''ペプチドベース合成ワクチン'''({{Lang-en-short|Peptide-based synthetic vaccines}})は、'''エピトープワクチン'''({{Lang-en-short|epitope vaccines}})とも呼ばれ、[[ペプチド]]から作られた[[サブユニットワクチン]]である。そのペプチドは、直接または潜在的に[[免疫応答]]を引き起こす[[抗原]]の[[エピトープ]]を模倣している<ref>{{cite journal | vauthors = Skwarczynski M, Toth I | title = Peptide-based synthetic vaccines | journal = Chemical Science | volume = 7 | issue = 2 | pages = 842–854 | date = February 2016 | pmid = 28791117 | pmc = 5529997 | doi = 10.1039/C5SC03892H }}</ref>。ペプチドワクチンは、[[感染]]性[[病原体]]や非感染性疾患に対する防御を誘導するだけでなく、[[腫瘍関連抗原]]に由来するペプチドを用いて、効果的な抗腫瘍[[細胞性免疫|T細胞応答]]を誘導する治療用[[がんワクチン]]としても利用することもできる<ref>{{cite journal | vauthors = Melief CJ, van der Burg SH | title = Immunotherapy of established (pre)malignant disease by synthetic long peptide vaccines | journal = Nature Reviews. Cancer | volume = 8 | issue = 5 | pages = 351–360 | date = May 2008 | pmid = 18418403 | doi = 10.1038/nrc2373 | s2cid = 205468352 }}</ref>。 |
||
== 歴史 == |
|||
従来の[[ワクチン]]は、生きている病原体または固定化した病原体全体である。第2世代のワクチンは、主に病原体から精製されたタンパク質である。第3世代のワクチンは、病原体のタンパク質を[[遺伝子発現|発現]]させるDNAやプラスミドである。ペプチドワクチンは、ワクチンの進化における最新の世代である<ref>{{cite book | vauthors = Schneble E, Clifton GT, Hale DF, Peoples GE | title = Vaccine Design | chapter = Peptide-Based Cancer Vaccine Strategies and Clinical Results | journal = Methods in Molecular Biology | volume = 1403 | pages = 797–817 | date = 2016 | pmid = 27076168 | doi = 10.1007/978-1-4939-3387-7_46 | publisher = Springer | isbn = 978-1-4939-3387-7 | series = Methods in Molecular Biology, Vaccine Design: Methods and Protocols: Volume 1: Vaccines for Human Diseases | place = New York, NY | veditors = Thomas S }}</ref>。 |
|||
== 長所と短所 == |
|||
ペプチドワクチンは、固定化した病原体全体やタンパク質分子を用いた従来のワクチンと比較して、いくつかの長所と短所がある<ref>{{cite journal | vauthors = Skwarczynski M, Toth I | title = Peptide-based synthetic vaccines | journal = Chemical Science | volume = 7 | issue = 2 | pages = 842–854 | date = February 2016 | pmid = 28791117 | pmc = 5529997 | doi = 10.1039/C5SC03892H }}</ref>。 |
|||
長所 |
|||
* ワクチンは[[化学合成]]によって完全に合成され、{{Ill2|分子実体|en|Molecular entity|label=化学物質}}として扱うことができる。 |
|||
* 自動化やマイクロ波技術を使用したより高度な[[ペプチド固相合成法]](SPPS)によって、ペプチドをより効率的に生産できる。 |
|||
* ワクチンは化学的に合成されるため、生物汚染はない。 |
|||
* ワクチンは水溶性であり、簡単な条件下で安定に保存するこができる。 |
|||
* ペプチドに特異性を持たせるために特別に設計することができる。たとえば、単一のペプチドワクチンに複数のエピトープを持たせ、いくつかの疾患に対する免疫応答を持つような設計ができる。 |
|||
* ワクチンは短いペプチド鎖しか含まないため、[[アレルギー]]反応や[[自己免疫応答]]を引き起こす可能性は低くなる。 |
|||
短所 |
|||
* [[免疫原性]]が低い。 |
|||
* 細胞内で不安定である。 |
|||
* [[天然状態|ネイティブ構造]]の欠如。 |
|||
* 有効性が限られた人々に限定される。 |
|||
== エピトープの設計 == |
|||
ペプチドワクチン全体は抗原のエピトープを模倣するものであるため、エピトープの設計はワクチン開発の最も重要な段階であり、目的の[[免疫原性]]タンパク質の[[一次構造|アミノ酸配列]]に対する正確な理解が必要である。設計されたエピトープは、病原体に対して強力で長期間の免疫応答を起こすことが期待される。エピトープを設計する際に考慮すべき事項は次の通りである。 |
|||
* 非優性エピトープ<!-- non-dominant epitope -->は、優性エピトープよりも強い免疫応答を引き起こす可能性がある。例: 鉤虫に感染した人の抗体は、{{Ill2|アメリカ鉤虫|en|Necator americanus}}(''Necator americanus'')APR-1タンパク質という抗原の優性エピトープを認識できるが、{{Ill2|鉤虫|en|鉤虫}}<!-- 英語版: Hookworm (ただし日本語版では[[有爪動物]]へのリダイレクトで、異なる生物を指していた) -->に対する防御を誘導することができない。ただし、APR-1タンパク質上の他の非優性エピトープは、鉤虫に対する中和抗体の産生を誘導する能力を発揮する。したがって、非優性エピトープは鉤虫症に対するペプチドワクチンのより良い候補である<ref>{{cite journal | vauthors = Pearson MS, Pickering DA, Tribolet L, Cooper L, Mulvenna J, Oliveira LM, Bethony JM, Hotez PJ, Loukas A | display-authors = 6 | title = Neutralizing antibodies to the hookworm hemoglobinase Na-APR-1: implications for a multivalent vaccine against hookworm infection and schistosomiasis | journal = The Journal of Infectious Diseases | volume = 201 | issue = 10 | pages = 1561–1569 | date = May 2010 | pmid = 20367477 | doi = 10.1086/651953 }}</ref>。 |
|||
* [[過敏症]]を考慮に入れる。例: 一部の[[IgE]]誘導エピトープは、鉤虫の抗原であるNa-ASP-2タンパク質の[[IgG]]エピトープと重複するため、ヒトの[[ワクチン接種]]後に過敏症反応を引き起こす<ref>{{cite journal | vauthors = Diemert DJ, Pinto AG, Freire J, Jariwala A, Santiago H, Hamilton RG, Periago MV, Loukas A, Tribolet L, Mulvenna J, Correa-Oliveira R, Hotez PJ, Bethony JM | display-authors = 6 | title = Generalized urticaria induced by the Na-ASP-2 hookworm vaccine: implications for the development of vaccines against helminths | journal = The Journal of Allergy and Clinical Immunology | volume = 130 | issue = 1 | pages = 169–76.e6 | date = July 2012 | pmid = 22633322 | doi = 10.1016/j.jaci.2012.04.027 }}</ref>。 |
|||
* 一部の単鎖ペプチドエピトープは、ネイティブ構造を維持するために伸長する必要がある。伸長された配列は、適切な[[二次構造]]を含むことができる。また、適切な[[コンフォメーション]]を維持するために、いくつかの単鎖ペプチドを一緒に安定化または環化することができる。例: [[B細胞]]エピトープは5つの[[アミノ酸]]しか含んでいない可能性がある。免疫応答を誘導するために、酵母{{Ill2|GCN4|en|GCN4}}タンパク質の配列を利用し、[[αヘリックス]]を形成することによってペプチドワクチンのコンフォメーションを改善する<ref>{{cite journal | vauthors = Cooper JA, Hayman W, Reed C, Kagawa H, Good MF, Saul A | title = Mapping of conformational B cell epitopes within alpha-helical coiled coil proteins | journal = Molecular Immunology | volume = 34 | issue = 6 | pages = 433–440 | date = April 1997 | pmid = 9307059 | doi = 10.1016/S0161-5890(97)00056-4 }}</ref>。 |
|||
* 免疫応答を誘導するためにエピトープに関連した[[アジュバント]]を用いる<ref>{{cite journal | vauthors = Azmi F, Ahmad Fuaad AA, Skwarczynski M, Toth I | title = Recent progress in adjuvant discovery for peptide-based subunit vaccines | journal = Human Vaccines & Immunotherapeutics | volume = 10 | issue = 3 | pages = 778–796 | date = March 2014 | pmid = 24300669 | pmc = 4130256 | doi = 10.4161/hv.27332 }}</ref>。 |
|||
== 応用例 == |
|||
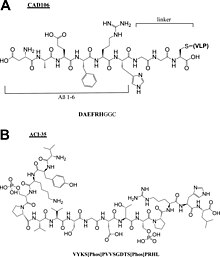
[[File:Cr9b00472_0009.jpg|thumb|アルツハイマー病ペプチドワクチンのペプチド成分の化学構造。(A) CAD106、(B) ACI-35<ref>{{cite journal | vauthors = Malonis RJ, Lai JR, Vergnolle O | title = Peptide-Based Vaccines: Current Progress and Future Challenges | journal = Chemical Reviews | volume = 120 | issue = 6 | pages = 3210–3229 | date = March 2020 | pmid = 31804810 | pmc = 7094793 | doi = 10.1021/acs.chemrev.9b00472 }}</ref>]] |
|||
=== 癌(がん) === |
|||
* {{Ill2|Gp100:209-217(210M)|en|Gp100:209-217(210M)|label=Gp100}}ペプチドワクチンは、[[メラノーマ]](悪性黒色腫)を治療するために研究されている。より大きな[[In vitro|''in vitro'']] [[細胞傷害性T細胞|CTL]]応答を得るために、ペプチドgp100:209-217(210M)を修飾し、HLA-A2*0201と結合させる。ワクチン接種後、より多くの循環[[T細胞]]が''in vitro''でメラノーマのがん細胞を認識し、これを殺滅することができる<ref>{{cite journal | vauthors = Marincola FM, Rivoltini L, Salgaller ML, Player M, Rosenberg SA | title = Differential anti-MART-1/MelanA CTL activity in peripheral blood of HLA-A2 melanoma patients in comparison to healthy donors: evidence of in vivo priming by tumor cells | journal = Journal of Immunotherapy with Emphasis on Tumor Immunology | volume = 19 | issue = 4 | pages = 266–277 | date = July 1996 | pmid = 8877721 | doi = 10.1097/00002371-199607000-00003 }}</ref>。 |
|||
* {{Ill2|リンドペピムート|en|Rindopepimut}}(''Rindopepimut'')は、[[膠芽腫|多形性膠芽腫]](GBM)を治療するための[[上皮成長因子受容体]](EGFR)由来のペプチドワクチンである。その14-merのペプチドは、{{Ill2|キーホールリンペットヘモシアニン|en|Keyhole limpet hemocyanin}}(KLH)と結合しており、がんのリスクを減らすことができる<ref>{{cite journal | vauthors = Neal DE, Sharples L, Smith K, Fennelly J, Hall RR, Harris AL | title = The epidermal growth factor receptor and the prognosis of bladder cancer | journal = Cancer | volume = 65 | issue = 7 | pages = 1619–1625 | date = April 1990 | pmid = 2311071 | doi = 10.1002/1097-0142(19900401)65:7<1619::aid-cncr2820650728>3.0.co;2-q }}</ref>。 |
|||
* E75、GP2、およびAE37は、乳がんを治療するための3種類の[[HER2/neu|HER2/''neu'']]由来の単一ペプチドワクチンである。健康な組織では通常、HER2/''neu''の発現レベルは低い。9個のアミノ酸からなるE75は、HER2タンパク質の免疫優性エピトープである。9個のアミノ酸からなるGP2は、亜優性エピトープである。E75とGP2は共に[[細胞傷害性T細胞|CD8+リンパ球]]を刺激するが、GP2はE75よりも低い親和性を持っている。AE37は[[ヘルパーT細胞|CD4+リンパ球]]を刺激する<ref>{{cite journal | vauthors = Palatnik-de-Sousa CB, Soares IS, Rosa DS | title = Editorial: Epitope Discovery and Synthetic Vaccine Design | journal = Frontiers in Immunology | volume = 9 | pages = 826 | date = 2018-04-18 | pmid = 29720983 | pmc = 5915546 | doi = 10.3389/fimmu.2018.00826 | doi-access = free }}</ref>。 |
|||
=== その他の一般的な疾患 === |
|||
* [[EpiVacCorona]]は、[[SARSコロナウイルス2|COVID-19]]に対するペプチドベースのワクチンである。 |
|||
* IC41は、[[C型肝炎ウイルス]]に対するペプチドワクチン候補である。これは、ポリ-l-アルギニンと呼ばれる合成アジュバントとともに、5個の合成ペプチドで構成されている<ref>{{cite journal | vauthors = Firbas C, Jilma B, Tauber E, Buerger V, Jelovcan S, Lingnau K, Buschle M, Frisch J, Klade CS | display-authors = 6 | title = Immunogenicity and safety of a novel therapeutic hepatitis C virus (HCV) peptide vaccine: a randomized, placebo controlled trial for dose optimization in 128 healthy subjects | journal = Vaccine | volume = 24 | issue = 20 | pages = 4343–4353 | date = May 2006 | pmid = 16581161 | doi = 10.1016/j.vaccine.2006.03.009 }}</ref>。 |
|||
* Multimeric-001は、[[インフルエンザ]]に対する最も効率的なペプチドワクチン候補である。これは、[[ヘマグルチニン]]由来のB細胞エピトープとT細胞エピトープを含んでいる。Matrix Iと[[核タンパク質]]は、単一の組換え発現ポリペプチドに結合される<ref>{{cite journal | vauthors = Atsmon J, Caraco Y, Ziv-Sefer S, Shaikevich D, Abramov E, Volokhov I, Bruzil S, Haima KY, Gottlieb T, Ben-Yedidia T | display-authors = 6 | title = Priming by a novel universal influenza vaccine (Multimeric-001)-a gateway for improving immune response in the elderly population | journal = Vaccine | volume = 32 | issue = 44 | pages = 5816–5823 | date = October 2014 | pmid = 25173483 | doi = 10.1016/j.vaccine.2014.08.031 }}</ref><ref>{{cite journal | vauthors = van Doorn E, Liu H, Ben-Yedidia T, Hassin S, Visontai I, Norley S, Frijlink HW, Hak E | display-authors = 6 | title = Evaluating the immunogenicity and safety of a BiondVax-developed universal influenza vaccine (Multimeric-001) either as a standalone vaccine or as a primer to H5N1 influenza vaccine: Phase IIb study protocol | journal = Medicine | volume = 96 | issue = 11 | pages = e6339 | date = March 2017 | pmid = 28296763 | doi = 10.1097/md.0000000000006339 | pmc = 5369918 }}</ref>。 |
|||
* [[アルツハイマー病]]ペプチドワクチン: CAD106<ref>{{cite journal | vauthors = Wiessner C, Wiederhold KH, Tissot AC, Frey P, Danner S, Jacobson LH, Jennings GT, Lüönd R, Ortmann R, Reichwald J, Zurini M, Mir A, Bachmann MF, Staufenbiel M | display-authors = 6 | title = The second-generation active Aβ immunotherapy CAD106 reduces amyloid accumulation in APP transgenic mice while minimizing potential side effects | journal = The Journal of Neuroscience | volume = 31 | issue = 25 | pages = 9323–9331 | date = June 2011 | pmid = 21697382 | doi = 10.1523/jneurosci.0293-11.2011|pmc=6623465 }}</ref>, UB311<ref>{{cite journal | vauthors = Wang CY, Finstad CL, Walfield AM, Sia C, Sokoll KK, Chang TY, Fang XD, Hung CH, Hutter-Paier B, Windisch M | display-authors = 6 | title = Site-specific UBITh amyloid-beta vaccine for immunotherapy of Alzheimer's disease | journal = Vaccine | volume = 25 | issue = 16 | pages = 3041–3052 | date = April 2007 | pmid = 17287052 | doi = 10.1016/j.vaccine.2007.01.031 }}</ref>, Lu AF20513<ref>{{cite journal | vauthors = Davtyan H, Ghochikyan A, Petrushina I, Hovakimyan A, Davtyan A, Poghosyan A, Marleau AM, Movsesyan N, Kiyatkin A, Rasool S, Larsen AK, Madsen PJ, Wegener KM, Ditlevsen DK, Cribbs DH, Pedersen LO, Agadjanyan MG | display-authors = 6 | title = Immunogenicity, efficacy, safety, and mechanism of action of epitope vaccine (Lu AF20513) for Alzheimer's disease: prelude to a clinical trial | journal = The Journal of Neuroscience | volume = 33 | issue = 11 | pages = 4923–4934 | date = March 2013 | pmid = 23486963 | doi = 10.1523/jneurosci.4672-12.2013|pmc=3634356 }}</ref>, ABvac40<ref>{{cite journal | vauthors = Lacosta AM, Pascual-Lucas M, Pesini P, Casabona D, Pérez-Grijalba V, Marcos-Campos I, Sarasa L, Canudas J, Badi H, Monleón I, San-José I, Munuera J, Rodríguez-Gómez O, Abdelnour C, Lafuente A, Buendía M, Boada M, Tárraga L, Ruiz A, Sarasa M | display-authors = 6 | title = Safety, tolerability and immunogenicity of an active anti-Aβ<sub>40</sub> vaccine (ABvac40) in patients with Alzheimer's disease: a randomised, double-blind, placebo-controlled, phase I trial | journal = Alzheimer's Research & Therapy | volume = 10 | issue = 1 | pages = 12 | date = January 2018 | pmid = 29378651 | doi = 10.1002/alz.045720 | pmc = 5789644 }}</ref>, ACI-35<ref>{{cite journal | vauthors = Hickman DT, López-Deber MP, Ndao DM, Silva AB, Nand D, Pihlgren M, Giriens V, Madani R, St-Pierre A, Karastaneva H, Nagel-Steger L, Willbold D, Riesner D, Nicolau C, Baldus M, Pfeifer A, Muhs A | display-authors = 6 | title = Sequence-independent control of peptide conformation in liposomal vaccines for targeting protein misfolding diseases | journal = The Journal of Biological Chemistry | volume = 286 | issue = 16 | pages = 13966–13976 | date = April 2011 | pmid = 21343310 | doi = 10.1074/jbc.m110.186338 | pmc=3077597 | doi-access = free }}</ref>, AADvac-1<ref>{{cite journal | vauthors = Kontsekova E, Zilka N, Kovacech B, Novak P, Novak M | title = First-in-man tau vaccine targeting structural determinants essential for pathological tau-tau interaction reduces tau oligomerisation and neurofibrillary degeneration in an Alzheimer's disease model | journal = Alzheimer's Research & Therapy | volume = 6 | issue = 4 | pages = 44 | date = 2014 | pmid = 25478017 | doi = 10.1186/alzrt278|pmc=4255368 }}</ref>。 |
|||
== 関連項目 == |
|||
* [[免疫化]] - ある物質(免疫原と呼ばれる)に対して個人の免疫系を強化する過程 |
|||
== 脚注 == |
== 脚注 == |
||
{{Reflist}} |
{{Reflist}} |
||
[[Category:ペプチドワクチン]] |
|||
[[Category:免疫学]] |
[[Category:免疫学]] |
||
[[Category:ワクチン]] |
[[Category:ワクチン]] |
||
2022年6月30日 (木) 20:41時点における版
ペプチドベース合成ワクチン(英: Peptide-based synthetic vaccines)は、エピトープワクチン(英: epitope vaccines)とも呼ばれ、ペプチドから作られたサブユニットワクチンである。そのペプチドは、直接または潜在的に免疫応答を引き起こす抗原のエピトープを模倣している[1]。ペプチドワクチンは、感染性病原体や非感染性疾患に対する防御を誘導するだけでなく、腫瘍関連抗原に由来するペプチドを用いて、効果的な抗腫瘍T細胞応答を誘導する治療用がんワクチンとしても利用することもできる[2]。
歴史
従来のワクチンは、生きている病原体または固定化した病原体全体である。第2世代のワクチンは、主に病原体から精製されたタンパク質である。第3世代のワクチンは、病原体のタンパク質を発現させるDNAやプラスミドである。ペプチドワクチンは、ワクチンの進化における最新の世代である[3]。
長所と短所
ペプチドワクチンは、固定化した病原体全体やタンパク質分子を用いた従来のワクチンと比較して、いくつかの長所と短所がある[4]。
長所
- ワクチンは化学合成によって完全に合成され、化学物質として扱うことができる。
- 自動化やマイクロ波技術を使用したより高度なペプチド固相合成法(SPPS)によって、ペプチドをより効率的に生産できる。
- ワクチンは化学的に合成されるため、生物汚染はない。
- ワクチンは水溶性であり、簡単な条件下で安定に保存するこができる。
- ペプチドに特異性を持たせるために特別に設計することができる。たとえば、単一のペプチドワクチンに複数のエピトープを持たせ、いくつかの疾患に対する免疫応答を持つような設計ができる。
- ワクチンは短いペプチド鎖しか含まないため、アレルギー反応や自己免疫応答を引き起こす可能性は低くなる。
短所
エピトープの設計
ペプチドワクチン全体は抗原のエピトープを模倣するものであるため、エピトープの設計はワクチン開発の最も重要な段階であり、目的の免疫原性タンパク質のアミノ酸配列に対する正確な理解が必要である。設計されたエピトープは、病原体に対して強力で長期間の免疫応答を起こすことが期待される。エピトープを設計する際に考慮すべき事項は次の通りである。
- 非優性エピトープは、優性エピトープよりも強い免疫応答を引き起こす可能性がある。例: 鉤虫に感染した人の抗体は、アメリカ鉤虫(Necator americanus)APR-1タンパク質という抗原の優性エピトープを認識できるが、鉤虫に対する防御を誘導することができない。ただし、APR-1タンパク質上の他の非優性エピトープは、鉤虫に対する中和抗体の産生を誘導する能力を発揮する。したがって、非優性エピトープは鉤虫症に対するペプチドワクチンのより良い候補である[5]。
- 過敏症を考慮に入れる。例: 一部のIgE誘導エピトープは、鉤虫の抗原であるNa-ASP-2タンパク質のIgGエピトープと重複するため、ヒトのワクチン接種後に過敏症反応を引き起こす[6]。
- 一部の単鎖ペプチドエピトープは、ネイティブ構造を維持するために伸長する必要がある。伸長された配列は、適切な二次構造を含むことができる。また、適切なコンフォメーションを維持するために、いくつかの単鎖ペプチドを一緒に安定化または環化することができる。例: B細胞エピトープは5つのアミノ酸しか含んでいない可能性がある。免疫応答を誘導するために、酵母GCN4タンパク質の配列を利用し、αヘリックスを形成することによってペプチドワクチンのコンフォメーションを改善する[7]。
- 免疫応答を誘導するためにエピトープに関連したアジュバントを用いる[8]。
応用例
癌(がん)
- Gp100ペプチドワクチンは、メラノーマ(悪性黒色腫)を治療するために研究されている。より大きなin vitro CTL応答を得るために、ペプチドgp100:209-217(210M)を修飾し、HLA-A2*0201と結合させる。ワクチン接種後、より多くの循環T細胞がin vitroでメラノーマのがん細胞を認識し、これを殺滅することができる[10]。
- リンドペピムート(Rindopepimut)は、多形性膠芽腫(GBM)を治療するための上皮成長因子受容体(EGFR)由来のペプチドワクチンである。その14-merのペプチドは、キーホールリンペットヘモシアニン(KLH)と結合しており、がんのリスクを減らすことができる[11]。
- E75、GP2、およびAE37は、乳がんを治療するための3種類のHER2/neu由来の単一ペプチドワクチンである。健康な組織では通常、HER2/neuの発現レベルは低い。9個のアミノ酸からなるE75は、HER2タンパク質の免疫優性エピトープである。9個のアミノ酸からなるGP2は、亜優性エピトープである。E75とGP2は共にCD8+リンパ球を刺激するが、GP2はE75よりも低い親和性を持っている。AE37はCD4+リンパ球を刺激する[12]。
その他の一般的な疾患
- EpiVacCoronaは、COVID-19に対するペプチドベースのワクチンである。
- IC41は、C型肝炎ウイルスに対するペプチドワクチン候補である。これは、ポリ-l-アルギニンと呼ばれる合成アジュバントとともに、5個の合成ペプチドで構成されている[13]。
- Multimeric-001は、インフルエンザに対する最も効率的なペプチドワクチン候補である。これは、ヘマグルチニン由来のB細胞エピトープとT細胞エピトープを含んでいる。Matrix Iと核タンパク質は、単一の組換え発現ポリペプチドに結合される[14][15]。
- アルツハイマー病ペプチドワクチン: CAD106[16], UB311[17], Lu AF20513[18], ABvac40[19], ACI-35[20], AADvac-1[21]。
関連項目
- 免疫化 - ある物質(免疫原と呼ばれる)に対して個人の免疫系を強化する過程
脚注
- ^ “Peptide-based synthetic vaccines”. Chemical Science 7 (2): 842–854. (February 2016). doi:10.1039/C5SC03892H. PMC 5529997. PMID 28791117.
- ^ “Immunotherapy of established (pre)malignant disease by synthetic long peptide vaccines”. Nature Reviews. Cancer 8 (5): 351–360. (May 2008). doi:10.1038/nrc2373. PMID 18418403.
- ^ “Peptide-Based Cancer Vaccine Strategies and Clinical Results”. Vaccine Design. Methods in Molecular Biology, Vaccine Design: Methods and Protocols: Volume 1: Vaccines for Human Diseases. 1403. New York, NY: Springer. (2016). 797–817. doi:10.1007/978-1-4939-3387-7_46. ISBN 978-1-4939-3387-7. PMID 27076168
- ^ “Peptide-based synthetic vaccines”. Chemical Science 7 (2): 842–854. (February 2016). doi:10.1039/C5SC03892H. PMC 5529997. PMID 28791117.
- ^ “Neutralizing antibodies to the hookworm hemoglobinase Na-APR-1: implications for a multivalent vaccine against hookworm infection and schistosomiasis”. The Journal of Infectious Diseases 201 (10): 1561–1569. (May 2010). doi:10.1086/651953. PMID 20367477.
- ^ “Generalized urticaria induced by the Na-ASP-2 hookworm vaccine: implications for the development of vaccines against helminths”. The Journal of Allergy and Clinical Immunology 130 (1): 169–76.e6. (July 2012). doi:10.1016/j.jaci.2012.04.027. PMID 22633322.
- ^ “Mapping of conformational B cell epitopes within alpha-helical coiled coil proteins”. Molecular Immunology 34 (6): 433–440. (April 1997). doi:10.1016/S0161-5890(97)00056-4. PMID 9307059.
- ^ “Recent progress in adjuvant discovery for peptide-based subunit vaccines”. Human Vaccines & Immunotherapeutics 10 (3): 778–796. (March 2014). doi:10.4161/hv.27332. PMC 4130256. PMID 24300669.
- ^ “Peptide-Based Vaccines: Current Progress and Future Challenges”. Chemical Reviews 120 (6): 3210–3229. (March 2020). doi:10.1021/acs.chemrev.9b00472. PMC 7094793. PMID 31804810.
- ^ “Differential anti-MART-1/MelanA CTL activity in peripheral blood of HLA-A2 melanoma patients in comparison to healthy donors: evidence of in vivo priming by tumor cells”. Journal of Immunotherapy with Emphasis on Tumor Immunology 19 (4): 266–277. (July 1996). doi:10.1097/00002371-199607000-00003. PMID 8877721.
- ^ “The epidermal growth factor receptor and the prognosis of bladder cancer”. Cancer 65 (7): 1619–1625. (April 1990). doi:10.1002/1097-0142(19900401)65:7<1619::aid-cncr2820650728>3.0.co;2-q. PMID 2311071.
- ^ “Editorial: Epitope Discovery and Synthetic Vaccine Design”. Frontiers in Immunology 9: 826. (2018-04-18). doi:10.3389/fimmu.2018.00826. PMC 5915546. PMID 29720983.
- ^ “Immunogenicity and safety of a novel therapeutic hepatitis C virus (HCV) peptide vaccine: a randomized, placebo controlled trial for dose optimization in 128 healthy subjects”. Vaccine 24 (20): 4343–4353. (May 2006). doi:10.1016/j.vaccine.2006.03.009. PMID 16581161.
- ^ “Priming by a novel universal influenza vaccine (Multimeric-001)-a gateway for improving immune response in the elderly population”. Vaccine 32 (44): 5816–5823. (October 2014). doi:10.1016/j.vaccine.2014.08.031. PMID 25173483.
- ^ “Evaluating the immunogenicity and safety of a BiondVax-developed universal influenza vaccine (Multimeric-001) either as a standalone vaccine or as a primer to H5N1 influenza vaccine: Phase IIb study protocol”. Medicine 96 (11): e6339. (March 2017). doi:10.1097/md.0000000000006339. PMC 5369918. PMID 28296763.
- ^ “The second-generation active Aβ immunotherapy CAD106 reduces amyloid accumulation in APP transgenic mice while minimizing potential side effects”. The Journal of Neuroscience 31 (25): 9323–9331. (June 2011). doi:10.1523/jneurosci.0293-11.2011. PMC 6623465. PMID 21697382.
- ^ “Site-specific UBITh amyloid-beta vaccine for immunotherapy of Alzheimer's disease”. Vaccine 25 (16): 3041–3052. (April 2007). doi:10.1016/j.vaccine.2007.01.031. PMID 17287052.
- ^ “Immunogenicity, efficacy, safety, and mechanism of action of epitope vaccine (Lu AF20513) for Alzheimer's disease: prelude to a clinical trial”. The Journal of Neuroscience 33 (11): 4923–4934. (March 2013). doi:10.1523/jneurosci.4672-12.2013. PMC 3634356. PMID 23486963.
- ^ “Safety, tolerability and immunogenicity of an active anti-Aβ40 vaccine (ABvac40) in patients with Alzheimer's disease: a randomised, double-blind, placebo-controlled, phase I trial”. Alzheimer's Research & Therapy 10 (1): 12. (January 2018). doi:10.1002/alz.045720. PMC 5789644. PMID 29378651.
- ^ “Sequence-independent control of peptide conformation in liposomal vaccines for targeting protein misfolding diseases”. The Journal of Biological Chemistry 286 (16): 13966–13976. (April 2011). doi:10.1074/jbc.m110.186338. PMC 3077597. PMID 21343310.
- ^ “First-in-man tau vaccine targeting structural determinants essential for pathological tau-tau interaction reduces tau oligomerisation and neurofibrillary degeneration in an Alzheimer's disease model”. Alzheimer's Research & Therapy 6 (4): 44. (2014). doi:10.1186/alzrt278. PMC 4255368. PMID 25478017.
