デンドラレン
デンドラレン (dendralene) は交差共役構造を持った非環式ポリエンである[1][2][3]。最も単純なデンドラレンは1,3-ブタジエン (1) ([2]デンドラレン)であり、以降は[3]デンドラレン (2)、[4]デンドラレン (3)、[5]デンドラレン (4) と続く。ブタジエンは交差共役構造を持たない唯一のデンドラレンである。
比較的単純な前駆体からディールス・アルダー反応によって新たな有機化合物を合成できるため、長鎖のデンドラレンは科学的興味の対象となっている。環状構造を持つ類縁体についてはラジアレンと呼ぶのが適当である。
合成[編集]
ビニルブタジエン([3]デンドラレン)は1955年、三酢酸エステル化合物の熱分解によって合成された[4][5]。

この化合物は2当量の無水マレイン酸とタンデム型ディールス・アルダー反応を起こす[6]。
ベンゾキノンを用いると、反応物は直鎖状のポリマーとなる。
[3]デンドラレン誘導体の合成経路はいくつか報告されており、アレンを用いたもの[7]、ホーナー・ワズワース・エモンズ反応を用いたもの[8]、クロスカップリング反応を用いたもの[9]、炭酸アリルエステルを用いたもの[10]等がある。
クロロプレンを用いた[4]デンドラレンの合成経路がある[11]。クロロプレンをマグネシウムと反応させグリニャール試薬とし、これを塩化銅(I)と反応させて有機銅中間体とする。塩化銅(II)を用いた酸化的カップリングによって中間体を二量化させることで[4]デンドラレンが得られる。
気相における[4]デンドラレンの構造が報告されている[12]。
2009年には、熊田・玉尾・コリューカップリングの後に根岸カップリングを行うことによる[8]デンドラレンの合成が報告された[13]。
2016年には一連の [9] から [12]デンドラレンの合成が報告されている[14]。
性質[編集]
偶数のアルケン単位を有するデンドラレン([6]、[8]デンドラレン等)は孤立したジエン単位の鎖として振る舞う傾向があり、紫外域における最大吸収波長はブタジエンと等しい。これに対し、奇数単位のデンドラレンはs-cis配座を取りやすいジエンが存在することから反応性が高く、末端選択的なディールス・アルダー反応が起こりやすい。
反応[編集]
単純なジエノフィルを用いたディールス・アルダー反応によって、デンドラレンから複雑な分子を素早く構築する反応スキームがいくつか報告されている[11][15][16][17][18][19][20][21][22]。
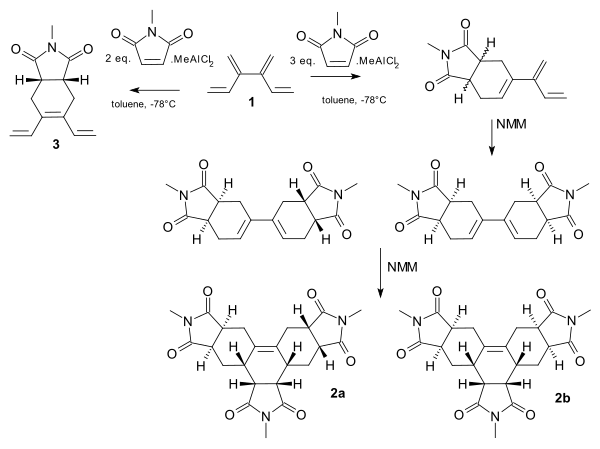
[4]デンドラレンはジエノフィルであるN-メチルマレイミド(NMM)とタンデム型ディールス・アルダー反応を起こす[11]。ルイス酸であるメチルアルミニウムジクロリドを用いることで完全な位置選択性を達成することが可能で、2当量のNMMと混合したものを用いればモノ付加体 (3)、3当量と混合したものを用いれば末端へのモノ付加体から続く反応によってトリス付加体 (2a, 2b) が得られる。
[6]デンドラレンまでは、シモンズ・スミス反応(ジエチル亜鉛/トリフルオロ酢酸)を用いたシクロプロパン化によってアイビアン (ivyane) と呼ばれる化合物群に変換できることが報告されている[23]。これらの1,1-オリゴシクロプロパンは(酸に曝露された場合を除き)安定で、[6]アイビアンはキュバンを超える大きな燃焼熱を有する。このオリゴシクロプロパン鎖はらせん構造を取る。
[3]デンドラレンに関しては光環化反応が報告されている[24]。
誘導体[編集]
2環性の[4]デンドラレン化合物が報告されている[25]。
脚注[編集]
- ^ Henning Hopf, Classics in Hydrocarbon Chemistry, Wiley VCH, 2000.
- ^ Hopf, H.; Sherburn, M. S. (2012). “Dendralenes Branch Out: Cross-Conjugated Oligoenes Allow the Rapid Generation of Molecular Complexity”. Angew. Chem. Int. Ed. 51: 2298–2338. doi:10.1002/anie.201102987.
- ^ Sherburn, M. S. (2015). “Preparation and Synthetic Value of π-Bond-Rich Branched Hydrocarbons”. Acc. Chem. Res. 48 (7): 1961-1970. doi:10.1021/acs.accounts.5b00242.
- ^ Bailey, William J.; Economy, James (1955). “Pyrolysis of Esters. III. Synthesis of 2-Vinylbutadiene”. J. Am. Chem. Soc. 77 (5): 1133–1136. doi:10.1021/ja01610a014.
- ^ Blomquist, A. T.; Verdol, Joseph A. (1955). “2-Vinyl-1,3-butadiene”. J. Am. Chem. Soc. 77 (1): 81–83. doi:10.1021/ja01606a025.
- ^ Bailey, William J.; Economy, James; Hermes, Mathew E. (1962). “Polymers. IV. Polymeric Diels-Alder Reactions”. J. Org. Chem. 27 (9): 3295–3299. doi:10.1021/jo01056a074.
- ^ Arisawa, M.; Sugihara, T.; Yamaguchi, M. (1998). “Synthesis of cross-conjugated trienes by dimerization of allenes with palladium-phenol catalyst”. Chem. Commun.: 2615-2616. doi:10.1039/A807527A.
- ^ Singh, R.; Ghosh, S. K. (2011). “Synthesis of substituted [3]dendralenes and their unique cycloaddition reactions”. Chem. Commun. 47 (38): 10809-10811. doi:10.1039/C1CC14211A. PMID 21874204.
- ^ Bradford, T. A.; Payne, A. D.; Willis, A. C.; Paddon-Row, M. N.; Sherburn, M. S. (2007). “Cross-Coupling for Cross-Conjugation:? Practical Synthesis and Diels?Alder Reactions of [3]Dendralenes”. Org. Lett. 9 (23): 4861–4864. doi:10.1021/ol7021998.
- ^ Beydoun K, Zhang HJ, Sundararaju B, Demerseman B, Achard M, Xi Z, Bruneau C (2009). “Efficient ruthenium-catalyzed synthesis of [3]dendralenes from 1,3-dienic allylic carbonates”. Chem. Commun. (43): 6580-6582. doi:10.1039/B913595B. PMID 19865656.
- ^ a b c Payne, A. D.; Willis, A. C.; Sherburn, M. S. (2005). “Practical Synthesis and Diels−Alder Chemistry of [4]Dendralene”. J. Am. Chem. Soc. 127 (35): 12188–12189. doi:10.1021/ja053772+. ISSN 0002-7863. PMID 16131173.
- ^ Brain, P. T.; Smart, B. A.; Robertson, H. E.; Davis,M. J.; Rankin, D. W. H.; Henry, W. J.; Gosney, I. (1997). “Molecular Structure of 3,4-Dimethylenehexa-1,5-diene ([4]Dendralene), C8H10, in the Gas Phase As Determined by Electron Diffraction and ab Initio Calculations”. J. Org. Chem. 62 (9): 2767-2773. doi:10.1021/jo962091h.
- ^ Payne AD, Bojase G, Paddon-Row MN, Sherburn MS (2009). “Practical Synthesis of the Dendralene Family Reveals Alternation in Behavior”. Angew. Chem. Int. Ed. 48 (26): 4836-4839. doi:10.1002/anie.200901733. PMID 19455528.
- ^ Saglam MF, Fallon T, Paddon-Row MN, Sherburn MS (2016). “Discovery and Computational Rationalization of Diminishing Alternation in [n]Dendralenes”. J. Am. Chem. Soc. 138 (3): 1022-1032. doi:10.1021/jacs.5b11889. PMID 26721640.
- ^ Brummond, Kay M.; You, Lingfeng (2005). “Consecutive Rh(I)-catalyzed Alder-ene/Diels–Alder/Diels–Alder reaction sequence affording rapid entry to polycyclic compounds”. Tetrahedron 61 (26): 6180–6185. doi:10.1016/j.tet.2005.03.141.
- ^ Hopf, H.; Yildizhan, Ş. (2011). “Highly Functionalized, Angularly Anellated Aromatic Compounds from Dendralenes”. Eur. J. Org. Chem. 2011: 2029–2034. doi:10.1002/ejoc.201001536.
- ^ Kobayashi, S.; Furuya, T.; Otani, T.; Saito, T. (2008). “A novel and facile stereocontrolled synthetic method for polyhydro-quinolines and pyridopyridazines via a diene-transmissive Diels–Alder reaction involving inverse electron-demand hetero Diels–Alder cycloaddition of cross-conjugated azatrienes”. Tetrahedron 64 (41): 9705-9716. doi:10.1016/j.tet.2008.07.102.
- ^ Pronin, S. V.; Shenvi, R. A. (2012). “Synthesis of a Potent Antimalarial Amphilectene”. J. Am. Chem. Soc. 134 (48): 19604-19606. doi:10.1021/ja310129b. PMID 23153381.
- ^ Green, N. J.; Lawrence, A. L.; Bojase, G.; Willis, A. C.; Paddon-Row, M. N.; Sherburn, M. S. (2013). “Domino Cycloaddition Organocascades of Dendralenes”. Angew. Chem. Int. Ed. 52: 8333–8336. doi:10.1002/anie.201302185.
- ^ Bradford, T. A.; Payne, A. D.; Willis, A. C.; Paddon-Row, M. N.; Sherburn, M. S. (2010). “Practical Synthesis and Reactivity of [3]Dendralene”. J. Org. Chem. 75 (2): 491-494. doi:10.1021/jo9024557.
- ^ Tan, S. M.; Willis, A. C.; Paddon-Row, M. N.; Sherburn, M. S. (2016). “Multicomponent Diene-Transmissive Diels–Alder Sequences Featuring Aminodendralenes”. Angew. Chem. Int. Ed. 55 (9): 3081-3085. doi:10.1002/anie.201510925. PMID 26823233.
- ^ Saglam, M. F.; Alborzi, A. R.; Payne, A. D.; Willis, A. C.; Paddon-Row, M. N.; Sherburn, M. S. (2016). “Synthesis and Diels–Alder Reactivity of Substituted [4]Dendralenes”. J. Org. Chem. 81 (4): 1461-1475. doi:10.1021/acs.joc.5b02583.
- ^ Bojase, G.; Nguyen, T. V.; Payne, A. D.; Willis, A. C.; Sherburn, M. S. (2011). “Synthesis and properties of the ivyanes: the parent 1,1-oligocyclopropanes”. Chem. Sci. 2: 229–232. doi:10.1039/C0SC00500B.
- ^ Okada, K.; Maehara, K.; Oda, M. (1994). “A novel photochemical reaction of [3]dendralene derivatives”. Tetrahedron Lett. 35 (29): 5251–5252. doi:10.1016/S0040-4039(00)77076-6.
- ^ Kosai, T.; Ishida, S.; Iwamoto, T. (2015). “Transformation of azulenes to bicyclic [4]dendralene and heptafulvene derivatives via photochemical cycloaddition of dialkylsilylene”. Chem. Commun. 51: 10707-10709. doi:10.1039/C5CC03424H. PMID 26050797.



![[4]dendralene synthetic scheme from chloroprene](http://upload.wikimedia.org/wikipedia/commons/thumb/4/40/4-dendralene.svg/569px-4-dendralene.svg.png)
![[8]-dendralene synthesis](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9d/8-dendralene.svg/411px-8-dendralene.svg.png)