酢酸アリル
| 酢酸アリル | |
|---|---|

| |

| |
Prop-2-en-1-yl acetate | |
別称 2-Propenyl acetate | |
| 識別情報 | |
| CAS登録番号 | 591-87-7 |
| PubChem | 11584 |
| ChemSpider | 13862665 |
| |
| 特性 | |
| 化学式 | C5H8O2 |
| モル質量 | 100.12 g mol−1 |
| 外観 | 無色液体 |
| 密度 | 0.928 g/cm3 |
| 沸点 |
103°C |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H225, H301, H312, H319, H330 |
| Pフレーズ | P210, P233, P240, P241, P242, P243, P260, P264, P270, P271, P280, P284, P301+310, P302+352 |
| 発火点 | 374°C |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
酢酸アリル (さくさんアリル、Allyl acetate) は、化学式 CH2=CHCH2OCOCH3 で表される有機化合物である。無色の液体で、有用な工業用中間体であるアリルアルコールの前駆体である。アリルアルコールの酢酸エステルである。
製造[編集]
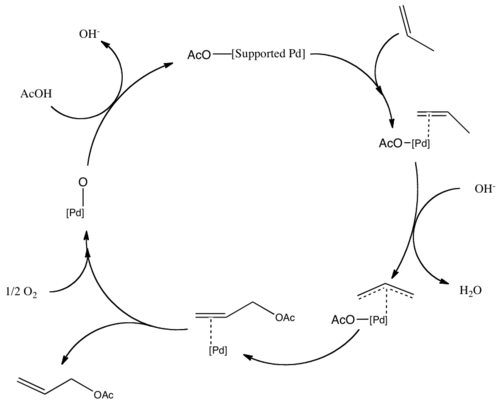
酢酸アリルは、工業的に酢酸の存在下パラジウム触媒を使用してプロペンの気相反応で生産される[1][2]。
- C3H6 + CH3COOH + ½ O2 → CH2=CHCH2OCOCH3 + H2O
この方法は、プロペンが安価で”グリーン”であるため有利である。アリルアルコールも主に塩化アリルから製造されるが、酢酸アリル経路の加水分解による製造は塩素の使用を回避するため、使用が増加している。
酢酸ビニルも同様に、プロペンの代わりにエチレンを使用して製造される。これらの反応はアセトキシル化の例である。次に、パラジウム中心は、存在するO2によって再酸化される。アセトキシル化のメカニズムは同様の経路をたどり、プロペンはパラジウム上にπ-アリル結合を形成する[3]。
反応と応用[編集]
酢酸アリルは加水分解してアリルアルコールにすることができる。
- CH2=CHCH2OCOCH3 + H2O → CH2=CHCH2OH + CH3COOH
アリルアルコールは、主に乾性油用の一部の特殊ポリマーの前駆体である。アリルアルコールは、合成グリセロールの前駆体でもある。過酸化水素によるエポキシ化によりグリシドールが生成され、これが加水分解されてグリセロールになる。
- CH2=CHCH2OH + HOOH → CH2OCHCH2OH + H2O
- CH2OCHCH2OH + H2O → C3H5(OH)3
合成グリセリンは化粧品やトイレタリーに使用される傾向があるが、脂肪の加水分解によるグリセリンは食品に使用される[4]。
置換反応[編集]
塩化水素を使用して酢酸アリルの酢酸基を置換すると、塩化アリルが得られる。塩化水素を使用して酢酸アリルの酢酸基を置換すると、塩化アリルが得られる[5]。
- CH2=CHCH2OCOCH3 + HCl → CH2=CHCH2Cl + CH3COOH
- CH2=CHCH2OCOCH3 + HCN → CH2=CHCH2CN + CH3COOH
塩化アリルは通常、プロペンの塩素化によって直接生成される。
脚注[編集]
- ^ Harold Wittcoff; B. G. Reuben; Jeffrey S. Plotkin (2004) (Google Books excerpt). Industrial organic chemicals. p. 212. ISBN 978-0-471-54036-6
- ^ Ludger Krähling; Jürgen Krey; Gerald Jakobson; Johann Grolig; Leopold Miksche (2002). "Allyl Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_425. ISBN 978-3527306732。
- ^ M. R. Churchill; R. Mason (1964). “Molecular Structure of π-allyl-palladium acetate”. Nature 4960 (4960): 777. doi:10.1038/204777a0.
- ^ H. A. Wittcoff; B. G. Reuben; J. S. Plotkin (2004). “Chemicals and Polymers from Propylene”. Industrial Organic Chemicals. pp. 195–214. ISBN 978-0-471-44385-8
- ^ Ludger Krahling (2000). “Allyl Compounds”. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a01_425.