ホール・エルー法
ホール・エルー法(ホール・エルーほう、Hall–Héroult process)は、唯一実用化されているアルミニウムの製錬方法。溶融させた原料を電気分解させることで目的物質を得る溶融塩電解の代表例である[1]。1886年にアメリカのチャールズ・マーティン・ホールとフランスのポール・エルーによりそれぞれ独自に開発された[2]。
歴史[編集]
ホール・エルー法以前、金属アルミニウムは鉱石を金属ナトリウムもしくはカリウムと共に真空中で加熱することによって得られていた。その方法は複雑で、当時高価であった原料を消費していたこともあり製造コストが非常に高く、19世紀前半にはアルミニウムは金や白金よりも高価であった。1855年のパリ万国博覧会ではアルミニウムの延棒がフランスの戴冠用宝玉と共に展示されており「粘土から得た銀」として注目された。また、フランス皇帝ナポレオン3世はアルミニウム製の食器を少数の重要な来賓にのみ使用していたといわれている[3]。カストナー法の開発による金属ナトリウムの製造コスト低減などによってアルミニウムの製造コストも低減されていったが[4]、それでもワシントン記念塔の冠石にアルミニウムが採用された当時のアルミニウムは銀よりも高価であった[5]。
ホール・エルー法は1886年のほぼ同時期に、アメリカの化学者チャールズ・マーティン・ホールとフランスのポール・エルーによってそれぞれ独自に開発された。ホール・エルー法では多量の電気を消費するが、ホール・エルー法が開発されたのと同時期にヴェルナー・フォン・ジーメンスによって実用的な発電機が発明されて大量の電気が供給可能になったことや、1888年にホール・エルー法の原料となる酸化アルミニウムの工業的製法であるバイヤー法がオーストリアの化学者カール・ヨーゼフ・バイヤーによって開発されたことで、ホール・エルー法が実用化可能になった[6][7][8]。1888年、ホールはピッツバーグで初の大規模なアルミニウム製造工場を始め、それは後にアルミニウム製造の世界的なメーカーであるアルコア社となった[9]。
ホール・エルー法に変わる新たなアルミニウム製造技術の開発も行われているがいずれも商用化には至っておらず、現在でもアルミニウムの工業生産にはホール・エルー法が利用されている[10]。1997年、ホール・エルー法はアルミニウム製造の商業化における重要性を認められ、アメリカ化学会よりNational Historic Chemical Landmarkに認定された[11]。
電極の消耗のほか多量の電力を要するため、発電のためにも大量の二酸化炭素が放出された。電力需要の高まりからか、1980年代には半分以上が水力発電で製造されていたのに2010年代後期には60%が石炭火力発電で賄われるようになり、[12]製造により生じる二酸化炭素の大半が電極ではなく発電で生じるようになった。2012年には、アルミニウムの製造1トン当たり12.7トンの二酸化炭素が排出されたと見積もられている[13]。
方法[編集]
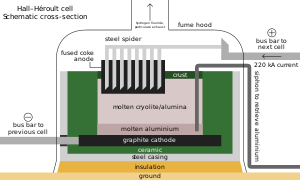
ホール・エルー法では、まず融剤として氷晶石(現在は蛍石から合成できるヘキサフルオロアルミン酸ナトリウムの合成品が用いられている)とフッ化ナトリウムを電解炉により1000°Cほどで融解する[注 1]。そして、ボーキサイトからバイヤー法によって99.95%まで精錬された酸化アルミニウムを5%程度入れて溶解させ、炭素電極で電気分解を行う。分解されたアルミニウムは融けて陰極に溜まり、酸素は陽極と反応して二酸化炭素となるが、800°C以上では炭素電極とさらに反応して一酸化炭素となる。
全体としての化学反応は以下のとおり。
ここで生成したアルミニウムは一部が電解層に溶解し、二酸化炭素と反応して酸化アルミニウムに戻る逆反応が起こる。この逆反応は電流効率低下の要因となるため、ホール・エルー法の最大電流効率は97%程度だと考えられている[15]。
ホール・エルー法の問題点は、融解及び電気分解で大量の電気を消費すること(アルミナ1tにつき15000kWh[注 2])である。そのため、アルミニウムは「電気の缶詰」と呼ばれることがある[17][18]。
これに対し、アルミ缶をリサイクルすると、必要なエネルギーはホール・エルー法の3%で済むといわれているが、実際には融解時に空気中の窒素と反応して窒化アルミニウム AlN として一部が失われる。
この窒化物は融解時にるつぼの表面に浮かぶので捨てられるが、空気中の水分と徐々に反応してアンモニアを生じる。
課題[編集]
- 高温を必要とする
- アルミナを溶かすため莫大な温度、エネルギーを必要とする[15]。
- 電解液の腐食性が非常に高い
- 融剤に使われるフッ素化物は非常に腐食性が強く、電解液を貯められる容器が存在しない。やむを得ず冷却して固体化したフッ素化物自身を利用しているが容器を冷却しつつ電解液を溶かすために多くの熱量を必要とする[15]
- これによりホール・エルー法は自由エネルギー変化ではなくエンタルピー変化となる。固体酸化物形電解セルのように発熱を無駄なく分解に利用し高い効率を得ることが出来ない。
- 効率を上げるためには大型化で容器の表面積を減らすなどして熱損失を抑えると同時に電解液を最適な組成に保つなどして過電圧を抑え理論電圧に近づける必要がある。
- 熱損失だけを抑えても過電圧が大きければ電解液が熱くなりすぎて電解槽を溶かしてしまうし、過電圧だけを下げて発熱を抑えても熱損失が大きければ電解液が冷えすぎて固まってしまう。
- エネルギー効率が悪い
- 上記の短所によりエネルギー効率が悪い。アルミの発熱量は8.6kWh/kgに対し製造に必要なエネルギーは15 - 18kWh/kgと莫大で半分以下のエネルギー効率でしかない。
- 電極を消耗する
- 陽極の炭素電極は酸素と反応し消耗するため交換が必要。
- 二酸化炭素を生じる
- 電極が消耗して二酸化炭素が生じる。地球温暖化を促進するリスクとなる。
新技術・競合技術[編集]
非消耗電極[編集]
高い温度、腐食性ゆえ非消耗電極の開発は困難を極める。
大きく分けて、金属、サーメット、セラミックの3種類があり、金属は導電性に優れる一方セラミックは侵食が小さい。サーメットは大凡その中間の性質を持つ。[19]
ニッケル、銅、鉄、リチウムなど多種多様な金属およびその酸化物を用いて開発が行われてきたが[20]、十分な導電性と耐蝕性を併せ持つ電極は未だ実用化に至っていない。
アルコアは、電力源に自然エネルギーを用いるだけでなく、炭素電極を非消耗型の電極に置き換えることでCO2排出を限りなくゼロに近づける方法を開発。2018年には、この実用化を目指すエリシス(Elysis)にアルコア、リオ・ティントと、Appleやカナダ、ケベック州政府が総額1億4,400万ドル出資した。2024年に実用化を目指している。[21][22][23][24]
特許情報によればELYSISの開発した電極には銅、ニッケル、鉄、酸素が用いられる他予期せぬテルミット反応を防ぐための監視装置を考案している。[25]
湿式電解製錬[編集]
アルミナを熱で溶かすのではなくイオン液体に溶かして電気分解する。
湿式電解製錬は空気アルミニウム電池の充電と全く同じプロセスである。
富士色素が空気アルミニウム電池の二次電池化に成功した他[26]電池開発の観点から精力的な研究が続けられている。
塩化アルミニウム[編集]
アルミナを一旦塩素と反応させ融点の低い塩化アルミニウムを合成、これを電気分解する。
必要な電力は9.6kWh/kg-Alほどであり、ホール・エル―法より25%ほど必要な電力を少なく出来る。
標準自由エネルギーの問題で炭素などの脱酸素剤が反応に必要となるが[27]、電極と異なり強度は必要ないので、生物由来のバイオカーボンを使うことが出来、カーボンニュートラルを実現しやすくなる。
塩素と原料の不純物によって起こる有害な塩素化合物が生成される点が問題となっている。[28]
炭素還元[編集]
電気を用いず炭素だけで還元する。理論的には2080℃まで加熱すれば可能だがそのような高温は実現が困難である。
そこで、まずアルミの炭化物、塩化物を作る方法、ケイ酸、酸化鉄と混合して粗合金を得た後に精錬する方法が考えられたが、いずれもホール・エルー法に勝るだけのコスト、エネルギー効率を達成できていない[29][30]。
脚注[編集]
注釈[編集]
出典[編集]
- ^ “溶融塩電解”. コトバンク. 朝日新聞社. 2016年4月29日閲覧。
- ^ “No.1 アルミ[原料]その1”. 『やさしい技術読本』1997年3月発行分. 神戸製鋼所(KOBELCO) (1997年3月). 2017年5月11日閲覧。
- ^ “パリ万博で登場した「粘土から得た銀」”. 歴史を見たマテリアル. 神戸製鋼所. 2016年4月30日閲覧。
- ^ “Manufacturer and builder / Volume 20, Issue 9, 1888”. 2016年4月30日閲覧。
- ^ George J. Binczewski (1995). “The Point of a Monument: A History of the Aluminum Cap of the Washington Monument”. JOM 47 (11): 20-25. Bibcode: 1995JOM....47k..20B. doi:10.1007/BF03221302.
- ^ 岩崎廣和「認定化学遺産 第028号 日本初のアルミニウム生産の工業化 : 電気の原料化と国産技術の振興を理念に (特集 化学遺産の第5回認定)」『化学と工業』第67巻第7号、日本化学会、2014年7月、599-601頁、ISSN 0022-7684、NAID 40020140794。
岩崎廣和「日本初のアルミニウム生産の工業化 : 認定化学遺産第028号「日本初のアルミニウム生産の工業化に関わる資料」(ヘッドライン:化学遺産,遺跡をたずねる)」『化学と教育』第64巻第1号、2016年、16-19頁、doi:10.20665/kakyoshi.64.1_16。 - ^ “アルミニウムの歴史”. 日本アルミニウム協会. 2016年4月30日閲覧。
- ^ 大澤直『現場で役立つ金属材料の基本と仕組み』秀和システムズ〈図解入門 : How-nual. Visual Text Book〉、2015年、135頁。ISBN 978-4-7980-4325-8。
- ^ “アルコア”. コトバンク. 朝日新聞社. 2016年4月30日閲覧。
- ^ 大澤直『よくわかるアルミニウムの基本と仕組み』秀和システムズ〈図解入門 : How-nual Visual Guide Book〉、2010年、39頁。ISBN 978-4-7980-2506-3。
- ^ “Production of Aluminum: The Hall-Heroult Process”. National Historic Chemical Landmarks. American Chemical Society. 2014年2月21日閲覧。
- ^ Solheim, Asbjorn (2019年4月24日). “Is aluminium electrolysis using inert anodes a blind alley?” (英語). #SINTEFblog. 2022年5月7日閲覧。
- ^ Das, Subodh (2012). “Achieving Carbon Neutrality in the Global Aluminum Industry”. JOM 64 (2): 285-290. doi:10.1007/s11837-012-0237-0. ISSN 1047-4838.
- ^ “アルミニウムの製造工程”. アルミニウムとは(基礎知識). 日本アルミニウム協会. 2017年5月11日閲覧。 “当該ページ後半の「アルミナ→アルミニウム」項より”
- ^ a b c 曻, 増子、紘一郎, 眞尾「アルミニウム製錬技術の現状」『軽金属』第65巻第2号、軽金属学会、2015年、66-71頁、doi:10.2464/jilm.65.66。
- ^ 『elements~メンデレーエフの奇妙な棚~(10)”電気の缶詰~アルミニウム~”』(インターネット番組)科学技術振興機構(サイエンスチャンネル)、2004年、該当時間: 08:40。2017年5月11日閲覧。
- ^ “アルミとは?”. アルミ精密切削加工.COM. (株)昭洋精機. 2017年5月11日閲覧。 “当該ページ後半の「3.アルミ製錬と電気」項より”
- ^ “アルミニウムの製錬-中学”. NHK for School. 日本放送協会. 2017年5月11日閲覧。 “説明用動画有”
- ^ He, Yong; Zhou, Ke-chao; Zhang, Yan; Xiong, Hui-wen; Zhang, Lei (2021-11-23). “Recent progress of inert anodes for carbon-free aluminium electrolysis: a review and outlook” (英語). Journal of Materials Chemistry A 9 (45): 25272-25285. doi:10.1039/D1TA07198J. ISSN 2050-7496.
- ^ Padamata, Sai Krishna and Yasinskiy, Andrey S and Polyakov, Peter V (2018). Progress of inert anodes in aluminium industry. Сибирский федеральный университет. Siberian Federal University.
- ^ “Apple、先進のカーボンフリー アルミニウム精練法の実現に 道を開く”. Apple Newsroom (日本). 2021年12月29日閲覧。
- ^ “Appleがベンチャーとアルミの新製錬法の確立を目指す、温室効果ガスを低減”. MONOist. 2021年12月29日閲覧。
- ^ “バリューチェーンで協力して進める アルミ生産の脱炭素化”. PROJECT DESIGN - 月刊「事業構想」オンライン (2021年3月31日). 2021年12月29日閲覧。
- ^ “Rio Tinto Alma smelter site for first commercial demo of ELYSIS GHG-free aluminum smelting technology”. Green Car Congress. 2022年5月7日閲覧。
- ^ “Primary Aluminum: Inert Anode and Wettable Cathode Technology in Aluminum Electrolysis” (英語). Light Metal Age Magazine (2020年2月19日). 2022年5月7日閲覧。
- ^ “世界初!アルミニウム-空気電池の初の二次電池化を実現”. 富士色素 (2013年). 2022年5月5日閲覧。
- ^ 南條道夫, 金井俊治, 伊藤良雅, 谷内研太郎「塩浴を反応媒体とするボーキサイトの塩化」『軽金属』第34巻第7号、軽金属学会、1984年、382-388頁、doi:10.2464/jilm.34.382、ISSN 04515994、CRID 1390282681316784512。
- ^ Øye, Bjarte (2019年3月28日). “Could the chloride process replace the Hall-Héroult process in aluminium production?” (英語). #SINTEFblog. 2023年6月21日閲覧。
- ^ 一司, 大日方「炭素還元によるアルミニウムの製造に関する諸研究」『軽金属』第14巻第2号、1964年、120-128頁、doi:10.2464/jilm.14.120。
- ^ 良吉, 真保、修, 小川、秀夫, 清水、佐吉, 後藤「アルミナの高温炭素還元に関する基礎研究」『日本鉱業会誌』第103巻第1191号、1987年、325-330頁、doi:10.2473/shigentosozai1953.103.1191_325。
関連項目[編集]
外部リンク[編集]
- アルミニウムの誕生 - 『科学映像館』より。1960年に日本軽金属(当時)の企画の下で制作された広報映画。
《当該映画の開始7分30秒後より当製錬法による製錬過程説明(但し製錬現場説明は開始10分37秒後以降)》





