フェニルリチウム
| フェニルリチウム | |
|---|---|

| |
別称 Phenyl lithium[要出典] | |
| 識別情報 | |
| 略称 | LiPh, PhLi |
| CAS登録番号 | 591-51-5 |
| PubChem | 637932 |
| ChemSpider | 10254416 |
| EC番号 | 209-720-1 |
| MeSH | phenyllithium |
| ChEBI | |
| バイルシュタイン | 506502 |
| Gmelin参照 | 2849 |
| |
| |
| 特性 | |
| 化学式 | LiC6H5 |
| モル質量 | 84.045 g mol-1 |
| 精密質量 | 84.055129209 g mol-1 |
| 外観 | 無色結晶 |
| 密度 | 828 mg cm-3 |
| 沸点 |
140-143 °C, 413-416 K, 284-289 °F |
| 水への溶解度 | 反応 |
| 熱化学 | |
| 標準生成熱 ΔfH |
48.3-52.5 kJ mol-1 |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| Rフレーズ | R14, R17, R23/24/25, R48 |
| Sフレーズ | (S1/2), S8, S9, S16, S26, S30, S46, S36/37/39, S45 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
フェニルリチウム(phenyllithium)は、経験式C6H5Liの有機金属試薬である。有機合成においてメタル化試薬ならびにフェニル基導入のためのグリニャール試薬の代替物として最も一般的に使用されている[2]。結晶フェニルリチウムは無色である。しかしながら、フェニルリチウムの溶液は使用する溶媒および溶質中に存在する不純物に依存して茶色や赤色など様々な色調を示す[3]。
構造と性質[編集]
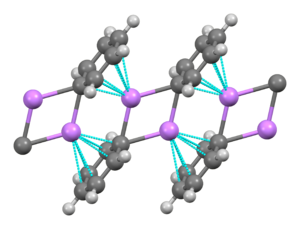
フェニルリチウムは単斜晶を形成する有機リチウム化合物である。固体フェニルリチウムは二量体 Li2Ph2サブユニットから構成されると説明できる。二量体において、Li原子およびフェニル基のipso-炭素は平面4員環を形成する。フェニル基の平面はこのLi2C2環に対して垂直である。さらなる強い分子間結合はこれらのフェニルリチウム二量体と隣接する二量体中のフェニル基のπ電子との間で起こり、その結果として無限重合体の梯子構造が生じる[4]。
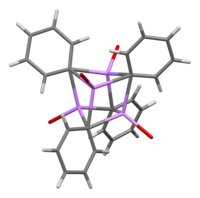
溶液中では、有機溶媒に依存して様々な構造を取る。テトラヒドロフラン中では、単量体と二量体状態の間の平衡となる。エーテル中(一般的にこの形で市販されている)では、フェニルリチウムは4量体として存在している。Li原子おび4つのipso-炭素中心は歪んだ立方体の交互の頂点を占める。フェニル基は正四面体の面にあり、最も近いLi原子3つに結合する。
C-Li結合長は平均2.33 Åである。エーテル分子は、酸素原子でそれぞれのLi部位に結合する。リチウムとハロゲン化フェニルが直接反応した副生成物であるLiBrの存在下では、[(PhLi • Et2O)4] 複合体が代わりに [(PhLi • Et2O)3 • LiBr) となる。LiBrのLi原子がキュバン様骨格のリチウム部位の1つを占め、Br原子が隣接する炭素部位に居座る[5]。
調製[編集]
フェニルリチウムは金属リチウムとジフェニル水銀との反応によって初めて作り出された[6]。
合成法はリチウムとハロゲン化フェニルを直接する反応させることによってその後すぐに改良された[7]。
フェニルリチウムは金属ハロゲン交換反応でも合成することができる。
今日におけるフェニルリチウム生産の主要な方法は後半の2つの合成法である。
反応[編集]
フェニルリチウムは求核付加および置換反応によって炭素-炭素単結合の形成を促進するために主に使用される。
脚注[編集]
- ^ “phenyllithium (CHEBI:51470)”. Chemical Entities of Biological Interest (ChEBI). Cambridge, UK: European Bioinformatics Institute (2009年1月22日). 2013年6月1日閲覧。
- ^ Wietelmann, U.; Bauer, R. J.. “Lithium and Lithium Compounds”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_393
- ^ Gilman, H.; Zoellner, E. A.; Selby, W. M. (1932). “An Improved Procedure for the Preparation of Organolithium Compounds”. J. Am. Chem. Soc. 54 (5): 1957–1962. doi:10.1021/ja01344a033.
- ^ Dinnebier, R. E.; Behrens, U.; Olbrich, F. (1998). “Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction”. Journal of the American Chemical Society 120 (7): 1430–1433. doi:10.1021/ja972816e.
- ^ Hope, H.; Power, P. P. (1983). “Isolation and Crystal Structures of the Halide-Free and Halide-Rich Phenyllithium Etherate Complexes [(PhLi•Et2O)4] and [(PhLi•Et2O)3•LiBr]”. J. Am. Chem. Soc. 105 (16): 5320–5324. doi:10.1021/ja00354a022.
- ^ Green, D. P.; Zuev, D. (2008). "Phenyllithium". Encyclopedia of Reagents for Organic Synthesis. Wiley and Sons. doi:10.1002/047084289X.rp076.pub2。
- ^ Dinnebier, R. E.; Behrens, U.; Olbrich, F. (1998). “Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction”. J. Am. Chem. Soc. 120 (7): 1430–1433. doi:10.1021/ja972816e.