化学吸着
化学吸着(かがくきゅうちゃく、英: Chemisorption)とは、吸着のうち表面と吸着質との間の化学反応を伴う種類のものを言う。 吸着剤表面に新たな化学結合が形成される。腐食のように巨視的に目に見える現象もあれば、不均一触媒反応における反応過程のように微視的な現象もある。吸着質と基質の表面との間の強い相互作用により、新しい種類の電子結合が生じる[1]。
化学吸着と対立する概念として、物理吸着という種類の吸着もある。この場合、吸着質および表面の化学種には変化が伴わない。慣例的に、「物理吸着」と「化学吸着」とを分ける境目は吸着する化学種あたりの結合エネルギーにして 0.5 eV とされる。
その特殊性から、化学吸着の性質は化学種と表面構造によって大きく左右される。
応用[編集]
化学吸着の重要な応用例として、不均一触媒が挙げられる。この触媒反応では、分子が化学吸着により生じた中間体を経て反応する。化学吸着を起こした化学種は、互いに結合を生じた後に表面から脱着する。
自己組織化単分子膜[編集]
自己組織化単分子膜(SAM)は金属表面に反応試薬を化学吸着させることにより形成される。有名な例としては、金表面にチオール(RS-H)を吸着させて生じるものが挙げられる。この過程では強い Au-SR 結合が生じ、H2 が脱離する。密度の高い SR 基により表面は保護される。
気体-表面化学吸着[編集]
速度論[編集]
化学吸着は吸着の一種であるから、吸着の過程に従う。 最初の段階では吸着質粒子が表面と接触する。粒子が表面に捉えられるためには、気体-表面井戸型ポテンシャルを超えるエネルギーを持っていないことが条件となる。もし粒子が表面と弾性衝突をする場合、粒子はバルク気体へと戻っていってしまう。しかし、非弾性衝突により十分な運動量を失った場合、粒子は表面に「くっつき」、物理吸着のように表面と弱く結合した前駆状態を生じる。粒子は表面上に拡散し、ポテンシャル井戸の深い化学吸着サイトを見付けるとそこで表面と化学反応を起こし、さもなくば時間と共に十分なエネルギーを得て単に脱着する[2]。
表面との反応は関与する化学種によって異なる。反応に関するギブズエネルギーの公式
を適用すると、熱力学的に定温定圧条件下で反応が自発的に進行するためには自由エネルギー変化が負である必要がある。自由粒子が表面に捉えられる場合、表面原子が非常に高い移動度を持ってでもいないかぎり、エントロピーは低下する。したがって、エンタルピー項が負でなくてはならず、反応は発熱反応であることが要求される[3]。
物理吸着がレナード・ジョーンズポテンシャルにより良く記述されるのに対して、化学吸着はモースポテンシャルにより良く記述される。物理吸着と化学吸着には交差点があり、したがって転移点が存在する。転移はゼロエネルギー線よりも上で起こる場合も下で起こる場合もあり、これは活性化エネルギーが必要であるか否かを表わす。ほとんどの単純気体と清浄金属表面の場合は活性化エネルギーは必要がない。
モデル化[編集]
化学吸着の実験を行う際、特定の系における吸着量は吸着確率の値により定量される。
しかし、化学吸着の理論化は非常に困難である。 吸着における表面の影響は有効媒質近似から導出される多次元ポテンシャルエネルギー面(PES)を利用して記述されるが、物質によって、用いられる部分は限られる。PES の単純な例では、以下のようにエネルギーを位置の関数として表わすことができる。
ここで は電子の自由度についてのシュレーディンガー方程式のエネルギー固有値であり、 はイオンの相互作用である。この式には並進エネルギーや回転準位、振動励起などは考慮されていない[4]。
表面反応を記述するモデルとしてはいくつかのモデルが知られている。ラングミュア・ヒンシェルウッド機構では反応化学種の両方が吸着し、イーレイ・リディール機構では片方が吸着し、もう片方がそれと反応する。
現実の系には多数の不規則性が存在し、理論計算がより複雑になる[5]。
- 固体表面は必ずしも平衡状態にあるとは限らない。
- 表面には外乱があったり、むらがあったり、欠陥があったりする。
- 吸着エネルギーには分布があり、特異な吸着サイトも存在する。
- 吸着質間で結合形成が起こる場合もある。
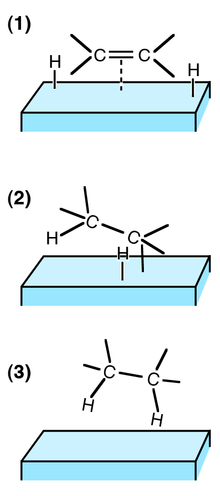
吸着質が単に表面に落ち着くだけの物理吸着とは異なり、化学吸着では表面構造によっては吸着質が表面上で変化することがある。表面構造は緩和を受けることがあり、表面に近い数層は、構造を保ったまま層間距離を変える可能性も、再構成を起こして構造を変化させる可能性もある。
たとえば、酸素は Cu(110) などの金属との間に非常に強固な結合 (~4 eV) を形成する。この過程で、表面結合が解離して表面・吸着質結合が形成される。列が失われることにより、大きな再構成が起こる場合がある。
解離吸着[編集]
気体・表面化学吸着の中には、解離吸着と呼ばれる種類のものがある。この過程では、水素や酸素、窒素などの二原子分子気体が表面において解離を起こす。この過程を記述するためのモデルの一つに、前駆体媒介モデルがある。表面に吸着した分子はまず前駆体状態を形成する。その後、分子は表面上の複数の吸着サイトへと拡散し、表面との新たな結合が好ましくなると分子結合を切る。解離反応の活性化エネルギーを越えるためのエネルギーは並進エネルギーや振動エネルギーから得られる。
例として、銅への水素分子の吸着に関しては多数の研究が行われている。その活性化エネルギーは .35 – .85 eV と大きい。水素分子の振動励起により、銅の低指数面で解離は促進される。
関連項目[編集]
出典[編集]
- ^ Oura, K.; V. G. Lifshits; A. A. Saranin; A. V. Zotov; M. Katayama (2003). Surface Science, An Introduction. Berlin: Springer. ISBN 3-540-00545-5
- ^ Rettner, C.T; Auerbach, D.J. (1996). “Chemical Dynamics at the Gas-Surface Interface”. Journal of Physical Chemistry 100 (31): 13021–13033. doi:10.1021/jp9536007.
- ^ Gasser, R.P.H.; (1985) An introduction to chemisorption and catalysis by metals, Clarendon Press, Oxford
- ^ Norskov, J.K. (1990). “Chemisorption on metal surfaces”. Reports on Progress in Physics 53 (10): 1253–1295. Bibcode: 1990RPPh...53.1253N. doi:10.1088/0034-4885/53/10/001.
- ^ Clark, A.; (1974); The Chemisorptive Bond: Basic Concepts, Academic Press, New York and London
参考文献[編集]
- F.C. Tompkins Chemisorption of gases on metals, Academic Press, (1978)
- L. Schlapbach, A. Zuttel, Nature 414, p 353-358 (2001)




