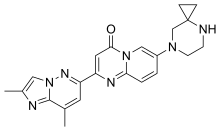
リスジプラム
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Evrysdi |
| Drugs.com | monograph |
| ライセンス | US Daily Med:リンク |
| 胎児危険度分類 | |
| 法的規制 | |
| 投与経路 | By mouth |
| 識別 | |
| CAS番号 | 1825352-65-5 |
| ATCコード | M09AX10 (WHO) |
| PubChem | CID: 118513932 |
| DrugBank | DB15305 |
| ChemSpider | 67886354 |
| UNII | 76RS4S2ET1 |
| KEGG | D11406 |
| ChEMBL | CHEMBL4297528 |
| 別名 | RG7916; RO7034067 |
| 化学的データ | |
| 化学式 | C22H23N7O |
| 分子量 | 401.47 g·mol−1 |
| |
| |
リスジプラム[5](Risdiplam)は、脊髄性筋萎縮症(SMA)の治療に使用される薬剤で[4][6]、この疾患の治療に承認された最初の経口薬である[4][6]。運動神経細胞生存遺伝子2指向性のRNAスプライシング[注 1]修飾薬である[3][4][7]。
臨床試験では、発熱、下痢、発疹、口内炎、関節痛、尿路感染などが主な有害事象として認められた[3][4]。また、乳幼児期に発症した集団では、上気道感染、肺炎、便秘、嘔吐などの有害事象が認められた[3][4]。
2020年8月に米国食品医薬品局(FDA)より、生後2カ月以上の小児および成人の治療薬として承認された[4][8]。日本では2021年6月に承認された[9]。
効能・効果
日本
- 脊髄性筋萎縮症
- (早産児および生後2カ月未満の乳児に対する有効性および安全性は確立していない。)[10]
米国
副作用
重大な副作用は知られていない[10]。
2つの臨床試験において、投与された患者は偽薬群と比較し、以下の有害事象が5%以上の頻度で発生した[3][4]。
の有害事象が発現した。
多剤対向輸送タンパク(MATE)基質である薬剤の血漿濃度を増加させる可能性があるため、これらをリスジプラムと共に服用してはならない[3][4]。
作用機序
脊髄性筋萎縮症(SMA)の根本的な原因である、運動神経細胞生存タンパク質(SMNタンパク質)の量の減少に対処する。このタンパク質は、SMN1 およびSMN2 遺伝子によってコード化されている。健常人では専らSMN1 から完全型のSMNが産生される一方、SMN2 から産生されるSMNはその9割でエクソン7を欠き、不安定で容易に分解される[11]。SMAは、活性型のタンパク質をコードするSMN1 の突然変異によって引き起こされる。SMN2 から産生される完全型SMNはSMN1 よりも遥かに少量であるが、SMN2 のコピー数[注 2]が病気の重症度を決定する傾向にある[6][12]。
この化合物はピリダジン誘導体であり、SMN2 伝令RNAのスプライシングを変更させてエクソン7を含む[7][13][14]様にする事で、生体内の機能的なSMNタンパク質の濃度を増加させる[15]。
SMAの治療薬として初めて承認されたヌシネルセンは、イントロンスプライシング静止因子N1(ISS-N1)を標的としたアンチセンス核酸で、SMN2 のmRNAスプライシングも変化させる[16]。
有効性
現在進行中の臨床試験では、乳児期および後期発症のSMAにおけるリスジプラムの安全性と有効性が評価されている[6][17][18][19][20]。
41名の被験者を対象とした非盲検試験である乳児期発症のSMA試験では、少なくとも5秒間サポートなしで座ることが出来るか否かに基づいて有効性が確認された。12ヵ月間の治療後、29%の被験者が5秒以上自立して座る事が出来た。治療開始から23ヵ月以上経過した時点で、81%の被験者が永久人工呼吸器なしで生存していた。この研究では、プラセボを投与された(無治療の)子供達との直接比較は行われていないが、未治療の疾患の典型的な経過と比較して良好な結果と言える[4][17]。
遅発性SMAの研究は、無作為化比較試験で、2歳から25歳までの重症度の低いSMA患者180名が登録された。リスジプラムを12ヵ月間投与した被験者は、プラセボを投与した被験者と比較して、運動機能の改善が認められた[4][6][18]。
非盲検の第II/III相試験では、生後1ヵ月から7ヵ月の乳児21名が登録され、2021年に用量決定および安全性に関する初期段階が終了した。動物モデルで見られた副作用である網膜毒性は、本試験対象者には認められなかった。また、機能性SMNタンパク質の血中濃度の上昇が認められた[14]。
承認
米国では、2020年8月に販売承認が与えられた。米国食品医薬品局(FDA)はこれに先立ち、迅速承認、優先審査、希少疾病用医薬品指定の申請を認可した[4][6][8]。
欧州医薬品庁(EMA)は、2018年にリスジプラムの優先医薬品指定を[8][21][22]、2019年に希少疾病用医薬品指定を与えた[8][23]。
日本では厚生労働省から2019年3月に希少疾病用医薬品に指定され[24]、2021年6月に承認された[9]。
2020年8月現在、ブラジル、チリ、中国、欧州連合、インドネシア、ロシア、韓国、台湾で販売承認が申請されている[8][25]。
注釈
参考資料
- ^ a b “Evrysdi”. Therapeutic Goods Administration (TGA) (2021年6月11日). 2021年9月6日閲覧。
- ^ a b “AusPAR: Risdiplam”. Therapeutic Goods Administration (TGA) (2021年9月13日). 2021年9月13日閲覧。
- ^ a b c d e f g h Food and Drugs Administration (FDA) (2020年8月18日). “Evrysdi- risdiplam powder, for solution”. DailyMed. MedLine by the National Library of Medicine (NLM) of the United States National Institutes of Health (NIH). 2020年9月24日閲覧。
- ^ a b c d e f g h i j k l m n O'Keefe, Lindsey (7 August 2020). "FDA Approves Oral Treatment for Spinal Muscular Atrophy" (Press release). Silver Spring, Maryland, United States of America: United States Food and Drug Administration (FDA). FDA Newsroom Department. 2020年8月11日時点のオリジナルよりアーカイブ。2020年8月7日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ “KEGG DRUG: リスジプラム”. www.genome.jp. 2021年10月18日閲覧。
- ^ a b c d e f Food and Drugs Administration (FDA) (2020年8月7日). “Evrysdi (Risdiplam) for Spinal Muscular Atrophy”. SMA News Today (Pensacola, Florida, United States: BioNews Services (BioNews Services, LLC.)). オリジナルの2021年1月21日時点におけるアーカイブ。 2021年6月9日閲覧。
- ^ a b Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, Petruska J, Narasimhan J, Dakka A, Welch EM, Karp G, Chen KS, Metzger F, Ratni H, Lotti F, Tisdale S, Naryshkin NA, Pellizzoni L, Paushkin S, Ko CP, Weetall M (May 2016). “Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy”. Human Molecular Genetics (Oxford, United Kingdom of Great Britain: Oxford University Press (OUP)) 25 (10): 1885-1899. doi:10.1093/hmg/ddw062. PMC 5062580. PMID 26931466.
- ^ a b c d e "FDA Approves Genentech's Evrysdi (risdiplam) for Treatment of Spinal Muscular Atrophy (SMA) in Adults and Children 2 Months and Older". Genentech (Press release) (English). San Francisco, California, United States of America: Genentech, Inc. (Roche Group). Genentech Global Product Development Division. 7 August 2020. 2020年8月18日時点のオリジナルよりアーカイブ。2020年8月7日閲覧。
- ^ a b “2021年06月23日|エブリスディ、脊髄性筋萎縮症に対し承認を取得|ニュースリリース|中外製薬”. 中外製薬企業情報サイト. 2021年10月18日閲覧。
- ^ a b “エブリスディドライシロップ60mg 添付文書”. www.info.pmda.go.jp. 2021年10月18日閲覧。
- ^ 佐橋健太郎、勝野雅央「脊髄性筋萎縮症に対する神経スプライシング制御治療」『神経治療』第37巻第3号、2020年、247-250頁、doi:10.15082/jsnt.37.3_247。
- ^ Ramdas S, Servais L (February 2020). “New treatments in spinal muscular atrophy: an overview of currently available data”. Expert Opinion on Pharmacotherapy (London, England, United Kingdom of Great Britain: Taylor & Francis (Informa UK Ltd)) 21 (3): 307-315. doi:10.1080/14656566.2019.1704732. OCLC 57378019. PMID 31973611.
- ^ “RG7916”. BioNews Services (BioNews Services, LLC.) (2016年11月8日). 2020年4月24日時点のオリジナルよりアーカイブ。2021年6月9日閲覧。
- ^ a b Baranello G, Darras BT, Day JW, Deconinck N, Klein A, Masson R, Mercuri E, Rose K, El-Khairi M, Gerber M, Gorni K, Khwaja O, Kletzl H, Scalco RS, Seabrook T, Fontoura P, Servais L (March 2021). “Risdiplam in Type 1 Spinal Muscular Atrophy”. The New England Journal of Medicine (Boston, Massachusetts, United States of America: NEJM Group (Massachusetts Medical Society)) 384 (10): 915-923. doi:10.1056/NEJMoa2009965. ISSN 00284793. LCCN 20-20456. OCLC 231027780. PMID 33626251.
- ^ Ratni H, Ebeling M, Baird J, Bendels S, Bylund J, Chen KS, Denk N, Feng Z, Green L, Guerard M, Jablonski P, Jacobsen B, Khwaja O, Kletzl H, Ko CP, Kustermann S, Marquet A, Metzger F, Mueller B, Naryshkin NA, Paushkin SV, Pinard E, Poirier A, Reutlinger M, Weetall M, Zeller A, Zhao X, Mueller L (August 2018). “Discovery of Risdiplam, a Selective Survival of Motor Neuron-2 ( SMN2) Gene Splicing Modifier for the Treatment of Spinal Muscular Atrophy (SMA)”. Journal of Medicinal Chemistry (Washington, D.C.) 61 (15): 6501-6517. doi:10.1021/acs.jmedchem.8b00741. ISSN 00222623. LCCN a630-643. OCLC 39480771. PMID 30044619.
- ^ Zanetta C, Nizzardo M, Simone C, Monguzzi E, Bresolin N, Comi GP, Corti S (January 2014). “Molecular therapeutic strategies for spinal muscular atrophies: current and future clinical trials”. Clinical Therapeutics (Philadelphia, Pennsylvania, United States of America: Elsevier) 36 (1): 128-140. doi:10.1016/j.clinthera.2013.11.006. PMID 24360800.
- ^ a b Baranello, G.; Servais, L.; Day, J.; Deconinck, N.; Mercuri, E.; Klein, A. et al. (1 October 2019). “P.353FIREFISH Part 1: 16-month safety and exploratory outcomes of risdiplam (RG7916) treatment in infants with type 1 spinal muscular atrophy”. Neuromuscular Disorders (London, United Kingdom of Great Britain: World Muscle Society (WMS)/Elsevier Inc.) 29 (Supplement 1): S184. doi:10.1016/j.nmd.2019.06.515. ISSN 0960-8966. OCLC 24318845.
- ^ a b “Update from SUNFISH Part 1: Safety, Tolerability and PK/PD from the Dose-Finding Study, Including Exploratory Efficacy Data in Patients with Type 2 or 3 Spinal Muscular Atrophy (SMA) Treated with Risdiplam (RG7916) (S25.007)”. Neurology (Minneapolis, Minnesota, United States of America: American Academy of Neurology/Wolters Kluwer) 92 (15 (Supplement)). (16 April 2019). ISSN 00283878. LCCN 55-43902. OCLC 960771045 2021年6月9日閲覧。.
- ^ “2021年03月19日|ロシュ社、2~25歳のII型またはIII型脊髄性筋萎縮症(SMA)において運動機能の改善・維持を示すEvrysdiTM(リスジプラム)の2年データを発表|ニュースリリース|中外製薬”. 中外製薬企業情報サイト. 2021年10月18日閲覧。
- ^ “2021年04月21日|Evrysdi(リスジプラム)、乳児のI型脊髄性筋萎縮症(SMA)において継続して運動機能および生存の改善・維持を示す|ニュースリリース|中外製薬”. 中外製薬企業情報サイト. 2021年10月18日閲覧。
- ^ Inacio, Patricia (2018年12月21日). “Risdiplam Granted EMA's PRIME Designation for Potential in Spinal Muscular Atrophy” (English). SMA News Today (Pensacola, Florida, United States: BioNews Services (BioNews Services, LLC.)). オリジナルの2021年1月26日時点におけるアーカイブ。 2021年6月9日閲覧。
- ^ Roche Group Media Relations Division (17 December 2018). "PRIME designation granted by European Medicines Agency for Roche's risdiplam for treatment of spinal muscular atrophy (SMA)" (Press release) (English). Basel, Switzerland: F. Hoffmann-La Roche Ltd. Group Communications Department (Roche Group Media Relations Division). pp. 1–5. 2018年8月18日時点のオリジナル (PDF)よりアーカイブ。2021年6月9日閲覧。
- ^ Stoyanova-Beninska, Violeta (Committee Chair); Schwarzer-Daum, Brigitte (Committee Vice Chair) (26 February 2019). Public summary of opinion on orphan designation: Risdiplam for the treatment of spinal muscular atrophy (PDF). EMA Committee for Orphan Medicinal Products (COMP) (Report) (English). Amsterdam, The Netherlands: European Medicines Agency (EMA Committee for Orphan Medicinal Products). pp. 1–4. 2020年5月6日時点のオリジナルよりアーカイブ (PDF)。
- ^ “2019年03月27日|リスジプラムが脊髄性筋萎縮症に対する希少疾病用医薬品に指定|ニュースリリース|中外製薬”. 中外製薬企業情報サイト. 2021年10月18日閲覧。
- ^ PTC Therapeutics (2020年8月17日). “PTC Announces the Acceptance of the European Marketing Authorization Application for Evrysdi™ (risdiplam) for the Treatment of Spinal Muscular Atrophy”. PTC Therapeutics. Albuquerque, New Mexico, United States of America: PR Newswire. オリジナルの2020年8月18日時点におけるアーカイブ。 2021年6月9日閲覧。
関連文献
- Dhillon S (November 2020). “Risdiplam: First Approval” (English). Drugs (Berlin, Germany/Heidelberg, Germany/Cham, Switzerland: Adis International/Springer Nature Switzerland AG (Springer Nature)) 80 (17): 1853-1858. doi:10.1007/s40265-020-01410-z. OCLC 01566990. PMID 33044711.
- Ratni H, Scalco RS, Stephan AH (28 January 2021). “Risdiplam, the First Approved Small Molecule Splicing Modifier Drug as a Blueprint for Future Transformative Medicines”. ACS Medicinal Chemistry Letters (Washington, D.C.: ACS Publications (American Chemical Society)) 12 (6): 11021-11036. doi:10.1021/acsmedchemlett.0c00659. ISSN 19485875. OCLC 643819990. PMC 8201486. PMID 34141064.
外部リンク
- “Risdiplam”. Drug Information Portal. U.S. National Library of Medicine. 2021年10月18日閲覧。
- 臨床試験番号 NCT02913482 研究名 "Investigate Safety, Tolerability, PK, PD and Efficacy of Risdiplam (RO7034067) in Infants With Type1 Spinal Muscular Atrophy (FIREFISH)" - ClinicalTrials.gov
- 臨床試験番号 NCT02908685 研究名 "A Study to Investigate the Safety, Tolerability, Pharmacokinetics, Pharmacodynamics and Efficacy of Risdiplam (RO7034067) in Type 2 and 3 Spinal Muscular Atrophy (SMA) Participants (SUNFISH)" - ClinicalTrials.gov
