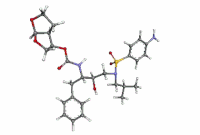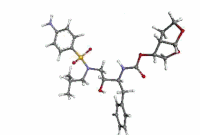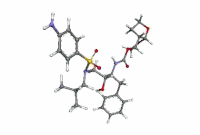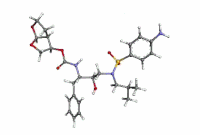
ダルナビル
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Prezista, Prezcobix, others[2] |
| Drugs.com | monograph |
| MedlinePlus | a607042 |
| ライセンス | EMA:リンク、US Daily Med:リンク |
| 胎児危険度分類 | |
| 法的規制 | |
| 投与経路 | By mouth |
| 薬物動態データ | |
| 生物学的利用能 | 37% (without ritonavir), 82% (with ritonavir) |
| 血漿タンパク結合 | 95% |
| 代謝 | hepatic (CYP3A4) |
| 半減期 | 15 hours (with ritonavir) |
| 排泄 | Feces (80%), urine (14%) |
| 識別 | |
| CAS番号 |
206361-99-1 |
| ATCコード | J05AE10 (WHO) |
| PubChem | CID: 213039 |
| DrugBank |
DB01264 |
| ChemSpider |
184733 |
| UNII |
YO603Y8113 |
| KEGG |
D03656 |
| ChEBI |
CHEBI:367163 |
| ChEMBL |
CHEMBL1323 |
| NIAID ChemDB | 073035 |
| PDB ligand ID | 017 (PDBe, RCSB PDB) |
| 別名 | TMC114, DRV, darunavir ethanolate |
| 化学的データ | |
| 化学式 | C27H37N3O7S |
| 分子量 | 547.67 g·mol−1 |
| |
ダルナビル(Darunavir, DRV)は、HIV/AIDSの治療および予防に使用される抗レトロウイルス薬である[2]。一般的には、他の抗レトロウイルス薬との併用が推奨されている[2][3]。ダルナビルの濃度を高める為に、低用量のリトナビルやコビシスタットと併用されることが多い[2]。本剤は、針刺し事故やその他の曝露の可能性がある場合の予防に使用される事がある[2]。1日1~2回、経口投与する[2]。商品名は単味剤はプレジスタとプレジスタナイーブ、コビシスタットとの2剤合剤はプレジコビックス、コビシスタット・エムトリシタビン・テノホビル アラフェナミドとの4剤合剤はシムツーザと呼ばれている。
一般的な副作用には、下痢、嘔気、腹痛、頭痛、発疹、嘔吐などがある[2][3]。重大な副作用としては、アレルギー反応、肝障害、中毒性表皮壊死症等の皮膚障害などが知られている[2]。妊娠中の研究は充分ではないが、胎児への安全性は高いと考えられている[1]。プロテアーゼ阻害薬(PI)の一種であり、HIVのプロテアーゼを阻害することで効果を発揮する[2]。
ダルナビルは、2006年6月に米国で[2]、2007年2月に欧州連合で[4]、2007年11月に日本で[5]医療用医薬品として承認された。世界保健機関(WHO)の必須医薬品リストにも登録されている[6]。合剤のダルナビル・コビシスタットは、1錠で使用できる[7]。
効能・効果
ダルナビルは、過去にHIV治療を受けた事があるか否かに拘らず、成人および青少年に対して米国Office of AIDS Research Advisory Council(DHHS)が推奨する治療オプションである[11]。
当初承認時は、HIV既治療の患者を対象とした臨床試験が実施されており、HIV治療歴のある患者に対してのみ1日2回投与で有効性(リトナビル併用)が確認されていた[5]。
HIV治療歴のない患者を対象とした研究が別途実施され、ダルナビルは1日1回の投与で96週間、ロピナビル・リトナビルと同等の効果を示した[12]。HIV未治療患者への1日1回投与は、2008年10月21日にFDAより承認された[13]。日本では2009年9月に発売された[5]。他の抗レトロウイルス薬と同様に、ダルナビルはHIV/AIDSを治癒するものではない[14]。
リトナビルとの併用により、3歳以上の成人および小児におけるヒト免疫不全ウイルス(HIV-1)感染症の治療を適応とし、他の抗レトロウイルス剤と組み合わせて使用される[3][4]。
禁忌
ダルナビルは、下記の薬剤と併用禁忌である[8]。
- トリアゾラム、ミダゾラム、ピモジド、エルゴタミン・カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメトリン、メチルエルゴメトリン、バルデナフィル、ブロナンセリン、シルデナフィル、タダラフィル、アゼルニジピン、アゼルニジピン・オルメサルタン メドキソミル、ルラシドン、アスナプレビル、ダクラタスビル・アスナプレビル・ベクラブビル、グラゾプレビル、リバーロキサバン
腎機能障害あるいは肝機能障害を持つ患者では、コルヒチンも禁忌となる。
2剤合剤および4剤合剤では併用禁忌薬は更に増える[9][10]。
副作用
ダルナビルは、一般的に忍容性が高い。発疹が最も一般的な副作用である(7%)[14]。その他の一般的な副作用には、下痢(2.3%)、頭痛(3.8%)、腹痛(2.3%)、便秘(2.3%)、嘔吐(1.5%)がある[14]。また、ダルナビルはアレルギー反応を起こすことがあり、リトナビルにアレルギーのある患者はダルナビルにも反応することがある[14]。
ダルナビルのようなプロテアーゼ阻害薬を服用している患者では、高血糖、糖尿病の発症または悪化、筋肉痛、圧痛または脱力感、血友病の患者の出血量の増加が報告されている[14]。HIV治療薬を服用している患者の中には、脚、腕、顔の脂肪の減少、腹部やその他の内臓の脂肪の増加、乳房肥大、首の後ろの脂肪の塊など、体脂肪の変化が見られる場合がある。これらの症状の原因や長期的な健康への影響は不明である[14]。
薬物相互作用
ダルナビルは、他の抗レトロウイルス剤、プロトンポンプ阻害薬やH2受容体拮抗薬といった制酸薬等、HIV/AIDS患者が一般的に服用している薬と相互作用する可能性がある[14]。セイヨウオトギリソウは、代謝酵素CYP3Aによるダルナビルの分解を促進することで、ダルナビルの効果を低下させる可能性がある[14]。
作用機序

ダルナビルは、非ペプチド系のプロテアーゼ(PR)阻害薬(PI)であり、多くの水素結合を介してPRの活性部位に留まる[15]。HIV-1プロテアーゼとの相互作用を高め、HIV-1プロテアーゼの変異に対する耐性を高める為に開発された。ダルナビルのKd(解離定数)は4.5×10-12Mで、PRとの相互作用が非常に強く、解離定数は他のプロテアーゼ阻害薬の1⁄100~1⁄1000となっている[16]。この強い相互作用は、ダルナビルとPRの活性部位の骨格との間の水素結合の増加に由来する(右図)。ダルナビルの構造は、これまでにFDAで開発・承認された殆どのPIよりも、PR活性部位との水素結合を多く作る事が出来る[17]。更に、HIV-1プロテアーゼのバックボーンは、変異があっても空間的なコンフォメーションを維持している[18]。ダルナビルはプロテアーゼのこの安定した部分と相互作用するため、PR-PI間の相互作用が変異によって破壊される可能性は低い[17]。

触媒部位
HIV-1プロテアーゼの化学的活性は、ホモ二量体の各コピーに由来する活性部位の2つの残基、Asp25とAsp25'に依存している[19]。ダルナビルは、これらの触媒アスパラギン酸と活性部位のバックボーンと水素結合で相互作用し、特にAsp25、Asp25'、Asp29、Asp30、Asp30'、Gly27の各残基に結合する(右図と左図)。この相互作用により、ウイルスのポリペプチドが活性部位にアクセスするのを競合的に阻害し、このタンパク質の酵素部分と強く結合することで、ウイルスの複製を防ぐ事が出来る[15]。
承認
ダルナビルは、2006年6月に米国で、2007年2月に欧州連合(EU)で、2007年11月に日本で使用が承認された[20][21][22][23][4][5]。
第一世代の臨床用阻害薬の開発は、水素結合と疎水性相互作用によってプロテアーゼ・リガンドの相互作用をより多く作り出すことに基礎を置いていた[15]。FDAに承認された最初のHIVプロテアーゼ阻害薬は、野生型HIV-1プロテアーゼを標的として設計されたサキナビルであった[24]。しかし、この阻害薬は、HIV-1プロテアーゼの構造上の耐性原因となる変異のために、もはや有効ではない。HIVのゲノムは可塑性が高いため、複数のHIV-1プロテアーゼ阻害薬に耐性を持つようになって来ている[25]。サキナビル以降、FDAはダルナビルを含む複数のPIを承認している[22]。
脚注
- ^ a b c “Darunavir (Prezista) Use During Pregnancy”. Drugs.com (2018年10月23日). 2020年4月21日閲覧。
- ^ a b c d e f g h i j “Darunavir”. The American Society of Health-System Pharmacists. 2016年11月10日時点のオリジナルよりアーカイブ。2016年11月28日閲覧。
- ^ a b c “Prezista- darunavir tablet, film coated Prezista- darunavir suspension”. DailyMed (2019年6月6日). 2020年4月21日閲覧。
- ^ a b c “Prezista EPAR”. European Medicines Agency (EMA). 2020年4月21日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ a b c d 日経メディカル. “耐性が生じにくいHIVプロテアーゼ阻害薬”. 日経メディカル. 2021年6月15日閲覧。
- ^ World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. (2019). hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO
- ^ “Darunavir / Cobicistat”. AIDSinfo. U.S. Department of Health and Human Services. 2021年6月15日閲覧。
- ^ a b c “プリジスタ錠600mg/プリジスタナイーブ錠800mg 添付文書”. www.info.pmda.go.jp. PMDA. 2021年6月15日閲覧。
- ^ a b c “プレジコビックス配合錠 添付文書”. www.info.pmda.go.jp. PMDA. 2021年6月15日閲覧。
- ^ a b “シムツーザ配合錠 添付文書”. www.info.pmda.go.jp. PMDA. 2021年6月15日閲覧。
- ^ Panel on Antiretroviral Guidelines for Adults and Adolescents (18 December 2019). "Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV" (Document). Department of Health and Human Services.
{{cite document}}: 不明な引数|access-date=は無視されます。 (説明); 不明な引数|lay-url=は無視されます。 (説明); 不明な引数|url=は無視されます。 (説明) - ^ hivandhepatitis.com Archived 2007-07-13 at the Wayback Machine., Efficacy and Safety of Boosted Darunavir (Prezista) Are Superior to Lopinavir/ritonavir (Kaletra) at 96 Weeks: ARTEMIS Trial, 2008-10-28, URL Archived 2009-07-19 at the Wayback Machine..
- ^ hivandhepatitis.com Archived 2007-07-13 at the Wayback Machine., Darunavir (Prezista) Receives Full Traditional Approval, Dose Set for Treatment-naive Patients, Caution Urged for Pregnant Women, 2008-10-24, URL Archived 2009-05-19 at the Wayback Machine..
- ^ a b c d e f g h “Drug Monograph, Prezista”. 2016年11月11日時点のオリジナルよりアーカイブ。2021年6月15日閲覧。
- ^ a b c Leonis, Georgios; Czyżnikowska, Żaneta; Megariotis, Grigorios; Reis, Heribert; Papadopoulos, Manthos G. (2012-06-25). “Computational Studies of Darunavir into HIV-1 Protease and DMPC Bilayer: Necessary Conditions for Effective Binding and the Role of the Flaps” (英語). Journal of Chemical Information and Modeling 52 (6): 1542–1558. doi:10.1021/ci300014z. ISSN 1549-9596.
- ^ King, Nancy M.; Prabu-Jeyabalan, Moses; Nalivaika, Ellen A.; Wigerinck, Piet; de Béthune, Marie-Pierre; Schiffer, Celia A. (2004-11). “Structural and Thermodynamic Basis for the Binding of TMC114, a Next-Generation Human Immunodeficiency Virus Type 1 Protease Inhibitor” (英語). Journal of Virology 78 (21): 12012–12021. doi:10.1128/JVI.78.21.12012-12021.2004. ISSN 0022-538X.
- ^ a b Lefebvre, E.; Schiffer, C. A. (2008). “Resilience to Resistance of HIV-1 Protease Inhibitors: Profile of Darunavir”. AIDS Rev. 10 (3): 131–142. PMC 2699666. PMID 18820715.
- ^ Lascar, R. M.; Benn, P. (2009). “Role of darunavir in the management of HIV infection”. HIV AIDS (Auckl) 1: 31–39. doi:10.2147/hiv.s5397. PMC 3218677. PMID 22096377.
- ^ Li, Dan; Zhang, Ying; Zhao, Run-Ning; Fan, Song; Han, Ju-Guang (2014-02). “Investigation on the mechanism for the binding and drug resistance of wild type and mutations of G86 residue in HIV-1 protease complexed with Darunavir by molecular dynamic simulation and free energy calculation” (英語). Journal of Molecular Modeling 20 (2): 2122. doi:10.1007/s00894-014-2122-y. ISSN 1610-2940.
- ^ MacArthur, Rodger D (2007). “Darunavir: promising initial results”. The Lancet 369 (9568): 1143–1144. doi:10.1016/S0140-6736(07)60499-1. PMID 17416241.
- ^ "FDA Approves New HIV Treatment for Patients Who Do Not Respond to Existing Drugs". U.S. Food and Drug Administration (FDA) (Press release). 2016年11月13日時点のオリジナルよりアーカイブ。2016年11月10日閲覧。
- ^ a b “HIV/AIDS Historical Time Line 2000 - 2010”. U.S. Food and Drug Administration (2018年1月5日). 2019年6月1日時点のオリジナルよりアーカイブ。2020年4月21日閲覧。
- ^ “Drug Approval Package: Prezista (Darumavir) NDA #021976”. U.S. Food and Drug Administration (FDA) (2006年9月6日). 2020年4月21日閲覧。
- ^ Liu, F.; Kovalevsky, A.Y. (2008). “Effect of Flap Mutations on Structure of HIV-1 Protease and Inhibition by Saquinavir and Darunavir”. J. Mol. Biol. 381 (1): 102–115. doi:10.1016/j.jmb.2008.05.062. PMC 2754059. PMID 18597780.
- ^ Eron, J (2000). “HIV-1 Protease Inhibitors”. Clinical Infectious Diseases 30: 160–170. doi:10.1086/313853. PMID 10860901.
参考資料
- Panel on Antiretroviral Guidelines for Adults and Adolescents (18 December 2019). "Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV" (Document). Department of Health and Human Services.
{{cite document}}: 不明な引数|lay-url=は無視されます。 (説明); 不明な引数|url=は無視されます。 (説明)
関連項目
外部リンク
- “Darunavir”. Drug Information Portal. U.S. National Library of Medicine. 2021年6月15日閲覧。
