ヒドロキシルアミン
| ヒドロキシルアミン | |
|---|---|

|

|
| |
Hydroxylamine | |
別称 アザノール オキサンモニウム | |
| 識別情報 | |
| CAS登録番号 | 7803-49-8 |
| PubChem | 787 |
| RTECS番号 | NC2975000 |
| 特性 | |
| 化学式 | NH2OH |
| モル質量 | 33.030 g/mol |
| 外観 | 白色の針状またはフレーク状固体 |
| 密度 | 1.21 g/cm3 (20 °C)[1] |
| 融点 |
33 °C, 306 K, 91 °F |
| 沸点 |
58 °C, 331 K, 136 °F (分解) |
| 水への溶解度 | 冷水に可溶 熱水では加水分解 |
| 溶解度 | 液体アンモニア、アルコールに易溶 |
| 酸解離定数 pKa | 5.94 |
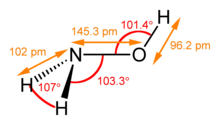
| 構造 | |
| 双極子モーメント | 0.67553 D |
| 熱化学 | |
| 標準生成熱 ΔfH |
-39.9 kJ/mol |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0661 |
| EU分類 | Carc. Cat. 3 爆発性 (E) 有毒 (T) 有害 (Xn) 刺激性 (Xi) 環境への危険性 (N) |
| EU Index | 612-122-00-7(水溶液、> 55 %) 612-122-01-4(水溶液、< 55 %) |
| NFPA 704 | |
| Rフレーズ | R2 R21/22 R37/38 R40 R41 R43 R48/22 R50 |
| Sフレーズ | S2 S26 S36/37/39 S61 |
| 引火点 | 129 °C, 402 K(爆発) |
| 発火点 | 265 °C, 538 K |
| 半数致死量 LD50 | 408 mg/kg(経口、マウス); 59–70 mg/kg(腹腔内投与、マウス、ラット); 29 mg/kg(皮下注射、ラット)[2] |
| 関連する物質 | |
| 関連するヒドロキシルアンモニウム塩 | |
| 関連物質 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ヒドロキシルアミン(英: hydroxylamine)は示性式が NH2OH と表される無機化合物である。水とアンモニアが互いに一部分を共有したような構造を持っているので、それらの混成体と見ることもできる。純粋なヒドロキシルアミンは室温で不安定な結晶性の固体であり、吸湿性を持つ。潮解性がある。一般的に水溶液、または塩酸塩などの塩として取り扱われる。
ヒドロキシルアミンは生合成的硝化の中間体である。アンモニアの酸化はヒドロキシルアミン酸化還元酵素によって媒介される。
生産[編集]
いくつかの合成法が知られている[3]。
ラシヒ法 (Raschig Synthesis) では、まず亜硝酸アンモニウム水溶液を 0 °C において で還元し、ヒドロキシルアミド-N,N-ジスルフェートとする。これを加水分解して硫酸塩 を得る。
固体のヒドロキシルアミンはこの硫酸塩を液体アンモニアで処理することによって得られる。硫酸アンモニウムは液体アンモニアに不溶なので濾別でき、アンモニアは減圧下に留去される。
他の合成法として、ヒドロキシルアンモニウム塩を経るものがある。亜硝酸または亜硝酸ナトリウムを亜硫酸イオンで還元する。生成したヒドロキシルアミド-N-スルフェートを加水分解し、ヒドロキシルアンモニウム塩としたのち、ナトリウムブトキシドで中和し遊離のヒドロキシルアミンを得る。
- (100 ℃、1時間)
反応[編集]
アルキル化剤のような求電子試薬と反応する。酸素と窒素はどちらも攻撃を受ける。
この反応はケトン、アルデヒドの精製に有用である。またオキシム類はジメチルグリオキシムのような配位子としても使われる。
クロロ硫酸と反応してヒドロキシルアミン-O-スルホン酸を与える。これはカプロラクタムの合成に用いられる試薬である。
ヒドロキシルアミン-O-スルホン酸は 0 ℃ 以下で保存する必要があり、ヨウ素滴定で確認できる。
利用[編集]
ヒドロキシルアミンおよびその塩類は多くの有機化学、無機化学反応において還元剤として一般的に用いられる。脂肪酸の酸化防止剤としての作用もある。化学以外での利用法としては、獣皮の脱毛や写真の現像液などがある[4]。半導体の洗浄剤として利用される。農薬の原料にもなる。
硝酸ヒドロキシルアンモニウムはロケットの推進剤として、一液推進薬(水溶液)、固体燃料の両方が研究されている。
安全性[編集]
ヒドロキシルアミンは爆発性の化合物であるが、その危険性の度合いについては完全にはわかっていない。火気や高温体に触れると、爆発的に燃焼する。紫外線を受けると爆発する。1999年以来、ヒドロキシルアミンを扱う工場での死者を伴う事故が何度か起こっている。
鉄(II), (III) イオンによって 50 % ヒドロキシルアミン溶液の分解が加速されることが知られている。ヒドロキシルアミンとその誘導体は塩の形で安全に取り扱うことができる。
呼吸器、皮膚、目、そして他の粘膜を刺激する。皮膚から吸収される可能性があり、飲み込んだ場合も有害であり、変異誘発物質である可能性がある。蒸気が大量に体内に入ると、血液の酸素吸収力が低下し、死亡することがある。
法規制[編集]
日本[編集]
毒物及び劇物取締法により劇物に指定されている[5]。
参考文献[編集]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ^ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. pp. 362. ISBN 1903996651
- ^ Earnshaw, A.; Greenwood, N. Chemistry of the Elements; Butterworth-Heinemann: Oxford, 1997; 2nd ed., pp. 431–432. ISBN 0750633654
- ^ Patnaik, P. Handbook of Inorganic Chemicals; McGraw Hill: Columbus, 2003; pp. 385–386. ISBN 0070494398
- ^ 毒物及び劇物取締法 昭和二十五年十二月二十八日 法律三百三号 第二条 別表第二
関連項目[編集]
外部リンク[編集]
- ヒドロキシルアミン研究データ (data.cas‑msds.com) at Archive.is (archived 2014年4月)





![{\displaystyle {\ce {[NH4]2[N(OH)(OSO2)2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8daee30a1ee4ba2553734d06c7eeb527900bdd0)
![{\displaystyle {\ce {[NH4]^+\ 2[N(OH)(OSO2)2]^{2-}\ + H2O ->}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8471a74733ca9ab2f21734e9f2956703ed239c9)
![{\displaystyle {\ce {[NH4][NH(OH)(OSO2)]\ + [NH4][HSO4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4d2164d301f89e9f494f435e065aba9f4e24113d)
![{\displaystyle {\ce {2[NH4]^+[NH(OH)(OSO2)]^-\ + 2H2O ->}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41c85d5936e5ba063c84463e0135f05d0f8400e8)
![{\displaystyle {\ce {[NH3(OH)]2[SO4]\ + [NH4]2[SO4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12c2209f6b71d3724c8dede0d8eb12b0a7971208)
![{\displaystyle {\ce {HNO2\ + 2 HSO3^- ->\ [N(OH)(OSO2) 2]^{2-}\ + H2O ->\ [NH(OH)(OSO2)]^-\ + [HSO4]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/365588c106601aa23f907747eaaef013afd7f32f)
![{\displaystyle {\ce {[NH(OH)(OSO2)]^-\ + H3O^+ ->\ [NH3(OH)]^+\ + [HSO4]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3d53189a0362c3bd2109dfea3f710a542a4d2fb)
![{\displaystyle {\ce {[NH3(OH)]Cl\ + NaOBu -> NH2OH\ + NaCl\ + BuOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1065a7b17e298d38abc628e1cfed22e135bbd4dc)



