「ヒトマイクロバイオーム」の版間の差分
m 内部リンク追加 タグ: モバイル編集 モバイルウェブ編集 改良版モバイル編集 |
Karasunoko (会話 | 投稿記録) 微生物叢 2021年8月5日 (木) 12:05 (UTC) の一部転記 タグ: サイズの大幅な増減 |
||
| 38行目: | 38行目: | ||
ニキビと抑うつは関連すると言われているが、1930年代にも皮膚病学者のストークスとビルズベリーはニキビと抑うつの関係から「腸・脳・皮膚軸」の仮説を提唱し、感情が腸内細菌叢を変えるために皮膚の炎症につながるとして、乳酸菌のラクトバチルス・アシドフィルスを摂取する治療法を提唱していた<ref name="naid40019418100">{{Cite journal |和書|author=M・コンスタンディ |date=2012-10 |title=胃腸と脳の意外なつながり |journal=日経サイエンス |volume=42 |issue=10 |pages=58-63 |naid=40019418100}}</ref>。 |
ニキビと抑うつは関連すると言われているが、1930年代にも皮膚病学者のストークスとビルズベリーはニキビと抑うつの関係から「腸・脳・皮膚軸」の仮説を提唱し、感情が腸内細菌叢を変えるために皮膚の炎症につながるとして、乳酸菌のラクトバチルス・アシドフィルスを摂取する治療法を提唱していた<ref name="naid40019418100">{{Cite journal |和書|author=M・コンスタンディ |date=2012-10 |title=胃腸と脳の意外なつながり |journal=日経サイエンス |volume=42 |issue=10 |pages=58-63 |naid=40019418100}}</ref>。 |
||
=== ヒトと微生物叢 === |
|||
[[ファイル:Skin-Microbiome-Human.png| |
|||
サムネイル|ヒトの皮膚微生物叢。その解剖学的部位によって、微生物叢を構成する細菌種の組成は異なる<ref name=":7">{{Cite journal|last=Byrd|first=Allyson L.|last2=Belkaid|first2=Yasmine|last3=Segre|first3=Julia A.|date=2018-03|title=The human skin microbiome|url=http://www.nature.com/articles/nrmicro.2017.157|journal=Nature Reviews Microbiology|volume=16|issue=3|pages=143-155|language=en|doi=10.1038/nrmicro.2017.157|issn=1740-1526}}</ref>。]] |
|||
腸内をはじめヒトの体には微生物が定着している。[[大腸]]には特に多数の細菌が生息しており、重量は体重70kgの成人男性で0.2kgに過ぎないが、細胞数では約40兆に及ぶと推定されている。この数は個人の全細胞の数を超える<ref>{{Cite journal|last=Sender|first=Ron|last2=Fuchs|first2=Shai|last3=Milo|first3=Ron|date=2016-08-19|title=Revised Estimates for the Number of Human and Bacteria Cells in the Body|url=https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1002533|journal=PLOS Biology|volume=14|issue=8|pages=e1002533|language=en|doi=10.1371/journal.pbio.1002533|issn=1545-7885|pmid=27541692|pmc=PMC4991899}}</ref>。ヒトの微生物叢は特に[[ヒトマイクロバイオーム]]と呼ばれ、疾病等との関連性から重点的に研究が進められてきた。その中でも腸内細菌叢に関する研究が特に焦点を当てられてきており、腸管に沿って腸内細菌叢の構造が変化することや、様々な疾病との関連が明らかにされている。同様に、口腔、皮膚、膣などの微生物叢も疾患との関連などから研究されてきた<ref name=":1">{{Cite journal|last=Rowan-Nash|first=Aislinn D.|last2=Korry|first2=Benjamin J.|last3=Mylonakis|first3=Eleftherios|last4=Belenky|first4=Peter|date=2019-01-09|title=Cross-Domain and Viral Interactions in the Microbiome|url=https://mmbr.asm.org/content/83/1/e00044-18|journal=Microbiology and Molecular Biology Reviews|volume=83|issue=1|pages=e00044-18, /mmbr/83/1/e00044-18.atom|language=en|doi=10.1128/MMBR.00044-18|issn=1092-2172|pmid=30626617|pmc=PMC6383444}}</ref>。また、ヒトの微生物叢の大規模な調査として、アメリカのHuman Microbiome ProjectやヨーロッパのMetaHITなどの国家規模のプロジェクトが実施されている<ref name=":5">{{Cite journal|last=NIH HMP Working Group|last2=Peterson|first2=Jane|last3=Garges|first3=Susan|last4=Giovanni|first4=Maria|last5=McInnes|first5=Pamela|last6=Wang|first6=Lu|last7=Schloss|first7=Jeffery A.|last8=Bonazzi|first8=Vivien|last9=McEwen|first9=Jean E.|date=2009-12|title=The NIH Human Microbiome Project|url=https://www.ncbi.nlm.nih.gov/pubmed/19819907|journal=Genome Research|volume=19|issue=12|pages=2317-2323|doi=10.1101/gr.096651.109|issn=1549-5469|pmid=19819907|pmc=2792171}}</ref><ref>{{Cite journal|last=Qin|first=Junjie|last2=Li|first2=Ruiqiang|last3=Raes|first3=Jeroen|last4=Arumugam|first4=Manimozhiyan|last5=Burgdorf|first5=Kristoffer Solvsten|last6=Manichanh|first6=Chaysavanh|last7=Nielsen|first7=Trine|last8=Pons|first8=Nicolas|last9=Levenez|first9=Florence|date=2010-03|title=A human gut microbial gene catalogue established by metagenomic sequencing|url=https://www.nature.com/articles/nature08821|journal=Nature|volume=464|issue=7285|pages=59-65|language=en|doi=10.1038/nature08821|issn=1476-4687}}</ref>。 |
|||
ヒトの微生物叢は腸管、口腔、皮膚、膣といった部位ごとに、構成する細菌種が異なり、例えば他者間のヒト腸管の微生物叢を比べた場合と、同一個人で腸管と口腔の微生物叢を比較した場合、前者の方が互いに類似性が高い<ref>{{Cite journal|last=Costello|first=Elizabeth K.|last2=Lauber|first2=Christian L.|last3=Hamady|first3=Micah|last4=Fierer|first4=Noah|last5=Gordon|first5=Jeffrey I.|last6=Knight|first6=Rob|date=2009-12-18|title=Bacterial Community Variation in Human Body Habitats Across Space and Time|url=https://science.sciencemag.org/content/326/5960/1694|journal=Science|volume=326|issue=5960|pages=1694-1697|language=en|doi=10.1126/science.1177486|issn=0036-8075|pmid=19892944}}</ref><ref name=":9">{{Cite journal|last=The Human Microbiome Project Consortium|date=2012-06|title=Structure, function and diversity of the healthy human microbiome|url=http://www.nature.com/articles/nature11234|journal=Nature|volume=486|issue=7402|pages=207-214|language=en|doi=10.1038/nature11234|issn=0028-0836|pmid=22699609|pmc=PMC3564958}}</ref>。 |
|||
==== 腸管の微生物叢 ==== |
|||
腸管の微生物叢については特に3つのエンテロタイプと呼ばれる微生物叢のグループが提唱されている。3つのエンテロタイプはそれぞれに特有な細菌の系統によって特徴付けることができ、これらの特徴的なグループは地域に依存せずに存在する<ref>{{Cite journal|last=Arumugam|first=Manimozhiyan|last2=Raes|first2=Jeroen|last3=Pelletier|first3=Eric|last4=Le Paslier|first4=Denis|last5=Yamada|first5=Takuji|last6=Mende|first6=Daniel R.|last7=Fernandes|first7=Gabriel R.|last8=Tap|first8=Julien|last9=Bruls|first9=Thomas|date=2011-05-12|title=Enterotypes of the human gut microbiome|url=https://www.ncbi.nlm.nih.gov/pubmed/21508958|journal=Nature|volume=473|issue=7346|pages=174-180|doi=10.1038/nature09944|issn=1476-4687|pmid=21508958|pmc=3728647}}</ref><ref>{{Citation|title=新たな臓器としての腸内細菌叢|url=https://doi.org/10.11405/nisshoshi.112.1939|publisher=一般財団法人 日本消化器病学会|date=2015|accessdate=2020-08-02|doi=10.11405/nisshoshi.112.1939|language=ja|first=朗|last=安藤}}</ref>。 |
|||
近年の研究成果から疾患と細菌叢の関係が明らかにされてきた。例えば[[肥満]]とそれに伴う[[2型糖尿病]]のような[[生活習慣病]]は、ヒトの遺伝情報だけではなく、腸内細菌叢を構成する細菌種の割合とも関係していること、疫学調査や動物実験から明らかにされた<ref>{{Cite journal|last=Qin|first=Junjie|last2=Li|first2=Yingrui|last3=Cai|first3=Zhiming|last4=Li|first4=Shenghui|last5=Zhu|first5=Jianfeng|last6=Zhang|first6=Fan|last7=Liang|first7=Suisha|last8=Zhang|first8=Wenwei|last9=Guan|first9=Yuanlin|date=2012-10|title=A metagenome-wide association study of gut microbiota in type 2 diabetes|url=https://www.nature.com/articles/nature11450|journal=Nature|volume=490|issue=7418|pages=55-60|language=en|doi=10.1038/nature11450|issn=1476-4687}}</ref><ref>{{Cite journal|last=Larsen|first=Nadja|last2=Vogensen|first2=Finn K.|last3=Berg|first3=Frans W. J. van den|last4=Nielsen|first4=Dennis Sandris|last5=Andreasen|first5=Anne Sofie|last6=Pedersen|first6=Bente K.|last7=Al-Soud|first7=Waleed Abu|last8=Sørensen|first8=Søren J.|last9=Hansen|first9=Lars H.|date=2010-02-05|title=Gut Microbiota in Human Adults with Type 2 Diabetes Differs from Non-Diabetic Adults|url=https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0009085|journal=PLOS ONE|volume=5|issue=2|pages=e9085|language=en|doi=10.1371/journal.pone.0009085|issn=1932-6203|pmid=20140211|pmc=PMC2816710}}</ref><ref>{{Cite journal|last=Ussar|first=Siegfried|last2=Griffin|first2=Nicholas W.|last3=Bezy|first3=Olivier|last4=Fujisaka|first4=Shiho|last5=Vienberg|first5=Sara|last6=Softic|first6=Samir|last7=Deng|first7=Luxue|last8=Bry|first8=Lynn|last9=Gordon|first9=Jeffrey I.|date=2015-09-01|title=Interactions between Gut Microbiota, Host Genetics and Diet Modulate the Predisposition to Obesity and Metabolic Syndrome|url=https://www.ncbi.nlm.nih.gov/pubmed/26299453|journal=Cell Metabolism|volume=22|issue=3|pages=516-530|doi=10.1016/j.cmet.2015.07.007|issn=1932-7420|pmid=26299453|pmc=4570502}}</ref>。 |
|||
環境が清潔だと[[アレルギー]]性疾患に罹患しやすいとする[[衛生仮説]]も微生物叢との関連から説明され得る<ref name=":1" />。経済的に豊かな富裕国では、病原性のない(または病原性の弱い)寄生虫や真菌、乳酸菌といった常在性の微生物に感染する機会が失われている。一方でこのような微生物は免疫の過剰応答を抑える[[制御性T細胞]]の誘導を活性化する働きがある。そのため、富裕国では[[炎症性腸疾患]]などのアレルギー性疾患が増加している、とするものである<ref>{{Cite journal|last=Rook|first=G. a. W.|last2=Brunet|first2=L. R.|date=2005-03|title=Microbes, immunoregulation, and the gut|url=https://www.ncbi.nlm.nih.gov/pubmed/15710972|journal=Gut|volume=54|issue=3|pages=317-320|doi=10.1136/gut.2004.053785|issn=0017-5749|pmid=15710972|pmc=1774411}}</ref>。実際に様々な研究が炎症性腸疾患と微生物叢の関連性を示しており、細菌叢の多様性([[α多様性]])が失われて特定の菌種が増加することなどの変化が起きると考えられているが、因果関係の証明には至っていない<ref>{{Cite journal|last=Lane|first=Erin R.|last2=Zisman|first2=Timothy L.|last3=Suskind|first3=David L.|date=2017|title=The microbiota in inflammatory bowel disease: current and therapeutic insights|url=https://www.ncbi.nlm.nih.gov/pubmed/28652796|journal=Journal of Inflammation Research|volume=10|pages=63-73|doi=10.2147/JIR.S116088|issn=1178-7031|pmid=28652796|pmc=5473501}}</ref>。 |
|||
==== 口腔の微生物叢 ==== |
|||
[[口腔]]にはおよそ700種程の細菌が生息すると推定されている。[[レンサ球菌属]]に代表される一部の細菌は口腔の全域に存在するが、特定の部位にのみ生息する細菌もあり、例えばRothia属の細菌は舌や歯の表面にしかいない。歯はヒトの体で唯一生理的に表皮の脱落が生じない部位であり、[[バイオフィルム]]の形成が行われるなど、微生物にとって絶好の生息地となる。また、他にも虫歯の治療のための歯冠やインプラントなどの表面も同様にバイオフィルム形成に影響し、口腔微生物叢の構成に変化を与えやすい<ref name=":12">{{Cite journal|last=Kilian|first=M.|last2=Chapple|first2=I. L. C.|last3=Hannig|first3=M.|last4=Marsh|first4=P. D.|last5=Meuric|first5=V.|last6=Pedersen|first6=A. M. L.|last7=Tonetti|first7=M. S.|last8=Wade|first8=W. G.|last9=Zaura|first9=E.|date=2016-11|title=The oral microbiome - an update for oral healthcare professionals|url=https://www.nature.com/articles/sj.bdj.2016.865|journal=British Dental Journal|volume=221|issue=10|pages=657-666|language=en|doi=10.1038/sj.bdj.2016.865|issn=1476-5373}}</ref><ref name=":13" />。 |
|||
人類の歴史とともに食生活は変化し、それに伴って口腔微生物叢も変化してきたと考えられている。例えば耕作により人類は精製糖を食生活に取り入れたが、''[[Streptococcus mutans]]''は増加した酸化ストレスへの防御機構と自ら産生する酸性の代謝産物への抵抗性を獲得し、他の細菌に優占するようになったとされる<ref name=":12" />。 |
|||
[[虫歯]]や[[歯周炎]]に代表される口腔の疾患は特定の細菌が原因となるのではなく、複数の常在細菌の集団が特定の条件で引き起こすと考えられている<ref name=":13">{{Cite journal|last=Krishnan|first=K|last2=Chen|first2=T|last3=Paster|first3=Bj|date=2017-04|title=A practical guide to the oral microbiome and its relation to health and disease|url=http://doi.wiley.com/10.1111/odi.12509|journal=Oral Diseases|volume=23|issue=3|pages=276-286|language=en|doi=10.1111/odi.12509|pmid=27219464|pmc=PMC5122475}}</ref>。また、口腔の疾患に関連した細菌は、数は少ないながらも常在している。そのため、口腔の疾患は病原体が新規に感染するのではなく、口腔微生物叢におけるバランスが破綻することによって引き起こされるという説が現在は受け入れられている<ref name=":12" />。 |
|||
==== 皮膚の微生物叢 ==== |
|||
腸管と同様に皮膚もまた独自の微生物叢を構成しており、皮膚の微生物叢においては[[プロピオニバクテリウム属]]、[[コリネバクテリウム属]]、[[ストレプトコッカス属]]の細菌とそれに感染するファージ、マラセチアなどの真菌、ポリオーマウイルスが主体となっている<ref>{{Cite journal|last=NISC Comparative Sequencing Program|last2=Oh|first2=Julia|last3=Byrd|first3=Allyson L.|last4=Deming|first4=Clay|last5=Conlan|first5=Sean|last6=Kong|first6=Heidi H.|last7=Segre|first7=Julia A.|date=2014-10|title=Biogeography and individuality shape function in the human skin metagenome|url=http://www.nature.com/articles/nature13786|journal=Nature|volume=514|issue=7520|pages=59-64|language=en|doi=10.1038/nature13786|issn=0028-0836|pmid=25279917|pmc=PMC4185404}}</ref>。健常者の皮膚微生物叢は[[黄色ブドウ球菌]]の増殖を抑制する働きを持つが、[[アトピー性皮膚炎]]の患者においては皮膚微生物叢が破綻して黄色ブドウ球菌が増殖している。また、[[尋常性痤瘡|ニキビ]]は皮膚微生物叢で最も比率の大きい種である[[アクネ菌]]との関連が指摘されている。アクネ菌は健常な皮膚における常在細菌だが、[[ニキビ]]患部においては特定の系統が増加している<ref name=":7" />。 |
|||
==== 膣の微生物叢 ==== |
|||
[[ファイル:Lactobacillus sp 01.png|サムネイル|膣の微生物叢の主要な構成種である[[ラクトバシラス属]]の細菌と膣の[[上皮細胞|扁平上皮細胞]]。[[グラム陽性菌|グラム陽性]]のラクトバシラス属細菌は青紫色に染色される。]] |
|||
[[膣]]微生物叢は偏った構造を持っており、構成種の大半が[[ラクトバシラス属]]に属する細菌である。一方でラクトバシラス属には様々な種が含まれており、個々人間でもラクトバシラス属内の種の多様性は大きく異なる。また、膣微生物叢の組成はpHの影響を受け、pHが高くなるとラクトバシラス属の減少が認められる<ref name=":9" />。ラクトバシラス属は乳酸菌を産生することでpH3.5-4.5の酸性環境を整えており、これが膣を有害な病原体から守ると考えられている<ref>{{Cite journal|last=Ma|first=Bing|last2=Forney|first2=Larry J.|last3=Ravel|first3=Jacques|date=2012|title=Vaginal microbiome: rethinking health and disease|url=https://www.ncbi.nlm.nih.gov/pubmed/22746335|journal=Annual Review of Microbiology|volume=66|pages=371-389|doi=10.1146/annurev-micro-092611-150157|issn=1545-3251|pmid=22746335|pmc=3780402}}</ref>。[[細菌性膣炎]]は膣の疾患で、悪臭を伴う、白色粘稠の分泌物が症状として認められる。細菌性[[膣炎]]では、pHが上昇し、ラクトバシラス属が減少する一方で、''Gardnerella vaginalis''などラクトバシラス属以外の細菌が増加することが知られる<ref>{{Cite journal|last=Kaambo|first=Evelyn|last2=Africa|first2=Charlene|last3=Chambuso|first3=Ramadhani|last4=Passmore|first4=Jo-Ann Shelley|date=2018|title=Vaginal Microbiomes Associated With Aerobic Vaginitis and Bacterial Vaginosis|url=https://www.frontiersin.org/articles/10.3389/fpubh.2018.00078/full|journal=Frontiers in Public Health|volume=6|language=English|doi=10.3389/fpubh.2018.00078|issn=2296-2565}}</ref>。 |
|||
==== ヒトの微生物叢の由来と定着 ==== |
|||
ヒトに定着している微生物はどこからやってくるのか。新生児の微生物叢は母体に由来しているようである。新生児の細菌叢と母体の細菌叢を比較した調査によると、新生児の細菌叢は出産の形態に影響を受ける。自然分娩の場合は母体の膣の細菌叢が新生児に定着し、ラクトバシラス属菌が優占種となる。一方で[[帝王切開]]の場合は母体の細菌叢が定着し、[[プロピオニバクテリウム属]]菌をはじめとした皮膚の常在細菌が優占種となる<ref>{{Cite journal|last=Dominguez-Bello|first=Maria G.|last2=Costello|first2=Elizabeth K.|last3=Contreras|first3=Monica|last4=Magris|first4=Magda|last5=Hidalgo|first5=Glida|last6=Fierer|first6=Noah|last7=Knight|first7=Rob|date=2010-06-29|title=Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns|url=https://www.pnas.org/content/107/26/11971|journal=Proceedings of the National Academy of Sciences|volume=107|issue=26|pages=11971-11975|language=en|doi=10.1073/pnas.1002601107|issn=0027-8424|pmid=20566857}}</ref>。分娩形態の違いにより生じる新生児における微生物叢の違いは12-24ヶ月齢までに徐々に消えていく<ref name=":11" />。分娩前の胎児が微生物叢を持つかについては議論があった。胎児が無菌的であるか否かについては150年前から議論されていたが、20世期の後半になって一旦は胎児は無菌であり、出産中とその後に微生物叢を獲得するという説が定説となる。しかしながら、近代的なDNAシークエンシング技術の開発によって、従来無菌的であると考えられていた[[羊水]]、[[胎盤]]、[[臍帯血]]、[[胎便]]からも細菌が検出されたことから、再び胎児の子宮内における微生物叢の獲得が主張されたきた<ref name=":0">{{Cite book|title=実験医学別冊 もっとよくわかる!シリーズ もっとよくわかる!腸内細菌叢 健康と疾患を司る“もう1つの臓器”|url=https://www.worldcat.org/oclc/1122630567|location=|isbn=978-4-7581-2206-1|oclc=1122630567|others=福田真嗣|date=|year=|publisher=羊土社}}</ref><ref>{{Cite journal|last=Perez-Muñoz|first=Maria Elisa|last2=Arrieta|first2=Marie-Claire|last3=Ramer-Tait|first3=Amanda E.|last4=Walter|first4=Jens|date=2017-04-28|title=A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome|url=https://doi.org/10.1186/s40168-017-0268-4|journal=Microbiome|volume=5|issue=1|pages=48|language=en|doi=10.1186/s40168-017-0268-4|issn=2049-2618|pmid=28454555|pmc=PMC5410102}}</ref>。もっともDNAの抽出試薬も細菌DNAに汚染されているなどの理由から、試料から得られるDNAの量が少ない場合は、試料に由来しない細菌DNAを検出してしまう可能性があるなど、実験系に制限があることが知られる。そのため、子宮内における微生物の検出には確定的な結論は出ていない<ref name=":11">{{Cite journal|last=Tamburini|first=Sabrina|last2=Shen|first2=Nan|last3=Wu|first3=Han Chih|last4=Clemente|first4=Jose C|date=2016-07|title=The microbiome in early life: implications for health outcomes|url=http://www.nature.com/articles/nm.4142|journal=Nature Medicine|volume=22|issue=7|pages=713-722|language=en|doi=10.1038/nm.4142|issn=1078-8956}}</ref>。実際、子宮内における微生物の検出には否定的な見解が示されている。537人の妊婦を対象とした研究によると、妊娠中の胎盤は基本的に無菌的であると考えられ、唯一の例外は約5%の妊婦でB群[[レンサ球菌]]が検出されたことのみであった<ref>{{Cite journal|last=de Goffau|first=Marcus C.|last2=Lager|first2=Susanne|last3=Sovio|first3=Ulla|last4=Gaccioli|first4=Francesca|last5=Cook|first5=Emma|last6=Peacock|first6=Sharon J.|last7=Parkhill|first7=Julian|last8=Charnock-Jones|first8=D. Stephen|last9=Smith|first9=Gordon C. S.|date=2019-07-10|title=Human placenta has no microbiome but can harbour potential pathogens|url= https://www.nature.com/articles/s41586-019-1451-5|journal=Nature|volume=572|issue=7769|pages=329-334|doi=10.1038/s41586-019-1451-5|issn=0028-0836|pmid=31367035|pmc=6697540}}</ref>。 |
|||
抗生物質は新生児の微生物叢に影響を及ぼし、新生児への持続的投与は喘息、2型糖尿病、炎症性腸疾患、乳アレルギーなどの疾患と関連する可能性がある。もっとも、否定的見解もしめされており、また、相関関係は必ずしも因果関係を意味しない。食事もまた微生物叢に影響を与える。[[母乳栄養]]は粉ミルクに比べ、新生児と母体の双方に健康上の利点があるとされるが、母乳に分泌される[[免疫グロブリンA]]、[[ラクトフェリン]]、[[ディフェンシン]]が少なからずこれに寄与すると考えられる<ref name=":11" />。 |
|||
==出典== |
==出典== |
||
{{Reflist}} |
{{Reflist|30em}} |
||
==参考文献== |
==参考文献== |
||
*{{Cite book|和書|author=鴨井久一編集|title=口腔プロバイオティクス&アンチバイオティクス ― 検査から始まる細菌の新しいコントロール法|publisher=永末書店|date=2013|isbn=978-4-8160-1262-4|ref=harv}} |
*{{Cite book|和書|author=鴨井久一編集|title=口腔プロバイオティクス&アンチバイオティクス ― 検査から始まる細菌の新しいコントロール法|publisher=永末書店|date=2013|isbn=978-4-8160-1262-4|ref=harv}} |
||
*{{Cite book|和書|author=Anders Zachrisson、Svante Twetman|chapter=プロバイオティクスからみた口腔細菌療法|title=口腔プロバイオティクス&アンチバイオティクス |publisher=永末書店|date=2013|isbn=978-4-8160-1262-4|page=85-99|ref=harv}} |
|||
{{デフォルトソート:ひとまいくろはいおおむ}} |
{{デフォルトソート:ひとまいくろはいおおむ}} |
||
2022年9月17日 (土) 14:12時点における版
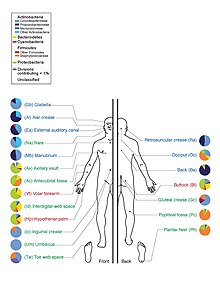
ヒトマイクロバイオーム(英:human microbiome)は、ヒトの細菌叢(微生物叢)である。腸内細菌叢には、ヒトの細胞数に近い約40兆個の細菌が存在し皮膚、口腔、鼻腔、膣などにも微生物が存在している[1]。
2010年に欧州の研究者によって、ヒトの消化器に1000種以上、330万個の微生物の遺伝子の数があることが判明し、これはヒトゲノムの遺伝子2万5千の約150倍として注目を受けた[2]。人類のDNAは99.9%が同じだが、ヒトマイクロバイオームでは構成が同じ人はいない[2]。
2007年に開始されたアメリカ国立衛生研究所 (NIH) が開始したのは ヒトマイクロバイオーム計画である [2]。翌年には国際コンソーシアム(米国、欧州、日本、中国からなる[3])が発足し、またMetaHITという、13の欧州の産学機関が参加するプロジェクトが開始された[2]。
種類
地球上には約70門の菌種があるが、ヒト常在菌の大部分は以下4門に集中している[3]。
TM7門は口腔にのみ存在する[3]。
量
乳児では大人の1/3から1/5である[3]。
研究手法の変化
日本では1950年代に光岡知足が、ヒト腸内細菌を嫌気培養して本格的な研究が開始されたが、後に16SリボソームRNA遺伝子(16S)を解析する、16S解析という手法が開発され培養できない細菌が多く存在することが判明してきた[3]。
2003年ごろにはメタゲノム解析が開発され、細菌叢のゲノム全体を解析するようになり、2010年代では2000年頃よりも数万倍の性能となり研究を進展させてきた[3]。
部位
皮膚常在菌、腸内細菌、口腔細菌、肺(英語版)、膣(英語版)、子宮(英語版)などに存在する
口腔
2013年までには、ヒト口腔微生物叢のデータベースには600以上の分類群が登録されている[4]。
口腔の健康を防衛するようにはたらく菌を食品で、あるいは錠剤やトローチで摂取するといった研究は数十研究が実施されており、う蝕(虫歯)、歯肉炎や、歯周炎、口内炎、口臭との関係を見ている[4]。両親の口でおしゃぶりをきれいにした方が、乳児の喘息や湿疹が少なくなるという研究結果も存在する[4]。
精神との関係
フランスでの研究はプロバイオティクスの健康食品が抑うつを低下させたという結果が報告した[5]。
ニキビと抑うつは関連すると言われているが、1930年代にも皮膚病学者のストークスとビルズベリーはニキビと抑うつの関係から「腸・脳・皮膚軸」の仮説を提唱し、感情が腸内細菌叢を変えるために皮膚の炎症につながるとして、乳酸菌のラクトバチルス・アシドフィルスを摂取する治療法を提唱していた[5]。
ヒトと微生物叢

腸内をはじめヒトの体には微生物が定着している。大腸には特に多数の細菌が生息しており、重量は体重70kgの成人男性で0.2kgに過ぎないが、細胞数では約40兆に及ぶと推定されている。この数は個人の全細胞の数を超える[7]。ヒトの微生物叢は特にヒトマイクロバイオームと呼ばれ、疾病等との関連性から重点的に研究が進められてきた。その中でも腸内細菌叢に関する研究が特に焦点を当てられてきており、腸管に沿って腸内細菌叢の構造が変化することや、様々な疾病との関連が明らかにされている。同様に、口腔、皮膚、膣などの微生物叢も疾患との関連などから研究されてきた[8]。また、ヒトの微生物叢の大規模な調査として、アメリカのHuman Microbiome ProjectやヨーロッパのMetaHITなどの国家規模のプロジェクトが実施されている[9][10]。
ヒトの微生物叢は腸管、口腔、皮膚、膣といった部位ごとに、構成する細菌種が異なり、例えば他者間のヒト腸管の微生物叢を比べた場合と、同一個人で腸管と口腔の微生物叢を比較した場合、前者の方が互いに類似性が高い[11][12]。
腸管の微生物叢
腸管の微生物叢については特に3つのエンテロタイプと呼ばれる微生物叢のグループが提唱されている。3つのエンテロタイプはそれぞれに特有な細菌の系統によって特徴付けることができ、これらの特徴的なグループは地域に依存せずに存在する[13][14]。
近年の研究成果から疾患と細菌叢の関係が明らかにされてきた。例えば肥満とそれに伴う2型糖尿病のような生活習慣病は、ヒトの遺伝情報だけではなく、腸内細菌叢を構成する細菌種の割合とも関係していること、疫学調査や動物実験から明らかにされた[15][16][17]。
環境が清潔だとアレルギー性疾患に罹患しやすいとする衛生仮説も微生物叢との関連から説明され得る[8]。経済的に豊かな富裕国では、病原性のない(または病原性の弱い)寄生虫や真菌、乳酸菌といった常在性の微生物に感染する機会が失われている。一方でこのような微生物は免疫の過剰応答を抑える制御性T細胞の誘導を活性化する働きがある。そのため、富裕国では炎症性腸疾患などのアレルギー性疾患が増加している、とするものである[18]。実際に様々な研究が炎症性腸疾患と微生物叢の関連性を示しており、細菌叢の多様性(α多様性)が失われて特定の菌種が増加することなどの変化が起きると考えられているが、因果関係の証明には至っていない[19]。
口腔の微生物叢
口腔にはおよそ700種程の細菌が生息すると推定されている。レンサ球菌属に代表される一部の細菌は口腔の全域に存在するが、特定の部位にのみ生息する細菌もあり、例えばRothia属の細菌は舌や歯の表面にしかいない。歯はヒトの体で唯一生理的に表皮の脱落が生じない部位であり、バイオフィルムの形成が行われるなど、微生物にとって絶好の生息地となる。また、他にも虫歯の治療のための歯冠やインプラントなどの表面も同様にバイオフィルム形成に影響し、口腔微生物叢の構成に変化を与えやすい[20][21]。
人類の歴史とともに食生活は変化し、それに伴って口腔微生物叢も変化してきたと考えられている。例えば耕作により人類は精製糖を食生活に取り入れたが、Streptococcus mutansは増加した酸化ストレスへの防御機構と自ら産生する酸性の代謝産物への抵抗性を獲得し、他の細菌に優占するようになったとされる[20]。
虫歯や歯周炎に代表される口腔の疾患は特定の細菌が原因となるのではなく、複数の常在細菌の集団が特定の条件で引き起こすと考えられている[21]。また、口腔の疾患に関連した細菌は、数は少ないながらも常在している。そのため、口腔の疾患は病原体が新規に感染するのではなく、口腔微生物叢におけるバランスが破綻することによって引き起こされるという説が現在は受け入れられている[20]。
皮膚の微生物叢
腸管と同様に皮膚もまた独自の微生物叢を構成しており、皮膚の微生物叢においてはプロピオニバクテリウム属、コリネバクテリウム属、ストレプトコッカス属の細菌とそれに感染するファージ、マラセチアなどの真菌、ポリオーマウイルスが主体となっている[22]。健常者の皮膚微生物叢は黄色ブドウ球菌の増殖を抑制する働きを持つが、アトピー性皮膚炎の患者においては皮膚微生物叢が破綻して黄色ブドウ球菌が増殖している。また、ニキビは皮膚微生物叢で最も比率の大きい種であるアクネ菌との関連が指摘されている。アクネ菌は健常な皮膚における常在細菌だが、ニキビ患部においては特定の系統が増加している[6]。
膣の微生物叢

膣微生物叢は偏った構造を持っており、構成種の大半がラクトバシラス属に属する細菌である。一方でラクトバシラス属には様々な種が含まれており、個々人間でもラクトバシラス属内の種の多様性は大きく異なる。また、膣微生物叢の組成はpHの影響を受け、pHが高くなるとラクトバシラス属の減少が認められる[12]。ラクトバシラス属は乳酸菌を産生することでpH3.5-4.5の酸性環境を整えており、これが膣を有害な病原体から守ると考えられている[23]。細菌性膣炎は膣の疾患で、悪臭を伴う、白色粘稠の分泌物が症状として認められる。細菌性膣炎では、pHが上昇し、ラクトバシラス属が減少する一方で、Gardnerella vaginalisなどラクトバシラス属以外の細菌が増加することが知られる[24]。
ヒトの微生物叢の由来と定着
ヒトに定着している微生物はどこからやってくるのか。新生児の微生物叢は母体に由来しているようである。新生児の細菌叢と母体の細菌叢を比較した調査によると、新生児の細菌叢は出産の形態に影響を受ける。自然分娩の場合は母体の膣の細菌叢が新生児に定着し、ラクトバシラス属菌が優占種となる。一方で帝王切開の場合は母体の細菌叢が定着し、プロピオニバクテリウム属菌をはじめとした皮膚の常在細菌が優占種となる[25]。分娩形態の違いにより生じる新生児における微生物叢の違いは12-24ヶ月齢までに徐々に消えていく[26]。分娩前の胎児が微生物叢を持つかについては議論があった。胎児が無菌的であるか否かについては150年前から議論されていたが、20世期の後半になって一旦は胎児は無菌であり、出産中とその後に微生物叢を獲得するという説が定説となる。しかしながら、近代的なDNAシークエンシング技術の開発によって、従来無菌的であると考えられていた羊水、胎盤、臍帯血、胎便からも細菌が検出されたことから、再び胎児の子宮内における微生物叢の獲得が主張されたきた[27][28]。もっともDNAの抽出試薬も細菌DNAに汚染されているなどの理由から、試料から得られるDNAの量が少ない場合は、試料に由来しない細菌DNAを検出してしまう可能性があるなど、実験系に制限があることが知られる。そのため、子宮内における微生物の検出には確定的な結論は出ていない[26]。実際、子宮内における微生物の検出には否定的な見解が示されている。537人の妊婦を対象とした研究によると、妊娠中の胎盤は基本的に無菌的であると考えられ、唯一の例外は約5%の妊婦でB群レンサ球菌が検出されたことのみであった[29]。
抗生物質は新生児の微生物叢に影響を及ぼし、新生児への持続的投与は喘息、2型糖尿病、炎症性腸疾患、乳アレルギーなどの疾患と関連する可能性がある。もっとも、否定的見解もしめされており、また、相関関係は必ずしも因果関係を意味しない。食事もまた微生物叢に影響を与える。母乳栄養は粉ミルクに比べ、新生児と母体の双方に健康上の利点があるとされるが、母乳に分泌される免疫グロブリンA、ラクトフェリン、ディフェンシンが少なからずこれに寄与すると考えられる[26]。
出典
- ^ 坂田恒昭、松本弥生「日本マイクロバイオームコンソーシアム(JMBC)の設立」『ファルマシア』第53巻第11号、2017年、1095-1097頁、doi:10.14894/faruawpsj.53.11_1095、NAID 130006191772。
- ^ a b c d J・アッカーマン「究極のソーシャルネット」『日経サイエンス』第42巻第10号、2012年10月、40-48頁、NAID 40019418088。
- ^ a b c d e f g h i 服部正平「個人差を生む マイクロバイオーム (特集 マイクロバイオーム : 細菌に満ちた私)」『日経サイエンス』第42巻第10号、2012年10月、50-57頁、NAID 40019418091。
- ^ a b c Anders Zachrisson、Svante Twetman 2013.
- ^ a b M・コンスタンディ「胃腸と脳の意外なつながり」『日経サイエンス』第42巻第10号、2012年10月、58-63頁、NAID 40019418100。
- ^ a b Byrd, Allyson L.; Belkaid, Yasmine; Segre, Julia A. (2018-03). “The human skin microbiome” (英語). Nature Reviews Microbiology 16 (3): 143-155. doi:10.1038/nrmicro.2017.157. ISSN 1740-1526.
- ^ Sender, Ron; Fuchs, Shai; Milo, Ron (2016-08-19). “Revised Estimates for the Number of Human and Bacteria Cells in the Body” (英語). PLOS Biology 14 (8): e1002533. doi:10.1371/journal.pbio.1002533. ISSN 1545-7885. PMC PMC4991899. PMID 27541692.
- ^ a b Rowan-Nash, Aislinn D.; Korry, Benjamin J.; Mylonakis, Eleftherios; Belenky, Peter (2019-01-09). “Cross-Domain and Viral Interactions in the Microbiome” (英語). Microbiology and Molecular Biology Reviews 83 (1): e00044-18, /mmbr/83/1/e00044-18.atom. doi:10.1128/MMBR.00044-18. ISSN 1092-2172. PMC PMC6383444. PMID 30626617.
- ^ NIH HMP Working Group; Peterson, Jane; Garges, Susan; Giovanni, Maria; McInnes, Pamela; Wang, Lu; Schloss, Jeffery A.; Bonazzi, Vivien et al. (2009-12). “The NIH Human Microbiome Project”. Genome Research 19 (12): 2317-2323. doi:10.1101/gr.096651.109. ISSN 1549-5469. PMC 2792171. PMID 19819907.
- ^ Qin, Junjie; Li, Ruiqiang; Raes, Jeroen; Arumugam, Manimozhiyan; Burgdorf, Kristoffer Solvsten; Manichanh, Chaysavanh; Nielsen, Trine; Pons, Nicolas et al. (2010-03). “A human gut microbial gene catalogue established by metagenomic sequencing” (英語). Nature 464 (7285): 59-65. doi:10.1038/nature08821. ISSN 1476-4687.
- ^ Costello, Elizabeth K.; Lauber, Christian L.; Hamady, Micah; Fierer, Noah; Gordon, Jeffrey I.; Knight, Rob (2009-12-18). “Bacterial Community Variation in Human Body Habitats Across Space and Time” (英語). Science 326 (5960): 1694-1697. doi:10.1126/science.1177486. ISSN 0036-8075. PMID 19892944.
- ^ a b The Human Microbiome Project Consortium (2012-06). “Structure, function and diversity of the healthy human microbiome” (英語). Nature 486 (7402): 207-214. doi:10.1038/nature11234. ISSN 0028-0836. PMC PMC3564958. PMID 22699609.
- ^ Arumugam, Manimozhiyan; Raes, Jeroen; Pelletier, Eric; Le Paslier, Denis; Yamada, Takuji; Mende, Daniel R.; Fernandes, Gabriel R.; Tap, Julien et al. (2011-05-12). “Enterotypes of the human gut microbiome”. Nature 473 (7346): 174-180. doi:10.1038/nature09944. ISSN 1476-4687. PMC 3728647. PMID 21508958.
- ^ 安藤朗『新たな臓器としての腸内細菌叢』一般財団法人 日本消化器病学会、2015年。doi:10.11405/nisshoshi.112.1939。2020年8月2日閲覧。
- ^ Qin, Junjie; Li, Yingrui; Cai, Zhiming; Li, Shenghui; Zhu, Jianfeng; Zhang, Fan; Liang, Suisha; Zhang, Wenwei et al. (2012-10). “A metagenome-wide association study of gut microbiota in type 2 diabetes” (英語). Nature 490 (7418): 55-60. doi:10.1038/nature11450. ISSN 1476-4687.
- ^ Larsen, Nadja; Vogensen, Finn K.; Berg, Frans W. J. van den; Nielsen, Dennis Sandris; Andreasen, Anne Sofie; Pedersen, Bente K.; Al-Soud, Waleed Abu; Sørensen, Søren J. et al. (2010-02-05). “Gut Microbiota in Human Adults with Type 2 Diabetes Differs from Non-Diabetic Adults” (英語). PLOS ONE 5 (2): e9085. doi:10.1371/journal.pone.0009085. ISSN 1932-6203. PMC PMC2816710. PMID 20140211.
- ^ Ussar, Siegfried; Griffin, Nicholas W.; Bezy, Olivier; Fujisaka, Shiho; Vienberg, Sara; Softic, Samir; Deng, Luxue; Bry, Lynn et al. (2015-09-01). “Interactions between Gut Microbiota, Host Genetics and Diet Modulate the Predisposition to Obesity and Metabolic Syndrome”. Cell Metabolism 22 (3): 516-530. doi:10.1016/j.cmet.2015.07.007. ISSN 1932-7420. PMC 4570502. PMID 26299453.
- ^ Rook, G. a. W.; Brunet, L. R. (2005-03). “Microbes, immunoregulation, and the gut”. Gut 54 (3): 317-320. doi:10.1136/gut.2004.053785. ISSN 0017-5749. PMC 1774411. PMID 15710972.
- ^ Lane, Erin R.; Zisman, Timothy L.; Suskind, David L. (2017). “The microbiota in inflammatory bowel disease: current and therapeutic insights”. Journal of Inflammation Research 10: 63-73. doi:10.2147/JIR.S116088. ISSN 1178-7031. PMC 5473501. PMID 28652796.
- ^ a b c Kilian, M.; Chapple, I. L. C.; Hannig, M.; Marsh, P. D.; Meuric, V.; Pedersen, A. M. L.; Tonetti, M. S.; Wade, W. G. et al. (2016-11). “The oral microbiome - an update for oral healthcare professionals” (英語). British Dental Journal 221 (10): 657-666. doi:10.1038/sj.bdj.2016.865. ISSN 1476-5373.
- ^ a b Krishnan, K; Chen, T; Paster, Bj (2017-04). “A practical guide to the oral microbiome and its relation to health and disease” (英語). Oral Diseases 23 (3): 276-286. doi:10.1111/odi.12509. PMC PMC5122475. PMID 27219464.
- ^ NISC Comparative Sequencing Program; Oh, Julia; Byrd, Allyson L.; Deming, Clay; Conlan, Sean; Kong, Heidi H.; Segre, Julia A. (2014-10). “Biogeography and individuality shape function in the human skin metagenome” (英語). Nature 514 (7520): 59-64. doi:10.1038/nature13786. ISSN 0028-0836. PMC PMC4185404. PMID 25279917.
- ^ Ma, Bing; Forney, Larry J.; Ravel, Jacques (2012). “Vaginal microbiome: rethinking health and disease”. Annual Review of Microbiology 66: 371-389. doi:10.1146/annurev-micro-092611-150157. ISSN 1545-3251. PMC 3780402. PMID 22746335.
- ^ Kaambo, Evelyn; Africa, Charlene; Chambuso, Ramadhani; Passmore, Jo-Ann Shelley (2018). “Vaginal Microbiomes Associated With Aerobic Vaginitis and Bacterial Vaginosis” (English). Frontiers in Public Health 6. doi:10.3389/fpubh.2018.00078. ISSN 2296-2565.
- ^ Dominguez-Bello, Maria G.; Costello, Elizabeth K.; Contreras, Monica; Magris, Magda; Hidalgo, Glida; Fierer, Noah; Knight, Rob (2010-06-29). “Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns” (英語). Proceedings of the National Academy of Sciences 107 (26): 11971-11975. doi:10.1073/pnas.1002601107. ISSN 0027-8424. PMID 20566857.
- ^ a b c Tamburini, Sabrina; Shen, Nan; Wu, Han Chih; Clemente, Jose C (2016-07). “The microbiome in early life: implications for health outcomes” (英語). Nature Medicine 22 (7): 713-722. doi:10.1038/nm.4142. ISSN 1078-8956.
- ^ 実験医学別冊 もっとよくわかる!シリーズ もっとよくわかる!腸内細菌叢 健康と疾患を司る“もう1つの臓器”. 福田真嗣. 羊土社. ISBN 978-4-7581-2206-1. OCLC 1122630567
- ^ Perez-Muñoz, Maria Elisa; Arrieta, Marie-Claire; Ramer-Tait, Amanda E.; Walter, Jens (2017-04-28). “A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome” (英語). Microbiome 5 (1): 48. doi:10.1186/s40168-017-0268-4. ISSN 2049-2618. PMC PMC5410102. PMID 28454555.
- ^ de Goffau, Marcus C.; Lager, Susanne; Sovio, Ulla; Gaccioli, Francesca; Cook, Emma; Peacock, Sharon J.; Parkhill, Julian; Charnock-Jones, D. Stephen et al. (2019-07-10). “Human placenta has no microbiome but can harbour potential pathogens”. Nature 572 (7769): 329-334. doi:10.1038/s41586-019-1451-5. ISSN 0028-0836. PMC 6697540. PMID 31367035.
参考文献
- 鴨井久一編集『口腔プロバイオティクス&アンチバイオティクス ― 検査から始まる細菌の新しいコントロール法』永末書店、2013年。ISBN 978-4-8160-1262-4。
- Anders Zachrisson、Svante Twetman「プロバイオティクスからみた口腔細菌療法」『口腔プロバイオティクス&アンチバイオティクス』永末書店、2013年、85-99頁。ISBN 978-4-8160-1262-4。
