抗微生物薬耐性

抗微生物薬耐性(こうびせいぶつやくたいせい、英語: Antimicrobial resistance, AMRまたはAR)は、微生物に対して薬が効かなくなることで、微生物がかつてはうまく治療することができた薬の影響に抵抗する能力[2][3][4]。
抗生物質に対して耐性を持つようになったバクテリアにのみ用いられる抗生物質耐性(英語: antibiotic resistance, ARまたはABR)という用語は、AMRの部分集合となる[3]。
耐性を獲得した微生物は治療がより困難であり、代替薬物療法またはより高用量の抗菌薬を必要とする。これらの治療法は、より高価またはより有毒、あるいはその両方である。
複数の抗微生物薬に耐性のある微生物は、多剤耐性 (MDR)と呼ばれる。広範囲薬剤耐性(英語: extensively drug resistance, XDR)または完全薬剤耐性(英語: totally drug-resistant, TDR)と考えられるものは、しばしば「スーパーバグ(英語: superbug)」と呼ばれる[5]。
概要
[編集]耐性は、3つのメカニズムのうちの1つを介して発生する:ある特定の種類の細菌が持つ自然耐性、遺伝子変異、または別の種から耐性を獲得することによる[6]。すべての種類の微生物には、耐性を発現する可能性がある。真菌は抗真菌剤耐性を、ウイルスは抗ウイルス薬耐性を、原虫は抗原虫薬耐性を、細菌は抗生物質耐性を発現する。ランダムな突然変異のため、抵抗性が自然発生することもある。しかしながら、抗微生物薬の長期使用により、抗微生物薬が無効になる可能性がある突然変異を促進すると考えられている[7]。
予防策として、必要なときにのみ抗生物質を使用することが含まれ、それによって抗生物質や抗微生物薬の濫用を防ぐことができる[8][9]。特定の生物を効果的かつ正確に標的にすることは、副作用だけでなく耐性を引き起こす可能性も低いため、可能な場合は、スペクトルの広い抗生物質よりもスペクトルの狭いものを用いることが好ましい[10][11]。これらの薬を外来で飲む人々にとって、適切な使用法についての教育は不可欠となる。医療提供者は、手洗い、消毒を含む適切な公衆衛生と衛生習慣によって耐性感染症の蔓延を最小限に抑えることができ、患者、訪問者や家族にも同じことを奨励する必要がある[12]。
薬剤耐性の増加は、主にヒトや他の動物における抗微生物剤の使用、およびその2つの間での耐性菌の拡散によって引き起こされる[8]。特に原薬を製造している国々で、薬剤耐性の増加は、製薬工場で不適切に処理された排水の投棄にも関連している[13]。抗生物質は微生物の淘汰圧を高め、脆弱な細菌を死滅させる。これは成長し続ける耐性菌の割合を増やすことに繋がる。非常に低レベルの抗生物質であっても、耐性菌は増殖の利点を持ち、脆弱な菌よりも速く増殖することができる[14]。抗生物質に対する耐性がより一般的になるにつれて、代替治療法の必要性が高まっている。新しい抗生物質療法が求められているが、新薬開発は稀になりつつある[15]。
発展途上国で抗生物質へのアクセスが増えたため、抗微生剤耐性が世界的に高まっている[16]。推定では、年間70万人から数百万人が死亡している[17][18]。米国では毎年、少なくとも200万人が抗生物質に耐性のある細菌に感染し、その結果少なくとも23,000人が死亡している[19]。抗微生物薬耐性に関する国際条約の提案を含め、脅威に対処するための世界的な集団行動を求める公衆の呼びかけがある [20]。世界的な抗微生物薬耐性は完全には確認されていないが、医療制度が弱い貧困国ほど影響を受けている[9]。
定義
[編集]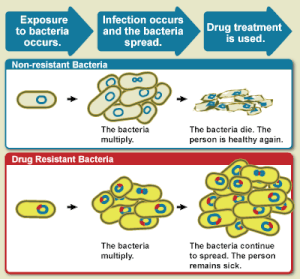
WHOは、抗微生物薬耐性を、「かつてはその微生物による感染症を治療することができた抗微生物薬に対して、微生物が獲得した耐性」と定義している[3]。ヒトは抗生物質に対して耐性になることはない。耐性は微生物の特性であり、微生物に感染したヒトや他の生物ではない[22]。
抗生物質耐性は抗微生物薬耐性の部分集合である。この、より特定された耐性は病原性細菌に関連しており、したがって、微生物学的および臨床的の2つのさらなる部分集合に分類される。微生物学的耐性は最も一般的であり、変異または遺伝する遺伝子が原因で発生する。これにより、細菌は特定の抗生物質に関連するメカニズムに抵抗できるようになる。臨床的耐性は、通常、感受性の細菌が治療され、耐性細菌が生き残った結果、つまり多くの治療技術の失敗を通して示される。いずれの場合も、細菌は、接合、形質導入、または形質転換を通して耐性を獲得する。これにより、同じ病原体または似た細菌性病原体にも耐性が広がることが可能になる[23]。
報告
[編集]2014年4月に発表された世界保健機関 (WHO)の報告書には、「この深刻な脅威はもはや将来の予測ではなく、世界のあらゆる地域で、今、どんな国でも起きている。抗生物質耐性 - 細菌が変化し感染を治療する必要がある人々に抗生物質が効かなくなったとき - は今や公衆衛生にとって大きな脅威となっている。」と記されている [24]。欧州疾病予防管理センターは、2015年に、抗生物質耐性菌によるEUおよび欧州経済地域での感染が671,689件発生し、その結果33,110人が死亡したと計算した。耐性獲得はほとんどが医療施設でなされた[25]。
2019年12月5日、国立国際医療研究センター病院・AMR臨床リファレンスセンターは、日本で初めて抗微生物薬耐性による深刻な被害を調査し、 MRSA菌血症とフルオロキノロン耐性大腸菌血症で年間約8,000名が死亡している、と報告した[26][27]。
原因
[編集]
抗生物質に対する耐性を有する細菌は、ヒトによる抗生物質の医学的使用の前から存在する[28][29]。しかしながら、広範な抗生物質の使用により、淘汰圧プロセスを通じてより多くの細菌に耐性をもたらした[30][7]。
ヒトの治療薬に抗生物質が広く使用される理由は次のとおり。
- 1950年代以降、世界的に利用可能になった
- 処方箋なしで店頭で入手できる多くの低所得国または中所得国で、規制を受けずに販売された。OTCとして販売された場合、抗生物質が適切に利用されていない可能性がある [31]:1060。これにより、生き残った細菌に耐性が出現する可能性がある。
他の原因として次のことが考えられる。
- 成長促進のために家畜飼料に低用量抗生物質を使用することは、多くの先進国で認められている慣習であり、耐性レベルの上昇をもたらすことが知られている[32][33]。
- 不適切な下水処理による医薬品製造工場からの大量の抗生物質の環境中への放出は、抗生物質耐性株が発生し広がる危険性を高める[34][35]。
- 抗菌石鹸および他の製品中に含まれる抗菌剤が抗生物質耐性に寄与するかどうかは不明でだが、抗菌石鹸は他の理由で推奨されない [36][37]。
防腐剤は、抗生物質や他の防腐剤に対してAMRを形成する。
防腐剤は細菌の耐性メカニズムを活性化するように見える。防腐剤は抗生物質と同様に、細菌に消毒剤の範囲に対する保護をもたらす。防腐剤は、病院の清掃や、多くの創傷治療用包帯に使用されている。これらの所見は、治療抵抗性の院内感染の増加を説明できるかもしれない。
消毒剤オクテニジン低用量に緑膿菌をさらすと、いくつかの異なる菌株が、他の消毒薬およびいくつかの異なる抗生物質に対する交差耐性を発現することが可能になった[38]。耐性レベルはかなりのものであり、すなわち、いくつかの場合において、同じ抗菌効果を得るためには、防腐剤の濃度を32倍にする必要があった。また、この増加した耐性は一過性のものではなく永久的だった。同じ研究チームは、肺炎桿菌がクロルヘキシジンに対する耐性を発現することができ、6つの株のうち5つが、最後の手段である抗生物質コリスチンに対して交差耐性を示したことを報告した[39]。
臨床的な意義
[編集]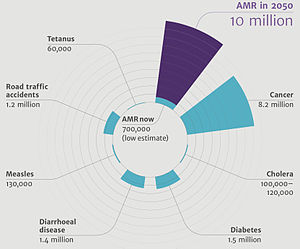
細菌耐性の増加は、処方された抗生物質の量、および抗生物質を服用する際の投与量の不足と関連している [40]。抗生物質の不適切な処方は、抗生物質を主張する患者や、なぜそれらが必要でないのかを説明する時間がないために医師が処方するなど、いくつかの原因による。もう1つの原因は、抗生物質を処方する時期を知らない医師、または医学的、法的な理由で慎重になりすぎることである[41]。例えば、下痢の70〜80パーセントはウイルス性病原体によって引き起こされ、抗生物質は効果的ではない。それにもかかわらず、これらの症例の約40%に対し、抗生物質による治療を試みられている[42]。一部の地域では、そのような症例の80%以上も抗生物質による治療を試みている[42]。
獣医学
[編集]この節には内容がありません。 (2019年11月) |
予防
[編集]
抗菌剤耐性に関する国際条約の提案を含む、脅威に対処するための世界的な集団行動の公衆の要求が高まっている。国際レベルで耐性の傾向を認識し、測定するためには、さらなる詳細と注意が依然として必要である。国際的な追跡システムが提案されているが、まだ実装には至っていない。プログラムの評価および抗生物質耐性との闘い、または克服のために行われてきた他の変化に必要な情報と同様に、このようなシステムは、高耐性の領域への見通しを提供するであろう。
歴史
[編集]この節には内容がありません。 (2019年11月) |
この節には内容がありません。 (2019年11月) |
さらなる研究
[編集]迅速なウイルス検査が小児の抗生物質の使用に影響するかどうかは不明[43]。
ワクチン
[編集]抗生物質が体の通常の防御とは別に作用するのに対し、ワクチンは体の免疫系を強化するため、微生物はワクチンに対する耐性を発現しない。また、ワクチンの使用が増加した場合、病原体の抗生物質耐性株が減少するという証拠がある。ワクチンは感染が発生する前に予防するため、抗生物質の必要性は自然に減少する[44]。ただし、病原体が進化し、ワクチンによって誘導される免疫を逃れる新しい株が発現する可能性がある。たとえば、インフルエンザワクチンは毎年更新された株が必要となる。
理論的には抗ブドウ球菌ワクチンは有望であるが、ブドウ球菌 種間の免疫学的なばらつきと、産生された抗体の有効性が限られた期間であるため、有効性が限定的である。より効果的なワクチンの開発と試験が進んでいる[45]。
交替療法
[編集]交替療法(Alternating therapy)は、2つまたは3つの抗生物質を輪番で用いる方法と、次の抗生物質に変えたときに1つの抗生物質に耐性のある細菌が死滅するように抗生物質を1つだけ用いる方法がある。研究により、この方法は単一の薬物のみを用いた場合と比較して、抗生物質耐性菌がin vitroで出現する速度を、全期間にわたって低下させることがわかっている[46]。
抗生物質の1つのグループに対して抗生物質耐性を進化させるバクテリアが、他のグループに対してより敏感になる可能性があることを、研究は示している[47]。この現象は、緑膿菌によって引き起こされる慢性感染症の治療戦略の開発に関連することが最近発見された、側副感度サイクリング(collateral sensitivity cycling)[48]と呼ばれるアプローチを使用して、耐性菌に対する薬剤選択に利用できる[49]。
新薬の開発
[編集]抗生物質の発見以来、研究開発(R&D)の努力により、古い抗生物質に耐性となった細菌の治療に間に合うように新薬が提供されてきたが、2000年代には深刻な病気の人が尽きて開発スピードが遅くなるという懸念すらあった[50][51]。別の懸念は、有害な感染のリスクが高まるため、医師が定期的な手術の実施に消極的になる可能性があることだ[52]。バックアップ処理には深刻な副作用がある。例えば、多剤耐性結核の治療は、難聴または心理的障害を引き起こす可能性がある[53]。間近にある潜在的な危機は、業界の研究開発の著しい減少の結果である[54]。抗生物質研究への財政投資が不十分なことで、状況を悪化させた[55][54]。製薬産業においては、リスクが高いため、また潜在的な経済的利益が他の医薬品よりも開発コストをカバーする可能性が低いため、抗生物質に投資するインセンティブがほとんど無い[56]。2011年、新しい抗生物質を開発している最後の大手製薬会社の1つであるファイザーは、慢性疾患の薬物に比べて株主の利益率が低いことを理由に、主要な研究努力を停止した[57]。ただし、中小規模の製薬会社は、抗生物質の研究に積極的に取り組んでいる。
米国で、製薬会社とバラク・オバマ大統領の政権は、FDAが耐性菌を標的とする抗生物質を承認する基準を変更することを提案していた[52][58]。
2014年9月18日、オバマ大統領は、米国大統領科学技術諮問委員会(PCAST)による報告[59]で提案された推奨事項を実施するための、新しい抗生物質に関する臨床試験研究開発推進の執行命令[60]に署名した。提案の中で:
- 危険な細菌感染に苦しんでいると特定された患者を即座に登録する「抗生物質検査のための堅牢で永続的な全国臨床試験ネットワーク」を作成する。このネットワークにより、安全性と有効性について、異なる企業の複数の新しい薬剤を同時にテストできる
- 限られた患者集団で使用するための新しい抗菌剤を承認するFDAの「特別な医療用途(Special Medical Use; SMU)」経路を確立し、重篤な感染症の患者ができるだけ早く利益を得ることができるよう、新薬の承認スケジュールを短縮
- 特に新しいクラスの抗生物質の開発に経済的インセンティブを提供することで、抗生物質を開発する業界を退ける急激な研究開発コストを相殺
古い治療法の再発見
[編集]古い処方に基づき成功した治療が発見されたマラリア治療の状況と同様に[61]、抗微生物薬耐性細菌に対して有効な、古くからある薬剤や他の治療の発見と試験に、すでにある程度成功している[62]。
迅速な診断
[編集]抗生物質を必要とする感染と自己制限的な感染を区別することは、臨床的には困難である。抗生物質の適切な使用を誘導し、抗菌薬耐性の発生と蔓延を防ぐために、臨床医に、タイムリーで実行可能な結果を提供する診断テストが必要とされる。
急性熱性疾患は、世界中で医療を求める一般的な理由であり、罹患率と死亡率の主な原因である。マラリアの発生率が低下している地域では、多くの発熱患者がマラリアに対して治療されることで不適切に処置されており、発熱の他の原因を特定するための簡単な診断テストがないため、臨床医は、非マラリア発熱疾患が細菌感染である可能性が高いと推測し、抗生物質の不適切な使用がなされている。複数の研究により、他の発熱の原因を識別するための信頼できるツールを使用しないマラリア迅速診断検査の使用により、抗生物質の使用が増加することが示されている[63]。
薬剤感受性試験(Antimicrobial susceptibility testing; AST)は、開業医のプレシジョン・メディシン[64]において、不必要な抗生物質を処方することを避け、効果的な抗生物質を処方するのに役立つが、従来のアプローチでは12〜48時間かかる[65]。分子診断(molecular diagnostics)の革新から可能になる迅速なテストは、「8時間の勤務シフト内で実行可能である」と定義されている。費用や規制などのさまざまな理由により、進展は遅かった[66]。
ファージ療法
[編集]ファージ療法は、病原性細菌感染症を治療するための、バクテリオファージの治療的使用[67]。ファージ療法は、ヒト対象の医学だけでなく、歯科、獣医学、農業にも多くの潜在的な用途がある[68]。
ファージ療法は、自然発生のバクテリオファージを使用して、宿主の感染部位で細菌に感染し、溶解する仕組みを利用している。遺伝学およびバイオテクノロジーの現在の進歩により、これらのバクテリオファージは特定の感染症を治療するために製造される可能性がある[69]。ファージは、多剤耐性細菌感染症を標的とするように生体工学的に設計でき、その使用には、人体の有益な細菌が除去されるのを防ぐという追加の利点が含まれる[69]。ファージは、内側から外側に多くの穴を開けて細菌を殺す溶解タンパク質の使用により、細菌の細胞壁と膜を破壊する[70]。バクテリオファージは、細菌を効果的に感染させて殺すために、抗生物質から細菌を保護する多くの細菌が発達するバイオフィルムを消化する能力さえ持つことができる。遺伝子工学により、有用なバクテリオファージが作成される[70]。
合理的なファージ治療には、ヒトまたは動物の身体環境における細菌およびファージ集団の相互作用と進化を理解することが不可欠[71]。
バクテリオファージ薬は、ジョージアのジョージ・エリアバ研究所(George Eliava Institute)およびポーランドのヴロツワフにある1つの研究所で、抗生物質耐性菌に対して用いられている[72][73]。バクテリオファージカクテルは、東欧の薬局店頭で販売されている一般用医薬品である[74][75]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ Kirby-Bauer Disk Diffusion Susceptibility Test Protocol Archived 2011-06-26 at the Wayback Machine., Jan Hudzicki, ASM
- ^ “Review on Antimicrobial Resistance”. amr-review.org. 25 September 2015時点のオリジナルよりアーカイブ。20 May 2016閲覧。
- ^ a b c “Antimicrobial resistance Fact sheet N°194”. who.int (April 2014). 10 March 2015時点のオリジナルよりアーカイブ。7 March 2015閲覧。
- ^ “About Antimicrobial Resistance - Antibiotic/Antimicrobial Resistance - CDC”. www.cdc.gov (19 September 2017). 1 October 2017時点のオリジナルよりアーカイブ。8 September 2017閲覧。
- ^ “Antibiotic Resistance Questions & Answers”. Get Smart: Know When Antibiotics Work. Centers for Disease Control and Prevention, USA (30 June 2009). 29 March 2013時点のオリジナルよりアーカイブ。20 March 2013閲覧。
- ^ “General Background: About Antibiotic Resistance”. www.tufts.edu. 23 October 2015時点のオリジナルよりアーカイブ。2015年10月30日閲覧。
- ^ a b “Outpatient antibiotic use in Europe and association with resistance: a cross-national database study”. Lancet 365 (9459): 579–87. (2005). doi:10.1016/S0140-6736(05)17907-0. PMID 15708101.(
 要購読契約)
要購読契約)
- ^ a b “About Antimicrobial Resistance”. www.cdc.gov (2018年9月10日). 1 October 2017時点のオリジナルよりアーカイブ。2015年10月30日閲覧。
- ^ a b Swedish work on containment of antibiotic resistance – Tools, methods and experiences. Stockholm: Public Health Agency of Sweden. (2014). pp. 16–17, 121–128. ISBN 978-91-7603-011-0. オリジナルの23 July 2015時点におけるアーカイブ。 23 July 2015閲覧。
- ^ “Duration of antibiotic therapy and resistance”. NPS Medicinewise. National Prescribing Service Limited trading, Australia (13 June 2013). 23 July 2015時点のオリジナルよりアーカイブ。22 July 2015閲覧。
- ^ “Association of Broad- vs Narrow-Spectrum Antibiotics With Treatment Failure, Adverse Events, and Quality of Life in Children With Acute Respiratory Tract Infections”. JAMA 318 (23): 2325–2336. (December 2017). doi:10.1001/jama.2017.18715. PMC 5820700. PMID 29260224.
- ^ “CDC Features – Mission Critical: Preventing Antibiotic Resistance”. www.cdc.gov (2018年4月4日). 8 November 2017時点のオリジナルよりアーカイブ。2015年7月22日閲覧。
- ^ Changing Markets. “IMPACTS OF PHARMACEUTICAL POLLUTION ON COMMUNITIES AND ENVIRONMENT IN INDIA”. Nordea. Nordea. 20 May 2017時点のオリジナルよりアーカイブ。1 May 2018閲覧。
- ^ “Selection of resistant bacteria at very low antibiotic concentrations”. PLoS Pathogens 7 (7): e1002158. (July 2011). doi:10.1371/journal.ppat.1002158. PMC 3141051. PMID 21811410.
- ^ “A new strategy to fight antimicrobial resistance: the revival of old antibiotics”. Frontiers in Microbiology 5: 551. (2014). doi:10.3389/fmicb.2014.00551. PMC 4202707. PMID 25368610.
- ^ Sample, Ian (2018年3月26日). “Calls to rein in antibiotic use after study shows 65% increase worldwide”. The Guardian. オリジナルの8 April 2018時点におけるアーカイブ。 2018年3月28日閲覧。
- ^ WHO (April 2014). “Antimicrobial resistance: global report on surveillance 2014”. WHO. WHO. 15 May 2015時点のオリジナルよりアーカイブ。May 9, 2015閲覧。
- ^ a b O'neill (May 2016). “TACKLING DRUG-RESISTANT INFECTIONS GLOBALLY: FINAL REPORT AND RECOMMENDATIONS”. amr-review.org/. 14 November 2017時点のオリジナルよりアーカイブ。November 10, 2017閲覧。
- ^ “Antibiotic / Antimicrobial Resistance - CDC”. www.cdc.gov (18 August 2017). 7 October 2016時点のオリジナルよりアーカイブ。6 October 2016閲覧。
- ^ “An international legal framework to address antimicrobial resistance”. Bulletin of the World Health Organization 93 (2): 66. (February 2015). doi:10.2471/BLT.15.152710. PMC 4339972. PMID 25883395.
- ^ “What is Drug Resistance?”. www.niaid.nih.gov. 27 July 2015時点のオリジナルよりアーカイブ。2015年7月26日閲覧。
- ^ “CDC: Get Smart: Know When Antibiotics Work”. Cdc.gov (2018年5月29日). 29 April 2015時点のオリジナルよりアーカイブ。2013年6月12日閲覧。
- ^ Macnaughton, Emily; MacGowan, Alasdair (2017-10-01). “Antibiotic resistance” (English). Medicine 45 (10): 622–628. doi:10.1016/j.mpmed.2017.07.006. ISSN 1357-3039.
- ^ "WHO's first global report on antibiotic resistance reveals serious, worldwide threat to public health" Archived 2 May 2014 at the Wayback Machine. Retrieved 2014-05-02
- ^ “Antibiotic-resistant bacteria responsible for over 33,000 deaths in Europe in 2015, study finds”. Pharmaceutical Journal. (7 November 2018) 16 December 2018閲覧。
- ^ Press Release AMR臨床リファレンスセンター (PDF)
- ^ Shinya Tsuzuki; Nobuaki Matsunaga, Koji Yahara, Yoshiaki Gu, Kayoko Hayakawa, Aki Hirabayashi, Toshiki Kajihara, Motoyuki Sugai, Keigo Shibayama, Norio Ohmagari. [https://reader.elsevier.com/reader/sd/pii/S1341321X19303356?token=D5DDA26127EA1E3927A26245865ACB94CC232733E42634F6EF1A6662C601893BF0661E715CFF95284C14EFD2AA5C063A “National trend of blood-stream infection attributable deaths caused by Staphylococcus aureus and Escherichia coli in Japan”]. Journal of Infection and Chemotherapy (Elsevier) 2019年12月9日閲覧。.
- ^ “Antibiotic resistance is ancient”. Nature 477 (7365): 457–61. (August 2011). Bibcode: 2011Natur.477..457D. doi:10.1038/nature10388. PMID 21881561.
- ^ Caldwell & Lindberg 2011.
- ^ Hawkey & Jones 2009, pp. i3–i10.
- ^ “Antibiotic resistance-the need for global solutions”. The Lancet. Infectious Diseases 13 (12): 1057–98. (December 2013). doi:10.1016/S1473-3099(13)70318-9. PMID 24252483. As PDF Archived 24 September 2015 at the Wayback Machine..
- ^ “Antibiotic resistance. Livestock feed ban preserves drugs' power”. Science 295 (5552): 27–8. (January 2002). doi:10.1126/science.295.5552.27a. PMID 11778017.(
 要購読契約)
要購読契約)
- ^ “Antibiotic resistance in bacteria associated with food animals: a United States perspective of livestock production”. Foodborne Pathogens and Disease 4 (2): 115–33. (2007). doi:10.1089/fpd.2006.0066. PMID 17600481.
- ^ “Pharmaceuticals Sold In Sweden Cause Serious Environmental Harm In India, Research Shows”. ScienceDaily (ScienceDaily, LLC). (7 February 2009). オリジナルの4 February 2015時点におけるアーカイブ。 29 January 2015閲覧. "We estimated that the[water] treatment plant released 45 kilograms of the antibiotic ciprofloxacin in one day, which is equivalent to five times the daily consumption of Sweden,”"
- ^ “Transparency throughout the production chain--a way to reduce pollution from the manufacturing of pharmaceuticals?”. Regulatory Toxicology and Pharmacology 53 (3): 161–3. (April 2009). doi:10.1016/j.yrtph.2009.01.008. PMID 19545507.(
 要購読契約)
要購読契約)
- ^ CDC (2018年5月29日). “Antibiotic Resistance Questions and Answers”. Centers for Disease Control and Prevention. 29 April 2015時点のオリジナルよりアーカイブ。February 25, 2015閲覧。
- ^ “Consumer antibacterial soaps: effective or just risky?”. Clinical Infectious Diseases 45 Suppl 2 (Supplement 2): S137–47. (September 2007). doi:10.1086/519255. PMID 17683018.
- ^ “Pseudomonas aeruginosa adapts to octenidine in the laboratory and a simulated clinical setting, leading to increased tolerance to chlorhexidine and other biocides”. The Journal of Hospital Infection 100 (3): e23–e29. (November 2018). doi:10.1016/j.jhin.2018.03.037. PMID 29614247.
- ^ “Mechanisms of Increased Resistance to Chlorhexidine and Cross-Resistance to Colistin following Exposure of Klebsiella pneumoniae Clinical Isolates to Chlorhexidine”. Antimicrobial Agents and Chemotherapy 61 (1). (January 2017). doi:10.1128/AAC.01162-16. PMC 5192135. PMID 27799211.
- ^ “Patients' interviews and misuse of antibiotics”. Clinical Infectious Diseases 33 Suppl 3: S170–3. (September 2001). doi:10.1086/321844. PMID 11524715.
- ^ “Interventions to improve antibiotic prescribing practices in ambulatory care”. The Cochrane Database of Systematic Reviews (4): CD003539. (October 2005). doi:10.1002/14651858.CD003539.pub2. PMID 16235325.
- ^ a b Araya (May 2016). “The Impact of Water and Sanitation on Diarrhoeal Disease Burden and Over-Consumption of Anitbiotics.”. 1 October 2017時点のオリジナルよりアーカイブ。November 12, 2017閲覧。
- ^ “Rapid viral diagnosis for acute febrile respiratory illness in children in the Emergency Department”. The Cochrane Database of Systematic Reviews 9 (9): CD006452. (September 2014). doi:10.1002/14651858.CD006452.pub4. PMC 6718218. PMID 25222468.
- ^ “Vaccines and antibiotic resistance”. Current Opinion in Microbiology 15 (5): 596–602. (October 2012). doi:10.1016/j.mib.2012.08.002. PMID 22981392.
- ^ “Immunity, Infectious Diseases, and Pandemics—What You Can Do”. HomesteadSchools.com. 3 December 2013時点のオリジナルよりアーカイブ。2013年6月12日閲覧。
- ^ “Alternating antibiotic treatments constrain evolutionary paths to multidrug resistance”. Proceedings of the National Academy of Sciences of the United States of America 111 (40): 14494–9. (October 2014). Bibcode: 2014PNAS..11114494K. doi:10.1073/pnas.1409800111. PMC 4210010. PMID 25246554.
- ^ “Collateral sensitivity of antibiotic-resistant microbes”. Trends in Microbiology 23 (7): 401–7. (July 2015). doi:10.1016/j.tim.2015.02.009. PMC 5958998. PMID 25818802.
- ^ “Use of collateral sensitivity networks to design drug cycling protocols that avoid resistance development”. Science Translational Medicine 5 (204): 204ra132. (September 2013). doi:10.1126/scitranslmed.3006609. PMID 24068739.
- ^ “Drug-Driven Phenotypic Convergence Supports Rational Treatment Strategies of Chronic Infections”. Cell 172 (1–2): 121–134.e14. (January 2018). doi:10.1016/j.cell.2017.12.012. PMC 5766827. PMID 29307490.
- ^ “Design and Synthesis of Molecular Scaffolds with Anti-infective Activity”. Tetrahedron 72 (25): 3579–3592. (June 2016). doi:10.1016/j.tet.2016.01.044. PMC 4894353. PMID 27284210.
- ^ “Annual Report of the Chief Medical Officer - Infections and the rise of antimicrobial resistance”. UK NHS (2011年). 30 October 2013時点のオリジナルよりアーカイブ。2019年12月9日閲覧。
- ^ a b “Obama Administration Seeks To Ease Approvals For Antibiotics”. NPR (4 June 2013). 13 March 2015時点のオリジナルよりアーカイブ。7 August 2016閲覧。
- ^ “Moldova Grapples With Whether To Isolate TB Patients”. NPR (4 June 2013). 3 August 2016時点のオリジナルよりアーカイブ。7 August 2016閲覧。
- ^ a b Walsh, Fergus (11 March 2013). “BBC News — Antibiotics resistance 'as big a risk as terrorism' – medical chief”. BBC News (Bbc.co.uk). オリジナルの8 August 2018時点におけるアーカイブ。 2013年3月12日閲覧。
- ^ Khor, Martin (2014年5月18日). “Why Are Antibiotics Becoming Useless All Over the World?”. The Real News. 18 May 2014時点のオリジナルよりアーカイブ。2014年5月18日閲覧。
- ^ Nordrum, Amy (2015年3月3日). “Antibiotic Resistance: Why Aren't Drug Companies Developing New Medicines to Stop Superbugs?”. International Business Times. 2019年12月9日閲覧。
- ^ Gever, John (2011年2月4日). “Pfizer Moves May Dim Prospect for New Antibiotics”. MedPage Today. 14 December 2013時点のオリジナルよりアーカイブ。2013年3月12日閲覧。
- ^ “FDA under pressure to relax drug rules”. Nature 492 (7427): 19. (December 2012). Bibcode: 2012Natur.492...19L. doi:10.1038/492019a. PMID 23222585.
- ^ Office of the Press Secretary (18 September 2014). “Executive Order – Combating Antibiotics-Resistant Bacteria”. The White House. 22 September 2014時点のオリジナルよりアーカイブ。22 September 2014閲覧。
- ^ President's Council of Advisors on Science and Technology (September 2014). “Report to the President on Combating Antibiotic Resistance”. PCAST. 22 September 2014時点のオリジナルよりアーカイブ。22 September 2014閲覧。
- ^ Getting Medieval on Bacteria: Ancient Books May Point to New Antibiotics
- ^ AncientBiotics - a medieval remedy for modern day superbugs?
- ^ Hopkins, Heidi; Bruxvoort, Katia J; Cairns, Matthew E; Chandler, Clare I R; Leurent, Baptiste; Ansah, Evelyn K; Baiden, Frank; Baltzell, Kimberly A et al. (2017-03-29). “Impact of introduction of rapid diagnostic tests for malaria on antibiotic prescribing: analysis of observational and randomised studies in public and private healthcare settings” (英語). BMJ 356: j1054. doi:10.1136/bmj.j1054. ISSN 0959-8138. PMC 5370398. PMID 28356302.
- ^ “Diagnostics Are Helping Counter Antimicrobial Resistance, But More Work Is Needed”. MDDI Online. (2018年11月20日) 2018年12月2日閲覧。
- ^ “Developmental roadmap for antimicrobial susceptibility testing systems”. Nature Reviews. Microbiology 17 (1): 51–62. (January 2019). doi:10.1038/s41579-018-0098-9. hdl:2445/132505. PMID 30333569.
- ^ “Progress on antibiotic resistance”. Nature 562 (7727): 307. (October 2018). Bibcode: 2018Natur.562Q.307.. doi:10.1038/d41586-018-07031-7. PMID 30333595.
- ^ “Silent Killers: Fantastic Phages?”. 10 February 2013時点のオリジナルよりアーカイブ。14 November 2017閲覧。
- ^ McAuliffe (2007). “The New Phage Biology: From Genomics to Applications" (introduction)”. Bacteriophage: Genetics and Molecular Biology. Caister Academic Press. ISBN 978-1-904455-14-1
- ^ a b “Phage therapy: An alternative to antibiotics in the age of multi-drug resistance”. World Journal of Gastrointestinal Pharmacology and Therapeutics 8 (3): 162–173. (August 2017). doi:10.4292/wjgpt.v8.i3.162. PMC 5547374. PMID 28828194.
- ^ a b “A century of the phage: past, present and future”. Nature Reviews. Microbiology 13 (12): 777–86. (December 2015). doi:10.1038/nrmicro3564. PMID 26548913.
- ^ “Ecological basis for rational phage therapy”. Acta Naturae 2 (1): 60–72. (April 2010). doi:10.32607/20758251-2010-2-1-60-71. PMC 3347537. PMID 22649629.
- ^ “Georgia: an unlikely stronghold for bacteriophage therapy”. Lancet 365 (9478): 2166–7. (June 2005). doi:10.1016/S0140-6736(05)66759-1. PMID 15986542.
- ^ “Bacteriophage therapy: a potential solution for the antibiotic resistance crisis”. Journal of Infection in Developing Countries 8 (2): 129–36. (February 2014). doi:10.3855/jidc.3573. PMID 24518621.
- ^ “Safety analysis of a Russian phage cocktail: from metagenomic analysis to oral application in healthy human subjects”. Virology 443 (2): 187–96. (September 2013). doi:10.1016/j.virol.2013.05.022. PMID 23755967.
- ^ “Phage treatment of human infections”. Bacteriophage 1 (2): 66–85. (March 2011). doi:10.4161/bact.1.2.15845. PMC 3278644. PMID 22334863.
書籍
[編集]- “Understanding Evolution” [Mutations are random]. University of California Museum of Paleontology (2011年). 2019年7月5日閲覧。
- Reynolds LA; Tansey EM, eds (2008). Superbugs and superdrugs : a history of MRSA : the transcript of a Witness Seminar held by the Wellcome Trust Centre for the History of Medicine at UCL, London, on 11 July 2006. London: Wellcome Trust Centre for the History of Medicine at UCL. ISBN 978-0-85484-114-1
- OECD (2018年)、Stemming the Superbug Tide: Just A Few Dollars More、OECD出版、パリ。doi:10.1787/9789264307599-en
学術論文
[編集]- Awerdick, Jason (2017-07-25). “Antibiotics come with ‘environmental side effects,’ experts say”. Microchemical Journal (Elsevier) 2019年12月9日閲覧。.
関連項目
[編集]外部リンク
[編集]- 抗微生物薬耐性 - Curlie(英語)
- 抗生物質耐性のアニメーション(英語) - PharmaXChange.info
- 医療現場における多剤耐性生物の管理、2006年(英語) - CDCガイドライン
- 抗菌剤管理プロジェクト (英語) - ミネソタ大学感染症研究政策センター (CIDRAP)
- AMR Industry Alliance (英語) - 大手R&D製薬会社、ジェネリックメーカー、バイオテクノロジー、診断会社のアライアンス
- AMR臨床リファレンスセンター - 国立研究開発法人 国立国際医療研究センター
