過レニウム酸アンモニウム
表示
| 過レニウム酸アンモニウム | |
|---|---|

| |

| |
別称 レニウム(VII)酸アンモニウム | |
| 識別情報 | |
| CAS登録番号 | 13598-65-7 |
| PubChem | 3084163 |
| ChemSpider | 2341271 |
| EC番号 | 237-075-6 |
| |
| |
| 特性 | |
| 化学式 | NH4ReO4 |
| モル質量 | 268.2359 g/mol |
| 密度 | 3.97 g/cm3, solid |
| 融点 |
°C |
| 水への溶解度 | 2.8 g/100 mL (0 °C), 6.2 g/100 mL (20 °C), 12.0 g/100 mL (40 °C), 20.7 g/100 mL (60 °C), 32.3 g/100 mL (80 °C), 39.1 g/100 mL (90 °C) |
| 構造 | |
| 結晶構造 | scheelite |
| 配位構造 | N/A |
| 危険性 | |
| 引火点 | Non-flammable |
| 関連する物質 | |
| その他の陰イオン | マンガン酸塩アンモニウム、過テクネチウム酸アンモニウム |
| その他の陽イオン | 過レニウム酸ナトリウム、過レニウム酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
過レニウム酸アンモニウム(かレニウムさんアンモニウム、APR)は、分子式NH4ReO4で表される過レニウム酸のアンモニウム塩。レニウムを販売する際に最も一般的な形態である。色は白く水溶性の塩である。レニウムが発見されてすぐに記述された物質である[1]。
構造
[編集]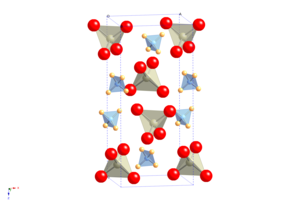
結晶構造は、原子陽イオンがアンモニウム分子陽イオンで置き換えられている灰重石の結晶構造である[2]。これは、空間群を変えずに冷却時に分子配向秩序の遷移を起こすが、単位格子の形状は高い異方性の変化を起こし、正の温度・圧力ReNQR係数を有するという異常性質をもたらす[3]。
NH4ReO4は、過テクネチウム酸塩(NH4TcO4)、過ヨウ素酸塩(NH4IO4)、テトラクロロタリウム酸(NH4TlCl4)、テトラクロロインジウム酸(NH4InCl4)などのアンモニウム灰重石の原型構造とみなすことができる[2]。
調合
[編集]実質的には全ての一般的なレニウム源から調合することができる。金属、酸化物、硫化物を硝酸で酸化し、得られた溶液をアンモニア水で処理することでできる。もしくは、Re2O7の水溶液をアンモニアで処理し、結晶化することで得られる[4][5]。
反応
[編集]純粋なレニウム粉末は、水素の存在下でAPRを加熱することにより製造することができる[4]。
- 2 NH4ReO4 + 7 H2 → 2 Re + 8 H2O + 2 NH3
APRは250℃から揮発性のRe2O7に分解するためゆっくり加熱しなくてはならない。密閉管中で500℃に加熱するとAPRは二酸化レニウムに分解する[4]。
- 2NH4ReO4 → 2ReO2 + N2 + 4 H2O
脚注
[編集]- ^ Noddack, J.; Noddack, W. (1929). “Die Sauerstoffverbindungen des Rheniums”. Zeitschrift für anorganische und allgemeine Chemie 181: 1–37. doi:10.1002/zaac.19291810102.
- ^ a b I. P. Swainson and R. J. C. Brown (1997). “Refinement of ammonium perrhenate structure using a pseudo-spin model for the ammonium ion orientation”. Acta Crystallographica B53: 76–81. doi:10.1107/S0108768196011160.
- ^ R. J. C. Brown and S. L. Segel (1977). “187Re, 14N, and 2H nuclear quadrupole couplings in NH4ReO4: Evidence for a possible phase transition”. Journal of Chemical Physics 67 (7): 3163–7. doi:10.1063/1.435229.
- ^ a b c O. Glemser "Ammonium Perrhenate" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, New York. vol. 1. p. 1476–85.
- ^ Richard J. Thompson (1966). “Ammonium Perrhenate”. Inorganic Syntheses 8: 171–173. doi:10.1002/9780470132395.ch44.
