デヒドロアラニン
| デヒドロアラニン | |
|---|---|
| |
| |
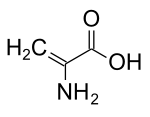
2-Aminoprop-2-enoic acid | |
| 識別情報 | |
| CAS登録番号 | 1948-56-7 |
| PubChem | 123991 |
| ChemSpider | 110510 |
| DrugBank | DB02688 |
| KEGG | C02218 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | C3H5NO2 |
| モル質量 | 87.08 g/mol |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
デヒドロアラニン(Dehydroalanine)は、デヒドロアミノ酸の1つである。遊離型では存在せず、天然では微生物のペプチド内の残基として生じる[1]。非飽和の骨格を持つ点で、アミノ酸残基としては特殊である[2]。
構造と反応性
[編集]大部分の第1級エナミンと同様に、デヒドロアラニンは不安定である。ペプチドやその関連化合物のようなN-アシル化誘導体は安定である。例えば、2-アセトアミドアクリル酸メチルはエステルのN-アセチル化誘導体である。ペプチドの残基として、翻訳後修飾により生成する。必要な前駆体はセリンとシステイン残基であり、酵素によってそれぞれ水と硫化水素が脱離して生成される。
大部分のアミノ酸残基は求核的に不活性であるが、デヒドロアラニンまたはその他のデヒドロアミノ酸を含むものは例外である。これらはα,β-不飽和カルボニルのため求電子的であり[2]、そのため例えば他のアミノ酸をアルキル化する。
生成
[編集]デヒドロアラニン残基は、抗菌活性を持つ環状ペプチドであるナイシン中に初めて検出された[2]。また、ランチビオティックやミクロシスチンにも含まれる。
DHAは、システインまたはセリンから、酵素なしの塩基触媒で生成するが、この反応は料理中やアルカリ性食品の加工中に発生する。これがリシン等の他のアミノ酸残基をアルキル化し、リシノアラニン架橋を形成して、元のアラニンをラセミ化させる。結果として生じたタンパク質は、ある種には低栄養、また別の種には高栄養となる。またリシノアラニンは、ラットの腎臓肥大の原因となる[3]。

デヒドロアラニン残基は、長い間、ヒスチジンアンモニアリアーゼとフェニルアラニンアンモニアリアーゼの重要な求電子触媒残基であると考えられてきた。しかし後に、より求電子性の高い別の不飽和アラニン誘導体である3,5-ジヒドロ-5-メチルジエン-4H-イミダゾール-4-オンが真の活性残基であることが明らかとなった[4][5]。
出典
[編集]- ^ Downs, DM; Ernst, DC (April 2015). “From microbiology to cancer biology: the Rid protein family prevents cellular damage caused by endogenously generated reactive nitrogen species.”. Molecular microbiology 96 (2): 211-9. doi:10.1111/mmi.12945. PMC 4974816. PMID 25620221.
- ^ a b c d Siod?ak, Dawid (2015). “α,β-Dehydroamino Acids in Naturally Occurring Peptides”. Amino Acids 47: 1-17. doi:10.1007/s00726-014-1846-4. PMC 4282715.
- ^ Friedman, Mendel (1999). “Lysinoalanine in food and in antimicrobial proteins”. In Jackson, Lauren S.; Knize, Mark G.; Morgan, Jeffrey N.. Impact of Processing on Food Safety. 459. Springer. pp. 145-159. doi:10.1007/978-1-4615-4853-9_10. ISBN 978-1-4615-4853-9. PMID 10335374
- ^ Retey, Janos (2003). “Discovery and role of methylidene imidazolone, a highly electrophilic prosthetic group”. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics 1647 (1-2): 179-184. doi:10.1016/S1570-9639(03)00091-8.
- ^ “Crystal structure of phenylalanine ammonia lyase: multiple helix dipoles implicated in catalysis”. Biochemistry 43 (36): 11403-16. (September 2004). doi:10.1021/bi049053+. PMID 15350127.
