テロメラーゼRNA要素
| TERC | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| 識別子 | |||||||||||||||||||||||||
| 記号 | TERC, DKCA1, PFBMFT2, SCARNA19, TR, TRC3, hTR, Telomerase RNA component, TER | ||||||||||||||||||||||||
| 外部ID | OMIM: 602322 GeneCards: TERC | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| オルソログ | |||||||||||||||||||||||||
| 種 | ヒト | マウス | |||||||||||||||||||||||
| Entrez |
| ||||||||||||||||||||||||
| Ensembl |
| ||||||||||||||||||||||||
| UniProt |
|
| |||||||||||||||||||||||
| RefSeq (mRNA) |
|
| |||||||||||||||||||||||
| RefSeq (タンパク質) |
|
| |||||||||||||||||||||||
| 場所 (UCSC) | Chr 3: 169.76 – 169.77 Mb | n/a | |||||||||||||||||||||||
| PubMed検索 | [2] | n/a | |||||||||||||||||||||||
| ウィキデータ | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Vertebrate telomerase RNA | |
|---|---|
 | |
| 識別 | |
| 略称 | Telomerase-vert |
| Rfam | RF00024 |
| その他のデータ | |
| リボ核酸の種類 | 遺伝子 |
| ドメイン | 真核生物; ウイルス |
| PDB構造 | PDBe |
| Ciliate telomerase RNA | |
|---|---|
 | |
| 識別 | |
| 略称 | Telomerase-cil |
| Rfam | RF00025 |
| その他のデータ | |
| リボ核酸の種類 | 遺伝子 |
| ドメイン | 真核生物 |
| PDB構造 | PDBe |
| Saccharomyces cerevisiae telomerase RNA | |
|---|---|
 | |
| 識別 | |
| 略称 | Sacc_telomerase |
| Rfam | RF01050 |
| その他のデータ | |
| リボ核酸の種類 | 遺伝子 |
| ドメイン | 真核生物 |
| PDB構造 | PDBe |
テロメラーゼRNA要素(テロメラーゼRNAようそ、英: telomerase RNA component、略称: TERC)は真核生物に存在するノンコーディングRNAで、テロメアの伸長に用いられる酵素 テロメラーゼの構成要素である[3][4]。テロメラーゼRNA構成要素、テロメラーゼRNA成分などとも呼ばれる。TERCは、テロメラーゼによるテロメアの複製(逆転写)の際の鋳型として機能する。TERCの配列と構造は脊椎動物、繊毛虫類、酵母の間で大きく異なるが、鋳型配列に近接した5'末端側にシュードノット構造が存在することは共通している。脊椎動物のTERCの3'末端にはH/ACA型snoRNA様ドメインが存在している[5][6][7]。
構造
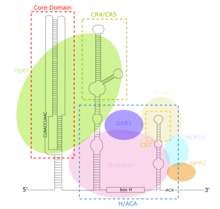
[編集]TERCは長鎖ノンコーディングRNA(lncRNA)の1つであり、その長さは繊毛虫類では約150ヌクレオチド、脊椎動物では400–600ヌクレオチド、酵母では約1300ヌクレオチドである[8]。成熟したヒトTERC(hTR)は451ヌクレオチドである[9]。TERCは広範囲の二次構造を持ち、4つの主要な保存されたドメインからなる[8]。TERCの5'末端に位置する最大のドメインであるコアドメインには、テロメアの鋳型となるCUAAC配列が含まれている。その二次構造は、鋳型配列を含む大きなループ、ループを閉じるP1ヘリックス、P2/P3シュードノットからなる[10]。コアドメインと保存されたCR4/CR5ドメインがTERTと結合し、テロメラーゼのin vitroでの触媒活性にはこれらのドメインのみが必要である[11]。TERCの3'末端には保存されたH/ACAドメインが存在し、一本鎖のヒンジで連結された2つのヘアピン構造と3'末端の一本鎖ACA配列からなる[9]。H/ACAドメインはジスケリン、GAR1、NOP10、NHP2と結合し、H/ACAリボヌクレオタンパク質複合体を形成する[10]。TERCの3'末端には保存されたCR7ドメインも存在し、TCAB1が結合する3ヌクレオチドのCABボックス(カハール体への局在を担う)を含んでいる[10]。
機能
[編集]テロメラーゼはリボヌクレオタンパク質からなるポリメラーゼで、テロメアの末端にTTAGGGのリピート配列を付加することで末端を維持する。リピート配列は、真核生物の種によって差異が存在する。テロメラーゼには逆転写酵素活性を持つタンパク質要素(TERT)と、テロメアリピートの鋳型として機能するRNA要素(TERC)が含まれている。脊椎動物型TERC配列の50位付近に存在するCCCUAA配列が鋳型として機能する。テロメラーゼの発現は細胞老化と関係している。出生後の体細胞では通常抑制されており、テロメアは短縮してゆく。体細胞でのテロメラーゼの発現調節の異常は発がんに関与している可能性がある。マウスでの研究からは、テロメアリピートの新規合成が二本鎖切断部位でも生じている可能性が示されており、テロメラーゼが染色体修復にも関与している可能性が示唆されている[12]。TERCのホモログはトリヘルペスウイルスにも存在する[13]。
TERCのコアドメインは、TERTがTTAGGGからなるテロメアリピートを合成する際のRNA鋳型を含んでいる[10]。他のリボヌクレオタンパク質と異なり、テロメラーゼではタンパク質のTERTが触媒活性を持つ一方、lncRNAであるTERCは構造的な役割を持ち、リボザイムではない[14]。In vitroでテロメラーゼの触媒活性を再構成するには、TERCのコア領域とTERTで十分である[10][11]。TERCのH/ACAドメインはTERCを安定化するジスケリン複合体(DKC1、GAR1、NOP10、NHP2)をリクルートし、テロメラーゼ複合体の形成と全体的な触媒活性を向上させる[10]。CR7ドメインはテロメラーゼをカハール体へ局在させるTCAB1と結合し、テロメラーゼの触媒活性をさらに向上させる[10]。テロメラーゼ活性やTERTの発現がみられない細胞においても、TERCは普遍的に発現している[15]。そのため、TERCのTERT非依存的なさまざまな役割が提唱されている。TERC結合モチーフを含む14の遺伝子はTERCによる直接的な転写調節を受けており、RNA-DNA三重鎖形成によって発現が増加する。TERCによるLIN37、TRPG1L、TYROBP、USP16のアップレギュレーションはNF-κB経路を刺激し、炎症性サイトカインの発現と分泌を増加させる[16]。
生合成
[編集]スプライソソームによってイントロンから組み立てられる大部分のlncRNAとは異なり、ヒトTERC(hTR)は、ゲノム上3q26.2の遺伝子座[17]に位置する専用のプロモーターからRNAポリメラーゼIIによって直接転写される[9]。成熟したhTRは451ヌクレオチドの長さであるが、細胞内の定常状態のhTR転写産物の約1/3にはゲノムにコードされた10ヌクレオチド程度の3'テールが存在する。こうした伸長型hTRの大部分には、さらにオリゴ(A)からなる3'末端の伸長が存在する[9]。3'テールを持つ未成熟型hTRから451ヌクレオチドの成熟型hTRへのプロセシングは、3'-5'エキソリボヌクレアーゼによる直接的な分解、もしくはPAPD5によるオリゴアデニル化、3'-5'エキソリボヌクレアーゼPARNによる3'オリゴ(A)テールの除去、そして3'-5'エキソリボヌクレアーゼによる分解、という間接的な経路によって行われる[9]。伸長型のhTRはエキソソームによっても分解される[9]。
hTR転写産物の5'末端もプロセシングを受ける。TGS1による5'キャップの2,2,7-トリメチルグアノシンへのメチル化は、hTRの成熟を阻害する[18]。hTR転写時のH/ACAドメインへのジスケリン複合体の結合は、転写終結を促進する[9]。こうしたhTRの成熟の活性化または阻害を行うさまざまな競合的経路の相対的速度の制御は、テロメラーゼ活性の全体的な調節の重要な要素となっている。
臨床的意義
[編集]TERCの機能喪失型変異は、さまざまな変性疾患と関係している。TERCの変異は、先天性角化異常症[19]、特発性肺線維症[20]、再生不良性貧血、骨髄異形成症候群と関係している[10]。TERCの過剰発現と不適切な調節は、さまざまながんと関係している。hTRのアップレギュレーションはHPVの感染による前がん状態の患者で広く観察される[21]。TERCの過剰発現はマルディウイルスの発がん性を高める[22]。TERCの過剰発現は胃がんで観察される[23]。TERCの過剰発現は2型糖尿病や多発性硬化症などの炎症性疾患でも観察され、TERCによってNF-κB炎症経路が活性化される[16]。
TERCは骨粗鬆症に対する保護効果が示唆されており、TERCの発現の低下は骨形成を低下させる[24]。TERCはさまざまながんで過剰発現しているため、がんのバイオマーカーとしての利用可能性が研究されている。肺扁平上皮がんにおいては、有効なバイオマーカーであることが示されている[25]。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000277925 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ “The RNA component of human telomerase”. Science 269 (5228): 1236–41. (September 1995). Bibcode: 1995Sci...269.1236F. doi:10.1126/science.7544491. PMID 7544491.
- ^ “Cell cycle-dependent recruitment of telomerase RNA and Cajal bodies to human telomeres”. Molecular Biology of the Cell 17 (2): 944–54. (February 2006). doi:10.1091/mbc.E05-09-0904. PMC 1356602. PMID 16319170.
- ^ “Ciliate telomerase RNA structural features”. Nucleic Acids Research 23 (7): 1091–7. (April 1995). doi:10.1093/nar/23.7.1091. PMC 306816. PMID 7739888.
- ^ “Telomerase RNAs of different ciliates have a common secondary structure and a permuted template”. Genes & Development 8 (16): 1984–98. (August 1994). doi:10.1101/gad.8.16.1984. PMID 7958872.
- ^ “Structure and function of telomerase RNA”. Current Opinion in Structural Biology 16 (3): 307–18. (June 2006). doi:10.1016/j.sbi.2006.05.005. PMID 16713250.
- ^ a b “Telomerase and Telomeres in Endometrial Cancer” (English). Frontiers in Oncology 9: 344. (2019). doi:10.3389/fonc.2019.00344. PMC 6533802. PMID 31157162.
- ^ a b c d e f g “Disruption of Telomerase RNA Maturation Kinetics Precipitates Disease”. Molecular Cell 74 (4): 688–700.e3. (May 2019). doi:10.1016/j.molcel.2019.02.033. PMC 6525023. PMID 30930056.
- ^ a b c d e f g h “Architecture of human telomerase RNA”. Proceedings of the National Academy of Sciences of the United States of America 108 (51): 20325–32. (December 2011). Bibcode: 2011PNAS..10820325Z. doi:10.1073/pnas.1100279108. PMC 3251123. PMID 21844345.
- ^ a b “Telomerase RNA is more than a DNA template”. RNA Biology 13 (8): 683–9. (August 2016). doi:10.1080/15476286.2016.1191725. PMC 4993324. PMID 27245259.
- ^ “Entrez Gene: TERC telomerase RNA component”. 2020年7月4日閲覧。
- ^ “Comparative functional study of the viral telomerase RNA based on natural mutations”. The Journal of Biological Chemistry 280 (25): 23502–15. (June 2005). doi:10.1074/jbc.M501163200. PMID 15811851.
- ^ “Structural Biology of Telomerase”. Cold Spring Harbor Perspectives in Biology 11 (12): a032383. (December 2019). doi:10.1101/cshperspect.a032383. PMC 6886448. PMID 31451513.
- ^ “Telomeres and telomerase: three decades of progress”. Nature Reviews Genetics 20 (5): 299–309. (May 2019). doi:10.1038/s41576-019-0099-1. PMID 30760854.
- ^ a b “TERC promotes cellular inflammatory response independent of telomerase”. Nucleic Acids Research 47 (15): 8084–8095. (September 2019). doi:10.1093/nar/gkz584. PMC 6735767. PMID 31294790.
- ^ “OMIM Entry - * 602322 - TELOMERASE RNA COMPONENT; TERC”. www.omim.org. 2020年3月2日閲覧。
- ^ “Loss of Human TGS1 Hypermethylase Promotes Increased Telomerase RNA and Telomere Elongation”. Cell Reports 30 (5): 1358–1372.e5. (February 2020). doi:10.1016/j.celrep.2020.01.004. PMC 7156301. PMID 32023455.
- ^ Rich, Robert R. (2018-01-13). Clinical immunology : principles and practice (Fifth ed.). [St. Louis, Mo.]. ISBN 978-0-7020-7039-6. OCLC 1023865227
- ^ Swigris, Jeffrey J; Brown, Kevin K (2018-07-25). Idiopathic pulmonary fibrosis. St. Louis. ISBN 978-0-323-54432-0. OCLC 1053744041
- ^ “Human papillomavirus and human telomerase RNA component gene in cervical cancer progression”. Scientific Reports 9 (1): 15926. (November 2019). Bibcode: 2019NatSR...915926L. doi:10.1038/s41598-019-52195-5. PMC 6828729. PMID 31685833.
- ^ “Overexpression of cellular telomerase RNA enhances virus-induced cancer formation”. Oncogene 38 (10): 1778–1786. (March 2019). doi:10.1038/s41388-018-0544-1. PMID 30846849.
- ^ “Demonstration of constant upregulation of the telomerase RNA component in human gastric carcinomas using in situ hybridization”. The Journal of Pathology 185 (2): 139–44. (June 1998). doi:10.1002/(SICI)1096-9896(199806)185:2<139::AID-PATH79>3.0.CO;2-L. PMID 9713339.
- ^ “LncRNA TERC alleviates the progression of osteoporosis by absorbing miRNA-217 to upregulate RUNX2”. European Review for Medical and Pharmacological Sciences 24 (2): 526–534. (January 2020). doi:10.26355/eurrev_202001_20029. PMID 32016954.
- ^ “Telomere-associated genes and telomeric lncRNAs are biomarker candidates in lung squamous cell carcinoma (LUSC)”. Experimental and Molecular Pathology 112: 104354. (February 2020). doi:10.1016/j.yexmp.2019.104354. PMID 31837325.
関連文献
[編集]- “For better or worse? Telomerase inhibition and cancer”. Cell 98 (3): 273–5. (August 1999). doi:10.1016/S0092-8674(00)81955-8. PMID 10458601.
- “Dyskeratosis congenita: molecular insights into telomerase function, ageing and cancer”. Expert Reviews in Molecular Medicine 6 (26): 1–23. (December 2004). doi:10.1017/S1462399404008671. PMID 15613268.
- “Mutations of telomerase complex genes linked to bone marrow failures”. Journal of Nippon Medical School = Nippon Ika Daigaku Zasshi 74 (3): 202–9. (June 2007). doi:10.1272/jnms.74.202. PMID 17625368.
- “Method for determining RNA 3' ends and application to human telomerase RNA”. Nucleic Acids Research 24 (3): 532–3. (February 1996). doi:10.1093/nar/24.3.532. PMC 145649. PMID 8602368.
- “Mapping of the gene for the mouse telomerase RNA component, Terc, to chromosome 3 by fluorescence in situ hybridization and mouse chromosome painting”. Genomics 41 (2): 293–4. (April 1997). doi:10.1006/geno.1997.4621. PMID 9143511.
- “Cloning and characterization of human and mouse telomerase RNA gene promoter sequences”. Oncogene 16 (10): 1345–50. (March 1998). doi:10.1038/sj.onc.1201892. PMID 9546436.
- “A telomerase component is defective in the human disease dyskeratosis congenita”. Nature 402 (6761): 551–5. (December 1999). Bibcode: 1999Natur.402..551M. doi:10.1038/990141. PMID 10591218.
- “Secondary structure of vertebrate telomerase RNA”. Cell 100 (5): 503–14. (March 2000). doi:10.1016/S0092-8674(00)80687-X. PMID 10721988.
- “Telomere dysfunction impairs DNA repair and enhances sensitivity to ionizing radiation”. Nature Genetics 26 (1): 85–8. (September 2000). doi:10.1038/79232. PMID 10973255.
- “Human telomerase activation requires two independent interactions between telomerase RNA and telomerase reverse transcriptase”. Molecular Cell 6 (2): 361–71. (August 2000). doi:10.1016/S1097-2765(00)00036-8. PMID 10983983.
- “SNO is a probable target for gene amplification at 3q26 in squamous-cell carcinomas of the esophagus”. Biochemical and Biophysical Research Communications 286 (3): 559–65. (August 2001). doi:10.1006/bbrc.2001.5428. PMID 11511096.
- “The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita”. Nature 413 (6854): 432–5. (September 2001). Bibcode: 2001Natur.413..432V. doi:10.1038/35096585. PMID 11574891.
- “Allosteric inhibitors of telomerase: oligonucleotide N3'-->P5' phosphoramidates”. Nucleic Acids Research 30 (2): 559–68. (January 2002). doi:10.1093/nar/30.2.559. PMC 99832. PMID 11788719.
- “Effects of cisplatin on telomerase activity and telomere length in BEL-7404 human hepatoma cells”. Cell Research 12 (1): 55–62. (March 2002). doi:10.1038/sj.cr.7290110. PMID 11942411.
- “Nucleolar localization of hTERT protein is associated with telomerase function”. Experimental Cell Research 277 (2): 201–9. (July 2002). doi:10.1006/excr.2002.5541. PMID 12083802.
- “Differential regulation of telomerase activity by six telomerase subunits”. European Journal of Biochemistry 269 (14): 3442–50. (July 2002). doi:10.1046/j.1432-1033.2002.03025.x. PMID 12135483.
- “Minimum length requirement of the alignment domain of human telomerase RNA to sustain catalytic activity in vitro”. Nucleic Acids Research 30 (20): 4470–80. (October 2002). doi:10.1093/nar/gkf575. PMC 137139. PMID 12384594.
- “p53 null mutations are associated with a telomerase negative phenotype in ovarian carcinoma”. Cancer Biology & Therapy 1 (5): 511–7. (2003). doi:10.4161/cbt.1.5.167. PMID 12496479.
- “Analysis of the structure of human telomerase RNA in vivo”. Nucleic Acids Research 30 (4): 912–20. (February 2002). doi:10.1093/nar/30.4.912. PMC 100349. PMID 11842102.


