乳酸ラセマーゼ
乳酸ラセマーゼ(lactate racemase)は、乳酸の2つの立体異性体の間の相互変換を触媒する酵素である。
- (S)-乳酸 (R)-乳酸
-
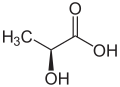
(S)-乳酸・L-乳酸
-
(R)-乳酸・D-乳酸
分布
乳酸菌のうちLactobacillus sakei、Lactobacillus curvatus、Lactobacillus plantarumなど数種で知られている。また乳酸菌以外でもクロストリジウム(嫌気性真正細菌)や特定の好塩古細菌などで活性が示されている[1]。なお乳酸ラセマーゼをコードするlarA遺伝子自体は広範な原核生物から見出されている[2]。
構造と性質
酸化に強い感受性があるため生化学的研究はほとんど行われていない[1]。1968年にL. sakeiの乳酸ラセマーゼを用いた研究があり、分子量およそ25kDaで鉄イオンの関与が示唆されていた[3]。一方2014年になってL. plantarumの乳酸ラセマーゼの遺伝子larAが同定されたが、それによれば分子量はおよそ46kDaで活性にニッケルを要求する[2]。
反応機構
C. beijerinckiiでは、酵素のスルフヒドリル基にα-カルボニル中間体が共有結合する機構で酵素が働くという証拠が得られている[4]。
L. sakeiから精製した乳酸ラセマーゼは乳酸脱水素酵素活性は示さない[3]。またこの酵素は、AMP[要曖昧さ回避]、オキサミン酸、アタブリン、アデノシン一硫酸塩、シアニド、そしていくつかの鉄キレート剤で阻害されることが分かっている。この酵素で触媒される化学反応は、D型とL型の存在量が等モルになった点で平衡に達する[3]。
L. plantarumでは、最初にL-乳酸が生成され、乳酸ラセマーゼの活性を誘導する。乳酸ラセマーゼはL-乳酸の不存在下では発現しない。酵素の活性が誘導されると、D-乳酸が生成されるようになり[1]、最終的にほぼ等量のD-乳酸とL-乳酸が生成し、平衡に達する。この種では、lar活性は、D-乳酸によって抑制され、larオペロン活性はL-乳酸によって正の制御を受ける。つまり、larオペロン活性は、L-乳酸/D-乳酸比によって制御されることになる。
重要性
L. plantarumにおけるピルビン酸の乳酸への代謝には、2つの経路が存在する。その1つはNAD依存性乳酸脱水素酵素によりD-乳酸を生成するもので、もう1つは乳酸ラセマーゼによるものである。乳酸脱水素酵素が不活化または阻害された場合、乳酸ラセマーゼは細菌のD-乳酸生成の救出経路として働く[1]。L. plantarumにおけるD-乳酸生成は、細胞壁の生合成と関係しているため、この働きは重要である。実際に、乳酸脱水素酵素を欠き、L-乳酸のみを生成するlarオペロンを持つ変異体では、ペプチドグリカン生合成が起こらなかった。
出典
- ^ a b c d Goffin Philippe, Deghorain Marie, Mainardi Jean-Luc et al. (2005). “Lactate racemization as a rescue pathway for supplying D-lactate to the cell wall biosynthesis machinery in Lactobacillus plantarum”. J. Bacteriol. 187 (19): 6750-61. doi:10.1128/JB.187.19.6750-6761.2005. PMC 1251571. PMID 16166538.
- ^ a b Desguin et al. (2014). “Lactate racemase is a nickel-dependent enzyme activated by a widespread maturation system”. Nat. Comm. 5: 3615. doi:10.1038/ncomms4615.
- ^ a b c Hiyama T, Fukui S, Kitahara K (1968). “Purification and properties of lactate racemase from Lactobacillus sake”. J. Biochem. 64 (1): 99-107. PMID 5707819.
- ^ Cantwell A, Dennis D (1974). “Lactate racemase. Direct evidence for an alpha-carbonyl intermediate”. Biochemistry 13 (2): 287-91. doi:10.1021/bi00699a009. PMID 4810054.