酸化オスミウム(VIII)
| 酸化オスミウム(VIII) | |
|---|---|

|

|

| |
osmium(VIII) oxide | |
| 識別情報 | |
| CAS登録番号 | 20816-12-0 |
| EC番号 | 244-058-7 |
| 国連/北米番号 | 2471 |
| RTECS番号 | RN1140000 |
| 特性 | |
| 化学式 | OsO4 |
| モル質量 | 254.23 g/mol |
| 外観 | 淡黄色固体 |
| 密度 | 4.9 g/cm3 |
| 融点 |
40.25 °C |
| 沸点 |
130 °C |
| 熱化学 | |
| 標準生成熱 ΔfH |
-394.1 kJ mol-1(s) -337.2 kJ mol-1(g) |
| 標準モルエントロピー S |
143.9 J mol-1K-1(s) 293.8 J mol-1K-1(g) |
| 標準定圧モル比熱, Cp |
74.1 J mol-1K-1(g) |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 0528 |
| EU分類 | 猛毒 (T+) 腐食性 (C) |
| EU Index | 076-001-00-5 |
| NFPA 704 | |
| Rフレーズ | R26/27/28 R34 |
| Sフレーズ | S1/2 S7/9 S26 S45 |
| 関連する物質 | |
| その他の陽イオン | 酸化ルテニウム(VIII) 酸化ハッシウム(VIII) |
| 関連するオスミウムの酸化物 | 酸化オスミウム(IV) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
酸化オスミウム(VIII)(さんかオスミウム はち、英: osmium(VIII) oxide)または四酸化オスミウム(しさんかオスミウム、英: osmium tetroxide)は、化学式が OsO4 と表されるオスミウムの酸化物である。分子量254.2、融点42 °C、沸点129.7 °C。CAS登録番号は [20816-12-0]。
性質[編集]
無色から淡黄色の固体で、オスミウムを加熱すると容易に生じる。沸点より低い温度でも気化・昇華しやすく、特有の刺激臭を持つ。加熱すると分解し、オスミウムと酸素を生じる。 強酸化剤であり、可燃性や還元性の物質と反応する。毒性が強く、吸い込んだり皮膚に触れると危険。特に目の粘膜に対して危険性が高い。しかし、酸化オスミウム(VIII)をポリスチレンやABS樹脂でマイクロカプセル化することで、気化と溶出が無く安全に扱えるオスミウム酸化剤が開発され[1][2]、試薬会社からも発売されている。
水溶液中では僅かに酸性を示すが、これは以下の様にルイス酸としての平衡が存在し、過オスミウム酸イオンを生成するためである。
- ,
水酸化カリウムと反応させると、過オスミウム酸カリウム K2[OsO4(OH)2] を生成する。
化学工業で反応速度を速める触媒としての用途がある。放射性物質と異なり、環境中にまき散らされても、除去はそれほど難しくない。
毒物及び劇物取締法には非該当である。
有機合成における応用[編集]
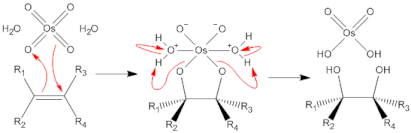
有機合成分野において酸化オスミウム(VIII)は、アルケンを 1,2-ジオールへと変換する重要な酸化剤として用いられる。機構としては炭素-炭素二重結合に対して酸化オスミウム(VIII)がシス付加して6価の環状オスミウム酸エステルを生じ、これが加水分解されてジオールを生ずると考えられている。この反応は入手容易な官能基であるオレフィンから不斉点2つを一挙に導入することができ、ジオールはさらに他の官能基へと変換することも容易であるため、有機合成上重要である。
普通に反応を行うと酸化オスミウム(VIII)はオレフィンに対して等モル量が必要であるが、再酸化剤を反応系に加えてやると6価のオスミウム酸が8価の酸化オスミウム(VIII)に酸化されるので、危険なオスミウム試薬の使用量を触媒量に減らすことができる。再酸化剤としては N-メチルモルホリン-N-オキシド (Upjohn法)、過酸化水素、フェリシアン化カリウムなどが用いられる。
応用[編集]
触媒量の酸化オスミウム(VIII)に加え、過剰量の過ヨウ素酸ナトリウムを加えておくとこれが再酸化剤として働く上、生成したジオールを酸化開裂させてカルボニル化合物2分子が生成する。これはレミュー・ジョンソン酸化 (Lemieux–Johnson oxidation) と呼ばれ、オゾン分解の代替反応になりうる。
また反応系にクロラミンTなどを共存させておくことにより、アミノアルコールを合成することもできる。2等量以上用いれば 1,2-ジアミンへと誘導することも可能である。
オスミウム酸化の際にキニーネの誘導体を共存させておくことにより、キラル(キラリティー)な 1,2-ジオールやアミノアルコールを得る手段がバリー・シャープレスらにより開発されている。
その他の応用[編集]
電子顕微鏡を用いて生物試料やポリマーアロイなどの試料を観察する際に、コントラストを増強するために使用されることがある。これらの手法はオスミウム染色・導電染色と呼ばれる。前項で解説されたように、酸化オスミウム(VIII)は炭素-炭素二重結合に付加する性質がある。試料を酸化オスミウム(VIII)の水溶液あるいは蒸気中に放置し、その後電子顕微鏡で観察すると、試料中の炭素-炭素二重結合のある部分(例えばポリブタジエン)が濃く見え、それ以外の部分(例えばPMMA)はそのままなので、それぞれの物質がどのように分布しているかを容易に判断することができる。また、生物試料など電子顕微鏡で観察する際、前処理としてパラジウムや金・白金などの金属薄膜を蒸着する際に、薄膜の付着性や均一性を狙って酸化オスミウム(VIII)処理を行うことがある。
また電子顕微鏡や電子線を入射する分析装置のためにアモルファスな導電性膜が成膜できるコーティング装置が市販されている。