コバルト酸リチウム
| Lithium cobalt oxide[1] | |
|---|---|

| |
| |
lithium cobalt(III) oxide | |
別称 lithium cobaltite | |
| 識別情報 | |
| CAS登録番号 | 12190-79-3 |
| PubChem | 23670860 |
| 特性 | |
| 化学式 | LiCoO2 |
| モル質量 | 97.87 g mol−1 |
| 危険性 | |
| 主な危険性 | harmful |
| Rフレーズ | R42/43 |
| Sフレーズ | S36 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
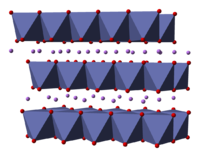
コバルト酸リチウム (コバルトさんリチウム) は二酸化リチウムコバルト (にさんかリチウムコバルト) または酸化リチウムコバルト(III) (さんかリチウムコバルト さん、英: lithium cobalt(III) oxide) の慣用名[注釈 1]であり、組成式 LiCoO2 で表わされる化合物である。 リチウムイオン二次電池の正極として用いられる。LiCoO2 の構造は、リチウム層とコバルトと酸素原子の八面体で構成されるスラブが交互に積層した構造であることが[2]、理論的にも、 X線回折、電子顕微鏡、粉末中性子回折、EXAFSなどの手法を用いて実験的にも知られている[3]。結晶の空間群はヘルマン・モーガン記号で [4] であり、菱面体晶系の単位胞に三回回映軸と鏡映面を持つ。
LiCoO2 を正極に用いる電池は容量が大きい代償として反応性が高く、リチウム・ニッケル・アルミニウム酸化物系などの新型よりも熱的安定性に欠ける。このため、 LiCoO2 電池は高温 (>130 ℃) での使用時や過充電の際に熱暴走の懸念がある。温度が上昇すると、LiCoO2 は分解して酸素を発生し、その酸素が電解質の有機溶媒と反応してしまう。この反応は発熱の大きい反応であり、周囲のセルにまで熱暴走が拡大したり、周囲の可燃物に引火する危険性がある[5]。
この化合物のインターカレーション型電極としての有用性は1980年、オックスフォード大学の水島公一とジョン・グッドイナフらにより発見された[6]。
脚注[編集]
注釈[編集]
- ^ 産業利用上においてリチウムイオン電池材料としてこの名称とともにあまりにも普及し、産業由来の学術研究も多いことから、表記として「コバルト酸リチウム (lithium cobaltate)」を用いることはやむを得ない状況である。英語表記としてlithium cobaltateあるいはlithium cobaltiteと表記される場合も散見される。しかしながら、cobaltateはオキソ酸、cobaltiteは亜オキソ酸となる陰イオンとしての表記 (語尾が-ate, -ite) である。さらに、コバルトの電荷は3+であり「亜コバルト酸」を意味することを意図としたと考えられるcobaltiteは本来、鉱物名 (輝コバルト鉱 (CoAsS)) と名称が重なる。実際にこの物質がオキソ酸としてふるまう場合は、対応する酸としてHCoO2が存在し、水素イオンが解離してCoO2-が存在できることが必要であるが、HCoO2は水素イオンが解離しないオキシ水酸化コバルト (CoOOH) となるため、安定なオキソ酸塩にはならない。つまり、組成的には表記できたとしても陽イオンとしてのLi+と陰イオンとしてのCoO2-からなる塩というよりは、Li+とCo3+の陽イオンを有する酸化物として考える方が妥当であり、IUPAC勧告に基づく命名法によれば「コバルト酸リチウム」は厳密に推奨されるべきではない。
出典[編集]
- ^ 442704 - Lithium cobalt(III) oxide (2012年9月14日). “Sigma-Aldrich product page”. Sigmaaldrich.com. 2013年1月21日閲覧。
- ^ Yang Shao-Horn, Laurence Croguennec, Claude Delmas, E. Chris Nelson and Michael A. O'Keefe (July 2003). “Atomic resolution of lithium ions in LiCoO2”. Nature Materials 2 (7): 464–467. doi:10.1038/nmat922. PMID 12806387.
- ^ I. Nakai, K. Takahashi, Y. Shiraishi, T. Nakagome, F. Izumi, Y. Ishii, F. Nishikawa, T. Konishi (1997). “X-ray absorption fine structure and neutron diffraction analyses of de-intercalation behavior in the LiCoO2 and LiNiO2 systems”. Journal of Power Sources 68 (2): 536–539. doi:10.1016/S0378-7753(97)02598-6.
- ^ H. J. Orman and P. J. Wiseman (January 1984). “Cobalt(III) lithium oxide, CoLiO2: structure refinement by powder neutron diffraction”. Acta Crystallographica Section C 40 (1): 12–14. doi:10.1107/S0108270184002833.
- ^ Doughty, Daniel. “Vehicle Battery Safety Roadmap Guidance”. National Renewable Energy Laboratory. 2013年1月19日閲覧。
- ^ K. Mizushima, P.C. Jones, P.J. Wiseman, J.B. Goodenough (1980). “LixCoO2 (0<x<l): A NEW CATHODE MATERIAL FOR BATTERIES OF HIGH ENERGY DENSITY”. Materials Research Bulletin 15: 783–789. doi:10.1016/0025-5408(80)90012-4.

