「シグナル伝達兼転写活性化因子」の版間の差分
編集の要約なし |
m編集の要約なし |
||
| 1行目: | 1行目: | ||
'''シグナル伝達兼転写活性化因子'''あるいは略して'''STAT'''(すたっと-、{{lang-en-short|Signal Transducers and Activator of Transcription, Signal Transduction and Activator of Transcription, STAT}})は、細胞増殖、[[分化 |
'''シグナル伝達兼転写活性化因子'''(しぐなるでんたつけんてんしゃかっせいかいんし)あるいは略して'''STAT'''(すたっと-、{{lang-en-short|Signal Transducers and Activator of Transcription, Signal Transduction and Activator of Transcription, STAT}})は、細胞増殖、[[細胞分化|分化]]および生存などの過程を制御する[[タンパク質]]であり、その名の通り[[シグナル伝達]]と[[転写 (生物学)|転写]]活性化の双方において働く[[分子]]である。STATは非活性化状態においては[[細胞質]]に存在するがJAK([[ヤーヌスキナーゼ]])が活性化されることによって[[リン酸]]化を受け、[[細胞核|核]]内へ移行して目的[[遺伝子]]を活性化する[[転写因子]]として機能する。この活性化経路は'''[[JAK-STAT経路]]'''と呼ばれており、JAK-STAT経路の制御不全は[[悪性腫瘍]]形成の初期の過程などにしばしば見られ、[[血管新生]]や腫瘍の生存延長、[[免疫]]抑制などを引き起こす。 |
||
== STATファミリー == |
== STATファミリー == |
||
[[ファイル:Stat3 structure.png|250px|thumb|STAT3。]] |
[[ファイル:Stat3 structure.png|250px|thumb|STAT3。]] |
||
[[ファイル:Stat domain structure.png|250px|thumb|STATタンパク質のドメイン構造および翻訳後修飾。]] |
[[ファイル:Stat domain structure.png|250px|thumb|STATタンパク質のドメイン構造および翻訳後修飾。]] |
||
これまでに同定されたSTATファミリーに属する分子として[[STAT1]]、[[STAT2]]、[[STAT3]]、[[STAT4]]、[[STAT5A]]、[[STAT5B]]、[[STAT6]]の7種類が存在している。これらの全ての分子はホモ二量体を形成することができる。また、STAT1/2やSTAT1/3、STAT5A/5Bなどのヘテロ二量体が存在することも知られており、いずれも[[シグナル伝達]]に関与している。STATの構造中にはDNA結合[[タンパク質ドメイン|ドメイン]]やJAKによりリン酸化された受容体との結合部位に当たる[[SH2ドメイン]]を有し、[[カルボキシル基]]末端側には保存されたチロシン残基が存在してSTAT二量体の形成に関与している。 |
これまでに同定されたSTATファミリーに属する分子として[[シグナル伝達兼転写活性化因子1|STAT1]]、[[シグナル伝達兼転写活性化因子2|STAT2]]、[[シグナル伝達兼転写活性化因子3|STAT3]]、[[シグナル伝達兼転写活性化因子4|STAT4]]、[[シグナル伝達兼転写活性化因子5A|STAT5A]]、[[シグナル伝達兼転写活性化因子5B|STAT5B]]、[[シグナル伝達兼転写活性化因子6|STAT6]]の7種類が存在している。これらの全ての分子はホモ二量体を形成することができる。また、STAT1/2やSTAT1/3、STAT5A/5Bなどのヘテロ二量体が存在することも知られており、いずれも[[シグナル伝達]]に関与している。STATの構造中にはDNA結合[[タンパク質ドメイン|ドメイン]]やJAKによりリン酸化された受容体との結合部位に当たる[[SH2ドメイン]]を有し、[[カルボキシル基]]末端側には保存されたチロシン残基が存在してSTAT二量体の形成に関与している。 |
||
サイトカイン受容体とSTATとでは数的に1対1で対応しているわけではなく、複数の[[サイトカイン]]分子が同一のSTATを活性化しうる。例えば[[IL-6]]と[[インターフェロン]]-γは共にSTAT1を活性化するが、[[生理活性]]は異なる。このことはIL-6がSTAT1以外にSTAT3をも活性化しうるためであることから説明がつき、実際にSTAT3を欠いた細胞においてはIL-6はインターフェロン-γと類似した作用を示す<ref>Costa-Pereira |
サイトカイン受容体とSTATとでは数的に1対1で対応しているわけではなく、複数の[[サイトカイン]]分子が同一のSTATを活性化しうる。例えば[[IL-6]]と[[インターフェロン]]-γは共にSTAT1を活性化するが、[[生理活性]]は異なる。このことはIL-6がSTAT1以外にSTAT3をも活性化しうるためであることから説明がつき、実際にSTAT3を欠いた細胞においてはIL-6はインターフェロン-γと類似した作用を示す<ref>{{cite journal |title=Mutational switch of an IL-6 response to an interferon-gamma-like response |author=Ana P Costa-Pereira, Silvia Tininini, Birgit Strobl, Tonino Alonzi, Joerg F Schlaak, Hayaatun Is'harc, Ida Gesualdo, Sally J Newman, Ian M Kerr, Valeria Poli |journal=Proceedings of the National Academy of Sciences of the United States of America |2002-06-11 |volume=99 |issue=12 |pages=8043-7 |doi=10.1073/pnas.122236099 |PMID=12060750 |PMC=123017 }}</ref>。 |
||
H, Gesualdo I, Newman SJ, Kerr IM and Poli V.(2002)"Mutational switch of |
|||
an IL-6 response to an interferon-gamma-like response."''Proc.Natl.Acad.Sci.USA.'' '''99''',8043-7. PMID 12060750</ref>。 |
|||
== 活性化 == |
== 活性化 == |
||
[[ファイル:Jakstat pathway.svg|thumb|right|250px|JAK-STAT経路の活性化。左より(1)細胞膜における受容体タンパク質の会合、(2)受容体のチロシン残基自己リン酸化、(3)STAT分子の結合、(4)STAT二量体の核内移行、転写活性化。]] |
[[ファイル:Jakstat pathway.svg|thumb|right|250px|JAK-STAT経路の活性化。左より(1)細胞膜における受容体タンパク質の会合、(2)受容体のチロシン残基自己リン酸化、(3)STAT分子の結合、(4)STAT二量体の核内移行、転写活性化。]] |
||
[[サイトカイン]]のシグナル伝達はJAK-STAT経路を介して行われる。細胞膜表面に存在する受容体にリガンドが結合すると受容体タンパク質の細胞内ドメインと会合しているJAKが活性化し、受容体の[[チロシン]]リン酸化を行う。このリン酸化を自己リン酸化と呼び、受容体のリン酸化チロシン残基がSTAT分子の[[SH2ドメイン]]との結合部位となる。転写因子であるSTATタンパク質はカルボキシル基側のチロシン残基がリン酸化されると共に、SH2ドメインを介した二量体を形成して活性化する。これによって輸送体タンパク質である[[インポーチン]]を介して[[細胞核|核]]内へ移行した後に[[デオキシリボ核酸|DNA]]上の[[プロモーター]]領域に結合する。例えばインターフェロン-γによって活性化されるSTAT1ホモ二量体はGASモチーフと呼ばれる配列に、IL-2によって活性化されるSTAT5ホモ二量体はMGFボックスにそれぞれ結合する。このような機構を介して活性化したSTATは転写活性化を引き起こし、種々の生物活性の発現につながる。一度チロシンリン酸化を受けて核内へ移行したSTATが[[ホスファターゼ]]による[[脱リン酸化]]を受けると輸送体タンパク質であるCrm1/RanGTPにより[[核外輸送]]を受ける。また、STATの[[セリン]]残基のリン酸化はSTATの活性に影響を与えている。JAK-STAT経路の活性化のレベルは通常5-30分でピークに達し、1-4時間で元のラインにまで戻る<ref name="Ivashkiv LB"> |
[[サイトカイン]]のシグナル伝達はJAK-STAT経路を介して行われる。細胞膜表面に存在する受容体にリガンドが結合すると受容体タンパク質の細胞内ドメインと会合しているJAKが活性化し、受容体の[[チロシン]]リン酸化を行う。このリン酸化を自己リン酸化と呼び、受容体のリン酸化チロシン残基がSTAT分子の[[SH2ドメイン]]との結合部位となる。転写因子であるSTATタンパク質はカルボキシル基側のチロシン残基がリン酸化されると共に、SH2ドメインを介した二量体を形成して活性化する。これによって輸送体タンパク質である[[インポーチン]]を介して[[細胞核|核]]内へ移行した後に[[デオキシリボ核酸|DNA]]上の[[プロモーター]]領域に結合する。例えばインターフェロン-γによって活性化されるSTAT1ホモ二量体はGASモチーフと呼ばれる配列に、IL-2によって活性化されるSTAT5ホモ二量体はMGFボックスにそれぞれ結合する。このような機構を介して活性化したSTATは転写活性化を引き起こし、種々の生物活性の発現につながる。一度チロシンリン酸化を受けて核内へ移行したSTATが[[ホスファターゼ]]による[[脱リン酸化]]を受けると輸送体タンパク質であるCrm1/RanGTPにより[[核外輸送]]を受ける。また、STATの[[セリン]]残基のリン酸化はSTATの活性に影響を与えている。JAK-STAT経路の活性化のレベルは通常5-30分でピークに達し、1-4時間で元のラインにまで戻る<ref name="Ivashkiv LB">{{cite journal |date=2004 |volume=6 |issue=4 |pages=159-68 |doi=10.1186/ar1197 |title=Signaling by STATs |author=Lionel B. Ivashkiv, Xiaoyu Hu |PMID=15225360 |PMC=464899 |journal=Arthritis Research & Therapy }}</ref>。 |
||
== フィードバック == |
== フィードバック == |
||
2021年8月23日 (月) 15:07時点における版
シグナル伝達兼転写活性化因子(しぐなるでんたつけんてんしゃかっせいかいんし)あるいは略してSTAT(すたっと-、英: Signal Transducers and Activator of Transcription, Signal Transduction and Activator of Transcription, STAT)は、細胞増殖、分化および生存などの過程を制御するタンパク質であり、その名の通りシグナル伝達と転写活性化の双方において働く分子である。STATは非活性化状態においては細胞質に存在するがJAK(ヤーヌスキナーゼ)が活性化されることによってリン酸化を受け、核内へ移行して目的遺伝子を活性化する転写因子として機能する。この活性化経路はJAK-STAT経路と呼ばれており、JAK-STAT経路の制御不全は悪性腫瘍形成の初期の過程などにしばしば見られ、血管新生や腫瘍の生存延長、免疫抑制などを引き起こす。
STATファミリー


これまでに同定されたSTATファミリーに属する分子としてSTAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6の7種類が存在している。これらの全ての分子はホモ二量体を形成することができる。また、STAT1/2やSTAT1/3、STAT5A/5Bなどのヘテロ二量体が存在することも知られており、いずれもシグナル伝達に関与している。STATの構造中にはDNA結合ドメインやJAKによりリン酸化された受容体との結合部位に当たるSH2ドメインを有し、カルボキシル基末端側には保存されたチロシン残基が存在してSTAT二量体の形成に関与している。
サイトカイン受容体とSTATとでは数的に1対1で対応しているわけではなく、複数のサイトカイン分子が同一のSTATを活性化しうる。例えばIL-6とインターフェロン-γは共にSTAT1を活性化するが、生理活性は異なる。このことはIL-6がSTAT1以外にSTAT3をも活性化しうるためであることから説明がつき、実際にSTAT3を欠いた細胞においてはIL-6はインターフェロン-γと類似した作用を示す[1]。
活性化
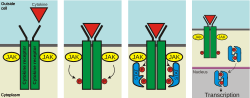
サイトカインのシグナル伝達はJAK-STAT経路を介して行われる。細胞膜表面に存在する受容体にリガンドが結合すると受容体タンパク質の細胞内ドメインと会合しているJAKが活性化し、受容体のチロシンリン酸化を行う。このリン酸化を自己リン酸化と呼び、受容体のリン酸化チロシン残基がSTAT分子のSH2ドメインとの結合部位となる。転写因子であるSTATタンパク質はカルボキシル基側のチロシン残基がリン酸化されると共に、SH2ドメインを介した二量体を形成して活性化する。これによって輸送体タンパク質であるインポーチンを介して核内へ移行した後にDNA上のプロモーター領域に結合する。例えばインターフェロン-γによって活性化されるSTAT1ホモ二量体はGASモチーフと呼ばれる配列に、IL-2によって活性化されるSTAT5ホモ二量体はMGFボックスにそれぞれ結合する。このような機構を介して活性化したSTATは転写活性化を引き起こし、種々の生物活性の発現につながる。一度チロシンリン酸化を受けて核内へ移行したSTATがホスファターゼによる脱リン酸化を受けると輸送体タンパク質であるCrm1/RanGTPにより核外輸送を受ける。また、STATのセリン残基のリン酸化はSTATの活性に影響を与えている。JAK-STAT経路の活性化のレベルは通常5-30分でピークに達し、1-4時間で元のラインにまで戻る[2]。
フィードバック
細胞にはサイトカインのシグナルを正または負に制御するシステムが備わっており、恒常性の維持において重要な役割を果たしている。ポジティブフィードバック機構としてはインターフェロン-γによるSTAT1やISG15(IFN-Stimulated Gene 15)の誘導などが知られている[2]。一方、サイトカインシグナルの抑制経路としてタンパク質分解による受容体発現の減少、チロシンホスファターゼであるSHPによるJAKおよびSTATの脱リン酸化、PIASやSOCSと呼ばれるタンパク質によるSTATの機能阻害が挙げられる。サイトカインの刺激により正と負いずれのフィードバック機構が強く誘導されるかは刺激の強さに依存し、大量のサイトカインによって刺激を受けた際には過剰なシグナルを抑制するために負のフィードバック機構が働く[2]。
出典
- 谷口克、宮坂昌之 編『標準免疫学 第2版』医学書院 2002年 ISBN 4-260-10452-7
- 今堀和友、山川民夫 編集 『生化学辞典 第4版』東京化学同人 2007年 ISBN 978-4-8079-0670-3
- 笹月健彦 監訳『免疫生物学 原書第5版』南江堂 2003年 ISBN 4-524-23522-1
参考文献
- ^ Ana P Costa-Pereira, Silvia Tininini, Birgit Strobl, Tonino Alonzi, Joerg F Schlaak, Hayaatun Is'harc, Ida Gesualdo, Sally J Newman, Ian M Kerr, Valeria Poli. “Mutational switch of an IL-6 response to an interferon-gamma-like response”. Proceedings of the National Academy of Sciences of the United States of America 99 (12): 8043-7. doi:10.1073/pnas.122236099. PMC 123017. PMID 12060750.
- ^ a b c Lionel B. Ivashkiv, Xiaoyu Hu (2004). “Signaling by STATs”. Arthritis Research & Therapy 6 (4): 159-68. doi:10.1186/ar1197. PMC 464899. PMID 15225360.
