「ヒュッケル則」の版間の差分
m ロボットによる 追加: fa:قاعده هوکل |
en:Hückel's rule15:02, 3 December 2010(UTC)を抄訳および加筆 |
||
| 1行目: | 1行目: | ||
'''ヒュッケル則'''(Hückel's rule)は、[[平面]]環状分子についてその[[芳香族性]]を推定する規則で、[[π電子]]の数が 4''n'' + 2 (''n'' は0を含めた正の整数)であれば芳香族性を有するというものである<ref>[http://goldbook.iupac.org/H02867.html IUPAC Gold Book - Hückel (4n + 2) rule]</ref>。[[1931年]]にドイツ人[[物理化学]]者の[[エーリヒ・ヒュッケル]]によって[[量子力学]]を基に考案された<ref>{{citation | last = Hückel | first = Erich | authorlink = エーリヒ・ヒュッケル| title = Quantentheoretische Beiträge zum Benzolproblem I. Die Elektronenkonfiguration des Benzols und verwandter Verbindungen | journal = Z. Phys. | year = 1931 | volume = 70 | issue = 3/4 | pages = 204–86 | doi = 10.1007/BF01339530}}. {{citation | last = Hückel | first = Erich | authorlink = エーリヒ・ヒュッケル | title = Quanstentheoretische Beiträge zum Benzolproblem II. Quantentheorie der induzierten Polaritäten | journal = Z. Phys. | year = 1931 | volume = 72 | issue = 5/6 | pages = 310–37 | doi = 10.1007/BF01341953}}. {{citation | last = Hückel | first = Erich | authorlink = エーリヒ・ヒュッケル | title = Quantentheoretische Beiträge zum Problem der aromatischen und ungesättigten Verbindungen. III | journal = Z. Phys. | year = 1932 | volume = 76 | issue = 9/10 | pages = 628–48 | doi = 10.1007/BF01341936}}</ref><ref>{{citation | last = Hückel | first = E. | authorlink = エーリヒ・ヒュッケル | title = Grundzüge der Theorie ungesättiger und aromatischer Verbindungen | publisher = Verlag Chem | location = Berlin | year = 1938 | pages = 77–85}}</ref>。簡潔に 4''n'' + 2 ルールと表現したのはフォン・デーリング(1951)であるが<ref>{{citation | last = Doering | first = W. v. E. | series = Abstracts of the American Chemical Society Meeting, New York | date = September 1951 | page = 24M}}</ref>、数名の著者が同時期にこの式を使用している<ref>See Roberts et al. (1952) and refs. therein.</ref>。ヒュッケル則を明確に満たすのは ''n'' = 0 からせいぜい ''n'' = 6 までである<ref>{{March3rd}}</ref>。 |
|||
'''ヒュッケル則'''(Hückel's rule)は、[[芳香族炭化水素]]の安定性について[[エーリヒ・ヒュッケル]]が[[1931年]]に発見した規則で、[[π電子]]の数が (4n+2) を満たすときに芳香環が安定するというもの<ref>[http://goldbook.iupac.org/H02867.html IUPAC Gold Book - Hückel (4n + 2) rule]</ref>。 |
|||
== 環状炭化水素 == |
|||
従って、環状炭化水素でヒュッケル則に従えば[[芳香族]]としての性質をもつと言い換えてもよい。[[ベンゼン]]や[[ナフタレン]]、[[アヌレン]]のうち炭素数が4で割り切れないもの(6,10,14個...―ただし、[[角度ひずみ]]のため、安定できるのは6個(ベンゼン)以外では18個([[シクロオクタデカノナエン|[18]アヌレン]])くらいである)はこの規則を満たしている。 |
|||
環状炭化水素では、ヒュッケル則に従えば[[芳香族]]としての性質をもつと言い換えてもよい。[[ベンゼン]](''n'' = 1)や[[ナフタレン]](''n'' = 2)、[[アズレン]](''n'' = 2)、[[アントラセン]](''n'' = 3)、はヒュッケル則を満たす。 |
|||
=== アヌレン === |
|||
[[アヌレン]]では炭素数が4で割り切れない[[シクロデカヘプタエン]](C = 10)、[[シクロテトラデカヘプタエン]](C = 14)、[[シクロオクタデカノナエン]](C = 18)がこの規則を満たす。しかし、立体的な制約(sp<sup>2</sup>炭素の結合角が120°を取れない)のため芳香族性を帯び安定化できるのは炭素数18のシクロオクタデカノナエンだけである。炭素数が4の倍数のときは、[[共鳴安定化]]できないため不安定になる(反芳香族性)。例としては、[[シクロブタジエン]]([4]アヌレン)、[[シクロオクタテトラエン]]([8]アヌレン)などがあり、これらは平面構造ではなく曲がった構造をしている。[[メビウスの帯]]のようにひねりが加えられた分子では、π電子が 4n 個のときに安定化するが、この現象を[[メビウス芳香族性]]という。 |
|||
=== カチオンとアニオン === |
|||
通常の分子ではヒュッケル則を満たさなくても電子が抜けたり([[カチオン]])、逆に加えられたり([[アニオン]])することによってヒュッケル則を満たすものもあり、こうして発生したカチオンやアニオンなどの[[イオン]]は通常のイオンよりも安定である。この例としては[[シクロペン |
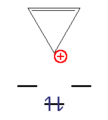
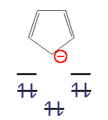
通常の分子ではヒュッケル則を満たさなくても電子が抜けたり([[カチオン]])、逆に加えられたり([[アニオン]])することによってヒュッケル則を満たすものもあり、こうして発生したカチオンやアニオンなどの[[イオン]]は通常のイオンよりも安定である。この例としては[[シクロプロペニルカチオン]](''n'' = 0)や[[シクロペンタジエニルアニオン]](''n'' = 1)、[[シクロヘプタトリエニルカチオン]](''n'' = 1)が挙げられる。 |
||
<gallery> |
|||
| ⚫ | |||
File:Cyclopropene (1plus) with MO diagram.png|シクロプロペニルカチオン |
|||
File:Cyclopentadiene (1minus) with MO diagram.png|シクロペンタジエニルアニオン |
|||
File:Cycloheptatriene (1plus) with MO diagram.png|シクロヘプタトリエニルカチオン |
|||
</gallery> |
|||
== 複素環式化合物 == |
|||
| ⚫ | |||
== 脚注 == |
== 脚注 == |
||
<references /> |
<references /> |
||
{{デフォルトソート:ひゆつけるそく}} |
|||
[[Category: |
[[Category:有機化学]] |
||
[[Category:立体化学]] |
|||
[[Category:芳香族化合物]] |
|||
[[ar:قاعدة هوكل]] |
[[ar:قاعدة هوكل]] |
||
2011年1月13日 (木) 22:56時点における版
ヒュッケル則(Hückel's rule)は、平面環状分子についてその芳香族性を推定する規則で、π電子の数が 4n + 2 (n は0を含めた正の整数)であれば芳香族性を有するというものである[1]。1931年にドイツ人物理化学者のエーリヒ・ヒュッケルによって量子力学を基に考案された[2][3]。簡潔に 4n + 2 ルールと表現したのはフォン・デーリング(1951)であるが[4]、数名の著者が同時期にこの式を使用している[5]。ヒュッケル則を明確に満たすのは n = 0 からせいぜい n = 6 までである[6]。
環状炭化水素
環状炭化水素では、ヒュッケル則に従えば芳香族としての性質をもつと言い換えてもよい。ベンゼン(n = 1)やナフタレン(n = 2)、アズレン(n = 2)、アントラセン(n = 3)、はヒュッケル則を満たす。
アヌレン
アヌレンでは炭素数が4で割り切れないシクロデカヘプタエン(C = 10)、シクロテトラデカヘプタエン(C = 14)、シクロオクタデカノナエン(C = 18)がこの規則を満たす。しかし、立体的な制約(sp2炭素の結合角が120°を取れない)のため芳香族性を帯び安定化できるのは炭素数18のシクロオクタデカノナエンだけである。炭素数が4の倍数のときは、共鳴安定化できないため不安定になる(反芳香族性)。例としては、シクロブタジエン([4]アヌレン)、シクロオクタテトラエン([8]アヌレン)などがあり、これらは平面構造ではなく曲がった構造をしている。メビウスの帯のようにひねりが加えられた分子では、π電子が 4n 個のときに安定化するが、この現象をメビウス芳香族性という。
カチオンとアニオン
通常の分子ではヒュッケル則を満たさなくても電子が抜けたり(カチオン)、逆に加えられたり(アニオン)することによってヒュッケル則を満たすものもあり、こうして発生したカチオンやアニオンなどのイオンは通常のイオンよりも安定である。この例としてはシクロプロペニルカチオン(n = 0)やシクロペンタジエニルアニオン(n = 1)、シクロヘプタトリエニルカチオン(n = 1)が挙げられる。
-
シクロプロペニルカチオン
-
シクロペンタジエニルアニオン
-
シクロヘプタトリエニルカチオン
複素環式化合物
環の中に炭素の代わりに窒素や酸素・硫黄などのヘテロ元素が置換したものもヒュッケル則を満たせば芳香族性を示し、複素環式芳香族化合物、ヘテロ芳香族化合物などと呼ばれる。低分子量で代表的な例としてはピロール、ピリジン、フラン、チオフェンなど、高分子量なものではポルフィリンや道路標識の青色に使われているフタロシアニンなどが挙げられ、いずれも平面化合物である。
脚注
- ^ IUPAC Gold Book - Hückel (4n + 2) rule
- ^ Hückel, Erich (1931), “Quantentheoretische Beiträge zum Benzolproblem I. Die Elektronenkonfiguration des Benzols und verwandter Verbindungen”, Z. Phys. 70 (3/4): 204–86, doi:10.1007/BF01339530. Hückel, Erich (1931), “Quanstentheoretische Beiträge zum Benzolproblem II. Quantentheorie der induzierten Polaritäten”, Z. Phys. 72 (5/6): 310–37, doi:10.1007/BF01341953. Hückel, Erich (1932), “Quantentheoretische Beiträge zum Problem der aromatischen und ungesättigten Verbindungen. III”, Z. Phys. 76 (9/10): 628–48, doi:10.1007/BF01341936
- ^ Hückel, E. (1938), Grundzüge der Theorie ungesättiger und aromatischer Verbindungen, Berlin: Verlag Chem, pp. 77–85
- ^ Doering, W. v. E. (September 1951), Abstracts of the American Chemical Society Meeting, New York, p. 24M
- ^ See Roberts et al. (1952) and refs. therein.
- ^ March, Jerry (1985). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (英語) (3rd ed.). New York: Wiley. ISBN 0-471-85472-7。