臭化金(III)
| 臭化金(III) | |
|---|---|

| |
| |
臭化金(III) | |
別称 三臭化金 | |
| 識別情報 | |
| CAS登録番号 | 11092-53-8 10294-28-7, 11092-53-8 |
| 特性 | |
| 化学式 | AuBr3 |
| モル質量 | 436.69 g/mol |
| 外観 | 暗赤色の結晶固体 |
| 融点 |
97.5 ℃ |
| 危険性 | |
| NFPA 704 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
臭化金(III)(しゅうかきん さん、gold(III) bromide)は、化学式が AuBr3 と表される暗赤色の結晶性固体である[1][2][3]。臭素原子が金原子に架橋して、化学式が Au2Br6 の二量体として存在する[2][3][4]。これも一般に臭化金(III)、三臭化金、しばしば六臭化二金とも呼ばれる。同族の銅や銀の安定な化合物が一価や二価を多くとるのに対して、この化合物や他のハロゲン化金と同じように、金が三価を多くとる[5]のは興味深い事実である。
歴史
[編集]ハロゲン化金についての最初の研究が行われたのは、1800年代の前半と言われる。この時代には、この分野を広く研究していた Thomsen、Schottländer、Krüss という3人の研究者がいた[6][7][8][9]。
構造
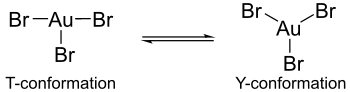
[編集]この二量体には、塩化金(III)のような他のハロゲン化金(III)と同じような性質がある。各 X-Au-X 角はおよそ90度で、平面四角形構造である。量子化学計算上ハロゲン化金(III)の単量体(仮定種)ではヤーン・テラー効果によって、それぞれのハロゲン化金(III)の構造に違いが起こると示されている。各結合長は AuBr3 の場合は長い結合が1本と短い結合が2本あるのに対し、AuCl3 や AuF3 においては長い結合が2本と短い結合が1本となっている[4]。しかし、AuBr3 は AuCl3 や AuF3 とは異なり、T字形構造を取ることがある。AuBr3 は平面三角形構造とT字型構造とで動的平衡状態になっていることが分かっている。この違いはヤーン・テラー効果によるものと思われるが、臭素からの金への π 逆供与結合の重なりが塩素やフッ素の場合より弱くなっているからと見ることもできる。同様に、AuCl3 や AuF3 より AuBr3 が不安定なことも π 逆供与結合の重なりが弱くなるためと説明できる。
合成
[編集]臭化金(III)の一般的な合成法は、金と過剰な液体臭素を 130℃[1] に加熱することである。
- (140℃)
また、塩化金(III)と臭化水素酸とのハロゲン交換反応も成功している。
この反応は、臭化水素酸と比べて安定な塩酸が生成することによって進行する[10]。
化学的性質
[編集]中性の単量体 AuBr3 は、他のハロゲン化金(III)の単量体と同じく配位数3が不安定[5][11]なため、気相においても存在できない。主に金(III)の化合物は平面四角形構造の配位数4が安定[3]なため、水溶液中では4つ目の配位子に配位され、錯体を作る[5][11]傾向がある。そのため配位数4を取ることができる AuBr3 の一水和物 AuBr3•H2O は安定に存在でき、市販もされている。また、配位子がない場合はハロゲンに架橋された二量体として存在する。[5]
さらに AuCl3 のように AuBr3 はルイス酸であり、いくつかの錯体を作ることができる[11]。例えば、臭化水素酸を作用させると臭化金酸 HAuBr4 が生成する[3]。
有機合成への応用
[編集]AuBr3 は触媒として様々な用途に利用されるが、最も興味深い用途はディールス・アルダー反応である。六員環を持つ環式有機化合物を合成するための enynal unit とカルボニル化合物の反応を促進する[12]。
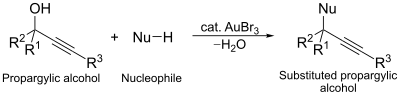
他の触媒作用にはプロパルギルアルコールの求核置換反応が挙げられる。この反応では、AuBr3 はプロパルギルアルコールの活性化剤として作用する[13]。
脚注
[編集]- ^ a b Macintyre, J. E. (ed.) Dictionary of Inorganic Compounds; Chapman & Hall: London, 1992; vol. 1, pp. 121
- ^ a b Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford,1997; pp. 1183-1185
- ^ a b c d e Cotton, F.A.; Wilkinson, G.; Murillo, C.A.; Bochmann, M. Advanced Inorganic Chemistry; John Wiley & Sons: New York, 1999; pp. 1101-1102
- ^ a b Schulz, A.; Hargittai, M. Chem. Eur. J. 2001, vol. 7, pp. 3657-3670
- ^ a b c d Schwerdtfeger, P. J. Am. Chem. Soc. 1989, vol. 111, pp. 7261-7262
- ^ Lengefield, F. American Chemical Journal 1901, vol. 26, pp. 324
- ^ Thomsen, J. J. prakt. Chem. 1876, vol. 13, pp. 337
- ^ Schottlander, Ann. Chem. (Liebig), vol. 217, pp. 312
- ^ Kruss, G. Ber. d. chem. Ges. 1887, vol. 20, pp. 2634
- ^ Dell'Amico, D.B.; Calderazzo, F.; Morvillo, A.; Pelizzi, G; Robino, P. J. Chem. Soc. Dalton Trans. 1991, pp. 3009-3016
- ^ a b c Schwerdtfeger, P.; Boyd, P.D.W.; Brienne, S.; Burrell, K. Inorg. Chem. 1992, vol. 31, pp. 3411-3422
- ^ Asao, N.; Aikawa, H.; Yamamoto, Y. J. Am. Chem. Soc. 2004, vol. 126, pp. 7458-7459
- ^ Georgy, M.; Boucard, V.; Campagne, J. J. Am. Chem. Soc. 2005, vol. 127, pp. 14180-14181