スワーン酸化
スワーン酸化(スワーンさんか、Swern oxidation)はジメチルスルホキシドを酸化剤とするアルコールの酸化反応のことである。 中でも特に塩化オキサリルを活性化剤として使用する方法を指す。
ジメチルスルホキシドはアリル位またはベンジル位のアルコールを還流条件下で酸化してカルボニル化合物へと変換する。 この反応はアルコールがジメチルスルホキシドの硫黄原子に求核付加反応してアルコキシスルホニウム塩を生成した後、ジメチルスルフィドが脱離することでカルボニル化合物となる機構で進行する。 ジメチルスルホキシドの硫黄原子はそれほど反応に活性ではないため、最初の段階の求核付加反応は極めて進行しにくい。 しかしジメチルスルホキシドをより活性なスルホニウム塩へと変換するような活性化剤を添加することで、より温和な条件でこの反応を進行させることができるようになる。 用いる活性化剤によっていくつかのバリエーションが存在する。
環境汚染の原因となりやすい重金属を使用しない酸化反応のため比較的グリーンサスティナブルな酸化反応であるとされている。 しかし、腐ったキャベツのような強い臭気を持つジメチルスルフィドが副生し悪臭公害の原因となりかねないため反応物の処理には細心の注意が必要である。 この点を改善するためにジメチルスルホキシドの代用としてドデシルメチルスルホキシドを使用する方法が発表されている。
また、下の反応式にもある通り、この反応では一酸化炭素・二酸化炭素が副生成物として発生する。このため反応は必ずドラフト内で行い、吸入しないよう気を配る必要がある。
塩化オキサリルを活性化剤とする方法
[編集]1978年にD. Swernらによって発表された方法であり、ジメチルスルホキシドを酸化剤とする反応の中でも標準的な方法となっている。 通常、スワーン酸化といえばこの方法を指す。 ジメチルスルホキシド1をまず塩化オキサリル2と反応させて塩化クロロジメチルスルホニウム4を発生させる。
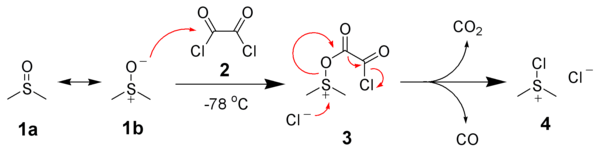
次にアルコール5を添加すると塩化クロロジメチルスルホニウム4と反応してアルコキシスルホニウム塩6が生成する。 最後にトリエチルアミンなどの塩基を加えるとカルボニル化合物8とジメチルスルフィドが生成する。

塩化クロロジメチルスルホニウム4は−20 ℃程度になると急速に分解するため、この反応は通常ジクロロメタンを溶媒として−60 ℃程度で行う。 −60 ℃でジクロロメタンに溶解しない物質については過剰量のジメチルスルホキシドと塩化オキサリルを使用して−10 ℃程度で反応させる。
トリフルオロ酢酸無水物を活性化剤とする方法
[編集]1974年にD. Swernらによって発表された方法で、こちらがスワーン酸化の大元の方法になる。 ジメチルスルホキシドが無水トリフルオロ酢酸によりトリフルオロアセチル化され、トリフルオロアセチルジメチルスルホニウム塩となった後、アルコールと反応してアルコキシスルホニウム塩となる。
この方法においてはアルコキシスルホニウム塩の安定性に基質によって差があるため反応温度のコントロールが重要となる。 アリルアルコール、ベンジルアルコールにおいてはアルコキシスルホニウム塩が不安定であり、−30 ℃以上ではプメラー転位を起こしてメチルチオメチルエーテルに変化してしまう。そのため、カルボニル基を得るためには−60 ℃のまま最後まで反応させる必要がある。
一方、その他のアルコールではアルコキシスルホニウム塩は一旦形成されてしまえば室温でもかなり安定であるので、−60 ℃でアルコキシスルホニウム塩の形成を行なった後、室温まで昇温してから塩基を加える方が収率が向上する。 プメラー転位は立体的に空いているアルコールの方が起こりやすいため、この方法は立体的にかさ高いアルコールの酸化に適している。

その他の活性化剤
[編集]- 無水酢酸: 1965年にJ. D. AlbrightとL. Goldmanによって報告された方法である。この方法でのジメチルスルホキシドの活性化は室温程度の熱が必要であり、この条件ではプメラー転位が起こりやすいため適用できるアルコールは限定される。
- N,N'-ジシクロヘキシルカルボジイミド (DCC): 1965年にK. E. PfitznerとJ. G. Moffatによって報告された方法である。この方法ではリン酸などの弱酸が触媒として必要で、室温程度で活性化する。無水トリフルオロ酢酸の系とは逆に1級アルコールの酸化に適する。難溶性のジシクロヘキシル尿素が副生し、分離がやっかいになることがある。
- 三酸化硫黄-ピリジン錯体: 1967年にJ. R. ParikhとW. von E. Doeringによって報告された方法。
- 五酸化二リン: 1965年にK. Onoderaらにより報告された方法。
- カルボン酸クロリド: 1978年にK.OmuraとD. Swernによって報告された方法。
- 塩素: 1973年にE. J. コーリーとC. U. Kimによって報告された方法。
ジメチルスルフィドを使用する類似の反応
[編集]ジメチルスルフィドを酸化的に活性化してスルホニウム塩を調製し、アルコールの酸化に使用する方法が知られており、キム-コーリー (Kim-Corey) 法と呼ばれている。 1972年にイライアス・コーリーとC. U. Kimによって報告された。 活性化剤としてはN-クロロスクシンイミド (NCS) や塩素を使用する。 通常活性化は0 ℃で行い、アルコールとの反応は−25 ℃程度で行なう。 塩素は炭素-炭素二重結合に付加してしまうので基質が制限されるが、NCSに比べると工業的に適している。
