C2ドメイン
| C2 domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
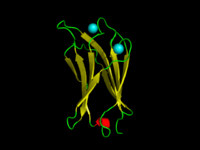 C. absonum α毒素のC2ドメイン(1OLP)。βストランドは黄色、αヘリックスは赤、ループは緑、配位したカルシウムイオンはシアンで示されている。 | |||||||||
| 識別子 | |||||||||
| 略号 | C2 | ||||||||
| Pfam | PF00168 | ||||||||
| InterPro | IPR000008 | ||||||||
| SMART | C2 | ||||||||
| PROSITE | PDOC00380 | ||||||||
| SCOP | 1qas | ||||||||
| SUPERFAMILY | 1qas | ||||||||
| OPM superfamily | 45 | ||||||||
| OPM protein | 1ugk | ||||||||
| CDD | cd00030 | ||||||||
| |||||||||
| Phosphoinositide 3-kinase C2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
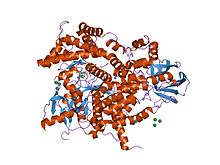 PI3キナーゼの構造[1] | |||||||||||
| 識別子 | |||||||||||
| 略号 | PI3K_C2 | ||||||||||
| Pfam | PF00792 | ||||||||||
| InterPro | IPR002420 | ||||||||||
| SMART | PI3K_C2 | ||||||||||
| PROSITE | PDOC50004 | ||||||||||
| SCOP | 1e8x | ||||||||||
| SUPERFAMILY | 1e8x | ||||||||||
| CDD | cd08380 | ||||||||||
| |||||||||||
C2ドメイン(英: C2 domain)は、タンパク質の細胞膜への標的化に関与するタンパク質ドメインである。典型的なタイプ(PKC-C2)は8つのβストランドから構成されるβサンドイッチ構造をしており、2つまたは3つのカルシウムイオンを配位する。カルシウムイオンは膜結合側に位置する、ドメインの最初と最後のループによって形成されるくぼみに結合する。一方、他のC2ドメインファミリーの多くはカルシウムイオン結合活性を持っていない[2][3]。
他のドメインとの共役
C2ドメインはしばしば酵素活性を有するドメインと共役しているのが見つかる。例えば、PTENのC2ドメインはホスファターゼドメインを細胞膜に接触させ、そこで基質であるホスファチジルイノシトール-3,4,5-トリスリン酸(PIP3)の脱リン酸化を行う。これによって、膜からPIP3を取り出すというエネルギー的に非常にコストの高い過程が不要になる。PTENはプロテインチロシンホスファターゼドメインとC2ドメインという2つのドメインから構成される。このドメインのペアはスーパードメインを構成し、遺伝的ユニットとして菌類、植物、動物のさまざまなタンパク質に見つかる[4]。加えて、ホスホイノシチドのイノシトール環の3-ヒドロキシル基をリン酸化する酵素PI3キナーゼもまた、膜に結合するためにC2ドメインを利用する(1e8w)。
進化
現在のところ、C2ドメインは真核生物のほかには、原核生物のウェルシュ菌 Clostridium perfringens でα毒素の一部として知られているだけである[5]。C2ドメインは17以上の異なる系統が同定されている[2][3]。C2ファミリーのほとんどは基本的な真核生物種まで遡ることができ、真核生物の共通祖先(LECA)以前に多様化したことが示唆される。保存されたカルシウム結合残基を有するのはPKC-C2ドメインファミリーのみであり、典型的なカルシウム依存的膜相互作用はPKC-C2ドメインに限定された特徴であることが示唆される[2]。
カルシウムと脂質の選択性
C2ドメインは、細胞膜の主要な構成要素であるホスファチジルセリンとホスファチジルコリンを含む、広い脂質選択性を示すという点で、膜標的化ドメインの中で独特である。プロテインキナーゼCのC2ドメインは約116アミノ酸残基からなり、2コピーのC1ドメイン(ホルボールエステルとジアシルグリセロールに結合、PDOC00379を参照)とプロテインキナーゼ触媒ドメイン(PDOC00100を参照)の間に位置する。C2ドメインと相同性を示す領域は多くのタンパク質に見つかる[6]。C2ドメインはカルシウム依存的なリン脂質結合と[7]、細胞内局在化などの膜標的化過程に関与していると考えられている。C2ドメインの大部分は膜(リン脂質)に対しCa2+依存的に相互作用するが、一部はCa2+への結合がなくても膜と相互作用することができる。同様に、C2ドメインは異なる脂質特異性を有するように進化している。シナプトタグミンのC2Aドメインなど、多くのC2ドメインは陰イオンリン脂質(ホスファチジルセリンやPIP2を含むリン脂質)に結合する。一方、他のcPLA2αののC2ドメインなど、他のC2ドメインは双性イオン脂質(ホスファチジルコリンなど)に結合する。このCa2+と脂質結合の多様性と選択性は、C2ドメインがさまざまな機能へ進化していることを示唆している[8]。
三次元構造
C2ドメインの三次元構造が報告されており[9]、ドメインは8つのストランドからなるβサンドイッチ構造を形成する。βサンドイッチは保存された4ストランドモチーフからなり、それらはC2 keyと呼ばれる[9]。カルシウムは、C2 keyモチーフのN末端とC末端のループによって形成されるお椀型のくぼみに結合する。
出典
- ^ “Structural determinants of phosphoinositide 3-kinase inhibition by wortmannin, LY294002, quercetin, myricetin, and staurosporine”. Molecular Cell 6 (4): 909–19. (October 2000). doi:10.1016/S1097-2765(05)00089-4. PMID 11090628.
- ^ a b c “Identification of novel families and classification of the C2 domain superfamily elucidate the origin and evolution of membrane targeting activities in eukaryotes”. Gene 469 (1–2): 18–30. (December 2010). doi:10.1016/j.gene.2010.08.006. PMC 2965036. PMID 20713135.
- ^ a b “Novel transglutaminase-like peptidase and C2 domains elucidate the structure, biogenesis and evolution of the ciliary compartment”. Cell Cycle 11 (20): 3861–75. (October 2012). doi:10.4161/cc.22068. PMC 3495828. PMID 22983010.
- ^ “Superdomains in the protein structure hierarchy: The case of PTP-C2”. Protein Science 24 (5): 874–82. (May 2015). doi:10.1002/pro.2664. PMC 4420535. PMID 25694109.
- ^ Naylor, Claire E.; Eaton, Julian T.; Howells, Angela; Justin, Neil; Moss, David S.; Titball, Richard W.; Basak, Ajit K. (August 1998). “Structure of the key toxin in gas gangrene”. Nature Structural & Molecular Biology 5 (8): 738–746. doi:10.1038/1447. ISSN 1545-9993.
- ^ “Mammalian homologues of Caenorhabditis elegans unc-13 gene define novel family of C2-domain proteins”. The Journal of Biological Chemistry 270 (42): 25273–80. (October 1995). doi:10.1074/jbc.270.42.25273. PMID 7559667.
- ^ “A single C2 domain from synaptotagmin I is sufficient for high affinity Ca2+/phospholipid binding”. The Journal of Biological Chemistry 268 (35): 26386–90. (December 1993). PMID 8253763.
- ^ “C2 domains from different Ca2+ signaling pathways display functional and mechanistic diversity”. Biochemistry 40 (10): 3089–100. (March 2001). doi:10.1021/bi001968a. PMC 3862187. PMID 11258923.
- ^ a b “Structure of the first C2 domain of synaptotagmin I: a novel Ca2+/phospholipid-binding fold”. Cell 80 (6): 929–38. (March 1995). doi:10.1016/0092-8674(95)90296-1. PMID 7697723.
外部リンク
- UMich Orientation of Proteins in Membranes families/superfamily-47 - 膜でのC2ドメインの結合の向き
