トポロジカルドメイン

トポロジカルドメイン(英: topological domain, topologically associating domain、略称: TAD)はゲノム内の自己相互作用領域であり、すなわち各TAD内のDNA配列は外部の配列よりも高頻度で内部の配列と物理的相互作用を行う[1]。マウス細胞におけるTADのサイズの中央値は880 kbであり、哺乳類以外の細胞でも同程度の大きさである[2]。哺乳類では、TAD間の境界は細胞種、さらには生物種を越えて保存されており[2]、CTCFやコヒーシンに非常に富む領域となっている[1]。さらに、一部の種類の遺伝子(tRNA遺伝子やハウスキーピング遺伝子)はTAD境界の近傍により高頻度で存在している[3][4]。
TADの機能は十分には理解されておらず、いまだ議論が行われている。大部分の研究では、TADはエンハンサー-プロモーター間相互作用を各TAD内に限定することで遺伝子発現を調節していることが示されているが[5]、一方でTADの構成を変化させても大部分の遺伝子の発現には変化がみられないことも報告されている[6]。TAD境界の破壊はがんのほか[7][8][9]、多合指症、Cooks症候群、F症候群(先端・胸・椎体異形成症、F-form of acro-pectoro-vertebral dysplasia)といった四肢の奇形、脳梁形成不全や成人発症脱髄性白質脳症といった脳疾患など、広範囲の疾患と関係していることが知られている[10]。
TAD形成の根底にある機構もまた複雑であり、十分には解明されていない。しかしながら、いくつかのタンパク質複合体やDNAエレメントがTAD境界と関係していることが知られている。CTCFやコヒーシンタンパク質の助けのもとで行われるTAD形成のモデルとして、"handcuff"モデルや"loop extrusion"モデルが提唱されている[11]。さらに、TAD境界部位の剛性がドメイン間のinsulationやTAD形成を引き起こしている可能性も提唱されている[11]。
発見と多様性[編集]
TADは、優先的に相互接触を行うDNA領域として定義される。TADは2012年に、Hi-Cなどの染色体立体配座捕捉法(3C法)を用いて発見された[3][4][12]。TADは、ショウジョウバエ[13]、マウス[3]、植物、菌類、ヒト[4]のゲノムなど複数の種で存在が示されている[14]。細菌では、chromosomal interacting domain(CID)と呼ばれる[14]。
解析ツールとデータベース[編集]
TADの位置は、Hi-Cデータに特定のアルゴリズムを適用することで定義される。一例として、TADは"directionality index"と呼ばれる、特定のゲノム領域においてその上流域または下流域との相互作用にどの程度偏りがあるかを定量化する指標によって同定される[4]。Directionality indexは 40kbのビンサイズで計算され、各ビン内のリードのペアリードがビンの上流と下流のどちらにマッピングされるかが観察される(リードペアの距離は2Mb以内であることが必要である)。正のdirectionality indexはリードペアが上流よりも下流に多く位置していることを、負の場合はその逆を意味する。この値はTADの境界付近では大きく変化することとなり、TADを同定することができる。
Juicebox[15]、HiGlass[16]/HiPiler[17]、The 3D Genome Browser[18]、3DIV[19]、3D-GNOME[20]、TADKB[21]といった専門的なゲノムブラウザと可視化ツールが開発されており[22]、さまざまな細胞種で目的のゲノム領域のTAD構成を可視化することが可能となっている。
形成機構[編集]
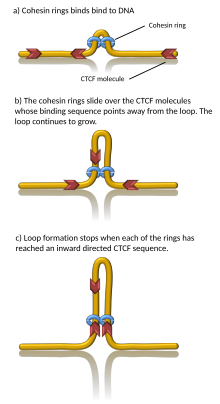
CTCFやコヒーシン複合体など、いくつかのタンパク質がTAD形成と関係していることが知られている[1]。TAD境界に必要な構成要素が何であるかは不明であるが、哺乳類細胞ではこうした領域にはCTCFが比較的高レベルで結合していることが示されている。さらに、一部の種類の遺伝子(tRNA遺伝子やハウスキーピング遺伝子)はTAD境界近傍に高頻度で位置している[3][4]。
計算機シミュレーションでは、コヒーシンモーターによってクロマチンのループ構造が押し出されることでTADが形成されうることが示されている[23][24]。この"loop extrusion"モデルでは、コヒーシンがクロマチンへ結合して内部へ引き込むモーターとして作用することで、クロマチンが押し出されてループが形成される。コヒーシン複合体は、クロマチンに結合したCTCFタンパク質に出会うまで両側のクロマチンを押し出し続ける。CTCFと出会うことで押し出しは停止し、クロマチンループのアンカーとしてTAD境界が形成される[25]。実際にin vitroでは、コヒーシンがATP依存的にDNAループを押し出し続け[26][27][28]、CTCF結合部位で停止することが観察されている[29][30]。また、コヒーシンは動的にクロマチンから解離しうるため、このモデルはTAD(や関連するクロマチンループ)は動的かつ一過的な構造であることを示唆しており、このことはin vivoでの観察と一致する[31][32][33][34]。しかしながら、一部のin vitroデータでは観察されるループがアーティファクトである可能性も示されている[35][36]。
TAD形成に関しては、他の機構も提唱されている。一部のシミュレーションでは、転写によって生じた超らせんによってコヒーシンのTAD境界への再局在が引き起こされる[37][38]、または受動的に拡散するコヒーシンの"slip link"によってTADが形成される[39][40]、といった機構が示唆されている。
性質[編集]
保存性[編集]
TADは、異なる細胞種(例えば幹細胞と血液細胞など)の間や、さらに特定の事例では種間でも比較的保存されていることが報告されている[4][41][42][43]。
プロモーター-エンハンサー相互作用との関係[編集]
観察されるプロモーターとエンハンサーとの間の相互作用の大部分は、TAD境界を越えることはない。CRISPRによる関連領域の除去などによってTAD境界を除去すると、新たなプロモーター-エンハンサー相互作用が形成される。こうした変化は近傍の遺伝子発現に影響を与え、調節異常によって四肢の奇形(多指症など)が引き起こされることがヒトやマウスで示されている[42]。
計算機シミュレーションでは、転写によって引きこされるクロマチン繊維の超らせん構造の形成がTAD形成機構となりうること、そして同じTAD内に位置するエンハンサー-プロモーター間の効率的相互作用を保証する機構ともなりうることが示されている[44]。
ゲノムのその他の構造的特徴との関係[編集]
DNA複製の単位となる複製ドメインはTADと関係していることが示されており、複製ドメインの境界はTAD境界との一致がみられる[45]。TADの機能的根底には、CTCF/コヒーシン結合領域によって形成されるDNAループであるinsulated neighborhood構造があることが提唱されている[46]。
疾患における役割[編集]
TAD境界の破壊は近傍遺伝子の発現に影響を与え、疾患の原因となる[47]。
例えば、TAD境界の破壊をもたらすゲノム構造変異はヒトの四肢の奇形など、発生過程と関連した疾患の原因となることが報告されている[48][49][50]。さらにいくつかの研究では、TAD境界の破壊や再編成は、T細胞急性リンパ性白血病(T-ALL)[51]、神経膠腫[52]、肺がん[53]など特定のがんの成長に有利になるというエビデンスが得られている。
ラミナ結合ドメイン[編集]

ラミナ結合ドメイン(lamina-associated domain、LAD)は、核膜内膜上のネットワーク構造である核ラミナと高度に相互作用するクロマチン領域である[54]。LADは主に転写がサイレンシングされたクロマチン領域によって構成され、ヒストンH3のリジン27番残基のトリメチル化(H3K27me3)に富んでいる。この修飾は、ヘテロクロマチンに多くみられる翻訳後修飾である[55]。LADの周縁部にはCTCF結合部位が存在する[54]。
出典[編集]
- ^ a b c “Three-dimensional genome architecture: players and mechanisms”. Nature Reviews. Molecular Cell Biology 16 (4): 245–257. (April 2015). doi:10.1038/nrm3965. PMID 25757416.
- ^ a b “The Three-Dimensional Organization of Mammalian Genomes”. Annual Review of Cell and Developmental Biology 33: 265–289. (October 2017). doi:10.1146/annurev-cellbio-100616-060531. PMC 5837811. PMID 28783961.
- ^ a b c d “Spatial partitioning of the regulatory landscape of the X-inactivation centre”. Nature 485 (7398): 381–385. (April 2012). Bibcode: 2012Natur.485..381N. doi:10.1038/nature11049. PMC 3555144. PMID 22495304.
- ^ a b c d e f “Topological domains in mammalian genomes identified by analysis of chromatin interactions”. Nature 485 (7398): 376–380. (April 2012). Bibcode: 2012Natur.485..376D. doi:10.1038/nature11082. PMC 3356448. PMID 22495300.
- ^ “Regulation of disease-associated gene expression in the 3D genome”. Nature Reviews. Molecular Cell Biology 17 (12): 771–782. (December 2016). doi:10.1038/nrm.2016.138. PMID 27826147.
- ^ “Highly rearranged chromosomes reveal uncoupling between genome topology and gene expression”. Nature Genetics 51 (8): 1272–1282. (August 2019). doi:10.1038/s41588-019-0462-3. PMC 7116017. PMID 31308546.
- ^ “The three-dimensional cancer genome”. Current Opinion in Genetics & Development 36: 1–7. (February 2016). doi:10.1016/j.gde.2016.01.002. PMC 4880523. PMID 26855137.
- ^ “TAD disruption as oncogenic driver”. Current Opinion in Genetics & Development 36: 34–40. (February 2016). doi:10.1016/j.gde.2016.03.008. PMC 4880504. PMID 27111891.
- ^ “Disruption of the 3D cancer genome blueprint”. Epigenomics 9 (1): 47–55. (January 2017). doi:10.2217/epi-2016-0111. PMID 27936932.
- ^ “Structural variation in the 3D genome”. Nature Reviews. Genetics 19 (7): 453–467. (July 2018). doi:10.1038/s41576-018-0007-0. hdl:21.11116/0000-0003-610A-5. PMID 29692413.
- ^ a b “Chromatin Domains: The Unit of Chromosome Organization”. Molecular Cell 62 (5): 668–680. (June 2016). doi:10.1016/j.molcel.2016.05.018. PMC 5371509. PMID 27259200.
- ^ “Topology of mammalian developmental enhancers and their regulatory landscapes”. Nature 502 (7472): 499–506. (October 2013). Bibcode: 2013Natur.502..499D. doi:10.1038/nature12753. PMID 24153303.
- ^ “Three-dimensional folding and functional organization principles of the Drosophila genome”. Cell 148 (3): 458–472. (February 2012). doi:10.1016/j.cell.2012.01.010. PMID 22265598.
- ^ a b “Principles of genome folding into topologically associating domains”. Science Advances 5 (4): eaaw1668. (April 2019). Bibcode: 2019SciA....5.1668S. doi:10.1126/sciadv.aaw1668. PMC 6457944. PMID 30989119.
- ^ “Juicebox Provides a Visualization System for Hi-C Contact Maps with Unlimited Zoom”. Cell Systems 3 (1): 99–101. (July 2016). doi:10.1016/j.cels.2015.07.012. PMC 5596920. PMID 27467250.
- ^ “HiGlass: web-based visual exploration and analysis of genome interaction maps”. Genome Biology 19 (1): 125. (August 2018). doi:10.1186/s13059-018-1486-1. PMC 6109259. PMID 30143029.
- ^ “HiPiler: Visual Exploration of Large Genome Interaction Matrices with Interactive Small Multiples”. IEEE Transactions on Visualization and Computer Graphics 24 (1): 522–531. (January 2018). doi:10.1109/TVCG.2017.2745978. PMC 6038708. PMID 28866592.
- ^ “The 3D Genome Browser: a web-based browser for visualizing 3D genome organization and long-range chromatin interactions”. Genome Biology 19 (1): 151. (October 2018). doi:10.1186/s13059-018-1519-9. PMC 6172833. PMID 30286773.
- ^ “3DIV: A 3D-genome Interaction Viewer and database”. Nucleic Acids Research 46 (D1): D52–D57. (January 2018). doi:10.1093/nar/gkx1017. PMC 5753379. PMID 29106613.
- ^ “3D-GNOME: an integrated web service for structural modeling of the 3D genome”. Nucleic Acids Research 44 (W1): W288–W293. (July 2016). doi:10.1093/nar/gkw437. PMC 4987952. PMID 27185892.
- ^ Liu, T., Porter, J., Zhao, C. et al. TADKB: Family classification and a knowledge base of topologically associating domains. BMC Genomics 20, 217 (2019). https://doi.org/10.1186/s12864-019-5551-2
- ^ “Visualising three-dimensional genome organisation in two dimensions”. Development 146 (19): 99–101. (September 2019). doi:10.1242/dev.177162. PMID 31558569.
- ^ “Formation of Chromosomal Domains by Loop Extrusion”. Cell Reports 15 (9): 2038–2049. (May 2016). doi:10.1016/j.celrep.2016.04.085. PMC 4889513. PMID 27210764.
- ^ “Chromatin extrusion explains key features of loop and domain formation in wild-type and engineered genomes”. Proceedings of the National Academy of Sciences of the United States of America 112 (47): E6456–E6465. (November 2015). Bibcode: 2015PNAS..112E6456S. doi:10.1073/pnas.1518552112. PMC 4664323. PMID 26499245.
- ^ “Organization of Chromosomal DNA by SMC Complexes”. Annual Review of Genetics 53 (1): 445–482. (December 2019). doi:10.1146/annurev-genet-112618-043633. PMID 31577909.
- ^ “Cohesin and condensin extrude DNA loops in a cell cycle-dependent manner”. eLife 9: e53885. (May 2020). doi:10.7554/eLife.53885. PMC 7316503. PMID 32396063.
- ^ “DNA loop extrusion by human cohesin”. Science 366 (6471): 1338–1345. (December 2019). Bibcode: 2019Sci...366.1338D. doi:10.1126/science.aaz3418. PMID 31753851.
- ^ “Human cohesin compacts DNA by loop extrusion”. Science 366 (6471): 1345–1349. (December 2019). Bibcode: 2019Sci...366.1345K. doi:10.1126/science.aaz4475. PMC 7387118. PMID 31780627.
- ^ Davidson, Iain F.; Barth, Roman; Zaczek, Maciej; van der Torre, Jaco; Tang, Wen; Nagasaka, Kota; Janissen, Richard; Kerssemakers, Jacob et al. (2023-04). “CTCF is a DNA-tension-dependent barrier to cohesin-mediated loop extrusion”. Nature 616 (7958): 822–827. doi:10.1038/s41586-023-05961-5. ISSN 1476-4687. PMC PMC10132984. PMID 37076620.
- ^ Zhang H, Shi Z, Banigan EJ, Kim Y, Yu H, Bai X, Finkelstein IJ (7 October 2022). "CTCF and R-loops are boundaries of cohesin-mediated DNA looping" (英語). bioRxiv 10.1101/2022.09.15.508177。
- ^ “Dynamics of CTCF- and cohesin-mediated chromatin looping revealed by live-cell imaging”. Science 376 (6592): 496–501. (April 2022). Bibcode: 2022Sci...376..496G. doi:10.1126/science.abn6583. PMC 9069445. PMID 35420890.
- ^ Beckwith KS, Ødegård-Fougner Ø, Morero NR, Barton C, Schueder F, Tang W, et al. (2 May 2022). "Visualization of loop extrusion by DNA nanoscale tracing in single human cells" (英語). bioRxiv 10.1101/2021.04.12.439407。
- ^ Mach, Pia; Kos, Pavel I.; Zhan, Yinxiu; Cramard, Julie; Gaudin, Simon; Tünnermann, Jana; Marchi, Edoardo; Eglinger, Jan et al. (2022-12). “Cohesin and CTCF control the dynamics of chromosome folding”. Nature Genetics 54 (12): 1907–1918. doi:10.1038/s41588-022-01232-7. ISSN 1546-1718. PMC 9729113. PMID 36471076.
- ^ “Single-nucleus Hi-C reveals unique chromatin reorganization at oocyte-to-zygote transition”. Nature 544 (7648): 110–114. (April 2017). Bibcode: 2017Natur.544..110F. doi:10.1038/nature21711. PMC 5639698. PMID 28355183.
- ^ Man, Zhou (September 2022). “DNA sliding and loop formation by E. coli SMC complex: MukBEF”. Biochemistry and Biophysics Reports 31: 101297. doi:10.1016/j.bbrep.2022.101297. PMC 9234588. PMID 35770038.
- ^ “Bridging-induced phase separation induced by cohesin SMC protein complexes”. Science Advances 7 (7): eabe5905. (February 2021). Bibcode: 2021SciA....7.5905R. doi:10.1126/sciadv.abe5905. PMC 7875533. PMID 33568486.
- ^ “Are TADs supercoiled?”. Nucleic Acids Research 47 (2): 521–532. (January 2019). doi:10.1093/nar/gky1091. PMC 6344874. PMID 30395328.
- ^ “Transcription-induced supercoiling as the driving force of chromatin loop extrusion during formation of TADs in interphase chromosomes”. Nucleic Acids Research 46 (4): 1648–1660. (February 2018). doi:10.1093/nar/gkx1123. PMC 5829651. PMID 29140466.
- ^ “Nonequilibrium Chromosome Looping via Molecular Slip Links”. Physical Review Letters 119 (13): 138101. (September 2017). arXiv:1612.07256. Bibcode: 2017PhRvL.119m8101B. doi:10.1103/PhysRevLett.119.138101. PMID 29341686.
- ^ “Osmotic mechanism of the loop extrusion process”. Physical Review E 96 (3–1): 030402. (September 2017). Bibcode: 2017PhRvE..96c0402Y. doi:10.1103/PhysRevE.96.030402. hdl:1887/58394. PMID 29346962.
- ^ “Comparative Hi-C reveals that CTCF underlies evolution of chromosomal domain architecture”. Cell Reports 10 (8): 1297–1309. (March 2015). doi:10.1016/j.celrep.2015.02.004. PMC 4542312. PMID 25732821.
- ^ a b “Coupling 1D modifications and 3D nuclear organization: data, models and function”. Current Opinion in Cell Biology 44: 20–27. (February 2017). doi:10.1016/j.ceb.2016.12.001. PMID 28040646.
- ^ “Comparing 3D Genome Organization in Multiple Species Using Phylo-HMRF”. Cell Systems 8 (6): 494–505.e14. (June 2019). doi:10.1016/j.cels.2019.05.011. PMC 6706282. PMID 31229558.
- ^ “Are TADs supercoiled?”. Nucleic Acids Research 47 (2): 521–532. (January 2019). doi:10.1093/nar/gky1091. PMC 6344874. PMID 30395328.
- ^ “Control of DNA replication timing in the 3D genome”. Nature Reviews. Molecular Cell Biology 20 (12): 721–737. (December 2019). doi:10.1038/s41580-019-0162-y. PMID 31477886.
- ^ “3D Chromosome Regulatory Landscape of Human Pluripotent Cells”. Cell Stem Cell 18 (2): 262–275. (February 2016). doi:10.1016/j.stem.2015.11.007. PMC 4848748. PMID 26686465.
- ^ “Breaking TADs: How Alterations of Chromatin Domains Result in Disease”. Trends in Genetics 32 (4): 225–237. (April 2016). doi:10.1016/j.tig.2016.01.003. hdl:11858/00-001M-0000-002E-1D1D-D. PMID 26862051.
- ^ “Disruptions of topological chromatin domains cause pathogenic rewiring of gene-enhancer interactions”. Cell 161 (5): 1012–1025. (May 2015). doi:10.1016/j.cell.2015.04.004. PMC 4791538. PMID 25959774.
- ^ “A Family's Shared Defect Sheds Light on the Human Genome”. The New York Times. (2017年1月9日)
- ^ “Formation of new chromatin domains determines pathogenicity of genomic duplications” (英語). Nature 538 (7624): 265–269. (October 2016). Bibcode: 2016Natur.538..265F. doi:10.1038/nature19800. hdl:11858/00-001M-0000-002C-010A-3. PMID 27706140.
- ^ “Activation of proto-oncogenes by disruption of chromosome neighborhoods”. Science 351 (6280): 1454–1458. (March 2016). Bibcode: 2016Sci...351.1454H. doi:10.1126/science.aad9024. PMC 4884612. PMID 26940867.
- ^ “Insulator dysfunction and oncogene activation in IDH mutant gliomas”. Nature 529 (7584): 110–114. (January 2016). Bibcode: 2016Natur.529..110F. doi:10.1038/nature16490. PMC 4831574. PMID 26700815.
- ^ “Pan-cancer analysis of somatic copy-number alterations implicates IRS4 and IGF2 in enhancer hijacking”. Nature Genetics 49 (1): 65–74. (January 2017). doi:10.1038/ng.3722. PMC 5791882. PMID 27869826.
- ^ a b “On TADs and LADs: Spatial Control Over Gene Expression”. Trends in Genetics 32 (8): 485–495. (August 2016). doi:10.1016/j.tig.2016.05.004. PMID 27312344.
- ^ “Navigating the epigenetic landscape of pluripotent stem cells”. Nature Reviews. Molecular Cell Biology 13 (8): 524–535. (July 2012). doi:10.1038/nrm3393. PMID 22820889.
