エライオプラスト
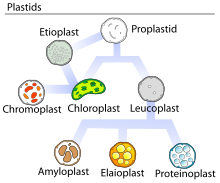

Illustration from Collegiate Dictionary, FA Brockhaus and IA Efron, circa 1905.
エライオプラスト(英: elaioplast)は一般的な3つの白色体のタイプのうちの1つであり、その主要な機能は脂肪酸、テルペン、その他の脂質の合成と貯蔵である。油糧種子の子葉、柑橘類の果実、多くの被子植物の葯に存在する[1][2][3][4]。
概要[編集]
大部分の白色体と同様、エライオプラストは色素を持たない細胞小器官であり、異なる形態の色素体と相互転換が可能である。エライオプラストは主に脂質の貯蔵と代謝を担い[5]、近年の研究ではこれらの細胞小器官がテルペンや脂肪酸の形成に関与していることが示されている[2][3]。典型的な外観は、油滴で満たされた小さな丸い細胞小器官である[1]。エライオプラスト内の脂質は原核生物によって合成される脂質を反映したものであり、主にトリアシルグリセロールとステロールエステルである。これらの物質は集合して油滴となり、顕微鏡で観察可能である[1]。その他の構成要素としては、フィブリリンなどのプラストグロビュール結合タンパク質を含んでいる。フィブリリンは色素体の祖先型シアノバクテリアから保持されていると考えられているタンパク質ファミリーである[4]。エライオプラストはタペトソーム(tapetosome、小胞体によって産生される油脂とタンパク質のクラスター)ともに被子植物の葯のタペータムで高頻度でみられ、そこでは色素体の油脂とタペトソームのタンパク質が発生中の花粉粒の外被(pollen coat)を形成するために利用される[1]。花粉粒の成熟後、これらの細胞小器官は分解され葯室へ放出される[1]。エライオプラストは油糧種子にも存在し、このグループのエライオプラストによってもたらされる脂質は炭水化物に変換され、胚の発芽の際のエネルギーとして利用される[4]。柑橘類の果皮には特に多量のエライオプラストが存在することが示されており、そこでのテルペンの産生に必要不可欠である[5]。
発生[編集]
植物内では、エライオプラストは他の色素体と同様、茎の分裂領域であるメリステムに存在する原色素体(proplastid)に由来する。原色素体は未分化状態であり、そのため既知の多様な色素体のいずれにも分化することができ、何へ分化するかは存在する組織によって決定される[6]。体細胞では原色素体の発生過程は一方向の経路であり、ある形態から他の形態への移行は起こらない。しかしながら、生殖細胞では色素体は頻繁に相互転換を起こしている可能性がある[7]。被子植物の葯ではエライオプラストはタペータムでの色素体の発生の最終段階である。原色素体から直接生じたものであるか、他の色素体からの転換によって生じたもののいずれかであり、生物種や受粉の戦略に依存して異なる[7]。
起源と遺伝[編集]
色素体は10億年以上前に生じた祖先型真核生物と祖先型シアノバクテリアとの内部共生に由来するものであり、真核生物に取り込まれた細菌が光合成のための代謝中心として保持されたものであると考えられている[8]。その証拠は、色素体のゲノムの特徴が現代のシアノバクテリアと密接に関連していることからも観察される[9]。太古の共生以降、色素体のゲノムは大きく縮小し、約2500種類の関連タンパク質のうち自身のゲノムがコードしているのは約100種類にすぎず、それ以外の遺伝子は核ゲノムへ移行している[1]。
大部分の色素体と同様、エライオプラストは親細胞の分裂とは独立して二分裂によって増殖し、これは祖先型細菌の特徴である[1]。分裂は細胞質分裂の直前に起こり、細胞質の構成要素として娘細胞へ受け継がれる[1]。
他の色素体ファミリーと相互転換することから明らかなように、エライオプラストは他の全ての色素体と同一のゲノム(plastome)を持っており、被子植物では主に母性遺伝する[5][7]。父親由来ののplastomeは、花粉の発生または花粉管の形成過程で排除される[7]。花粉の発生過程では、父親の色素体は小胞子の分裂の直前にマイクロフィラメントによって移行が阻止されるか、その直後に分解される[7]。父親由来の色素体は花粉管の形成過程でも阻止され、色素体は精細胞が卵と融合する際に分離される[7]。
出典[編集]
- ^ a b c d e f g h “The Diversity of Plastid Form and Function”. The Structure and Function of Plastids. Advances in Photosynthesis and Respiration. 23. (2007). pp. 3–26. doi:10.1007/978-1-4020-4061-0_1. ISBN 978-1-4020-4060-3
- ^ a b “Evidence That a Malate/Inorganic Phosphate Exchange Translocator Imports Carbon across the Leucoplast Envelope for Fatty Acid Synthesis in Developing Castor Seed Endosperm”. Plant Physiology 114 (3): 851–856. (July 1997). doi:10.1104/pp.114.3.851. PMC 158371. PMID 12223747.
- ^ a b “Monoterpene hydrocarbon biosynthesis by isolated leucoplasts of Citrofortunella mitis”. Planta 159 (4): 373–81. (November 1983). doi:10.1007/BF00393177. PMID 24258236.
- ^ a b c “Plastoglobuli: Plastid Microcompartments with Integrated Functions in Metabolism, Plastid Developmental Transitions, and Environmental Adaptation”. Annual Review of Plant Biology 68 (1): 253–289. (April 2017). doi:10.1146/annurev-arplant-043015-111737. PMID 28125283.
- ^ a b c “A comprehensive proteomic analysis of elaioplasts from citrus fruits reveals insights into elaioplast biogenesis and function”. Horticulture Research 5 (1): 6. (7 February 2018). doi:10.1038/s41438-017-0014-x. PMC 5802726. PMID 29423236.
- ^ “Plastid proteomics in higher plants: current state and future goals”. Plant Physiology 155 (4): 1578–88. (April 2011). doi:10.1104/pp.111.172932. PMC 3091083. PMID 21350036.
- ^ a b c d e f “Anther plastids in angiosperms”. The Botanical Review 67 (1): 54–73. (January 2001). doi:10.1007/BF02857849.
- ^ McFadden, Geoffrey Ian (December 1999). “Endosymbiosis and evolution of the plant cell”. Current Opinion in Plant Biology 2 (6): 513–519. doi:10.1016/s1369-5266(99)00025-4. PMID 10607659.
- ^ “Gene transfer to the nucleus and the evolution of chloroplasts”. Nature 393 (6681): 162–5. (May 1998). Bibcode: 1998Natur.393..162M. doi:10.1038/30234. PMID 11560168.
関連文献[編集]
- Kwiatkowska M, Stępiński D, Popłońska K, Wojtczak A, Polit JT (2010) ‘Elaioplasts’ identified as lipotubuloids in Althaea rosea, Funkia sieboldiana and Vanilla planifolia contain lipid bodies connected with microtubules. Acta Soc Bot Pol 80(3):211–219
