塩化インジウム(III)
| 塩化インジウム(III) | |
|---|---|
| |
別称 Indium chloride | |
| 識別情報 | |
| CAS登録番号 | 10025-82-8 |
| PubChem | 24812 |
| ChemSpider | 23197 |
| UNII | 58TD96H03I |
| |
| |
| 特性 | |
| 化学式 | InCl3 |
| モル質量 | 221.18 g/mol |
| 外観 | 白色薄片 |
| 密度 | 3.46 g/cm3 |
| 融点 |
586 °C, 859 K, 1087 °F |
| 沸点 |
800 °C, 1073 K, 1472 °F |
| 水への溶解度 | 可溶, 発熱 |
| 他の溶媒への溶解度 | テトラヒドロフラン |
| 構造 | |
| 結晶構造 | 単斜晶, mS16 |
| 空間群 | C12/m1, No. 12 |
| 危険性 | |
| EU Index | Not listed |
| NFPA 704 | |
| 関連する物質 | |
| その他の陰イオン | フッ化インジウム(III) 臭化インジウム(III) ヨウ化インジウム(III) |
| その他の陽イオン | 塩化アルミニウム 塩化ガリウム 塩化タリウム(III) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化インジウム(III)(Indium(III) chloride)は、化学式InCl3の化合物である。無色の塩でルイス酸として有機合成に用いられる。また、可溶性のあるインジウムの誘導体としては最も入手しやすい[1]。
合成と構造[編集]
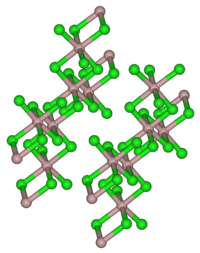
インジウムは比較的陽性の金属であり、塩素と素早く反応して三塩化物を生成する。InCl3は非常に溶けやすく、潮解性がある[2]。メタノール-ベンゼン混合溶媒中、電気化学電池を用いた合成の報告がある[3]。塩化アルミニウム(AlCl3)や塩化タリウム(III)(TlCl3)と同様に、InCl3の結晶はIn(III)中心に塩素が八面体型に配位した層が密に並んだ層状の結晶構造を作る[4]。このモチーフは、塩化イットリウム(III)(YCl3)で見られるものと類似している[5]。対照的に、塩化ガリウム(III)(GaCl3)はGa2Cl6を含む二量体として結晶化する[5]。溶融したInCl3は導電性を持つが[4]、AlCl3は二量体Al2Cl6を形成するため、電気を通さない[6]。
反応[編集]
はルイス酸であり、ドナーリガンドLと複合体を形成して 、、 を形成する。例えば、塩化物イオンが付加すると、、、を形成する[4]。
ジエチルエーテル溶液中では、InCl3は水素化リチウムLiHと反応してLiInH4を形成する。この物質は不安定で0℃以下で分解し[7]、またin situで還元剤と反応し[8]、第4級アミン及び水素化インジウム(InH3)とリンの複合体を形成する[9]。
トリメチルインジウム(InMe3)は、ジエチルエーテル中でInCl3をグリニャール試薬(MeMgI)またはメチルリチウム(LiMe)と反応させることにより合成できる。トリエチルインジウムも同様に合成できるが、グリニャール試薬としてはEtMgBrを用いる[10]。
エーテルは、真空中25℃で除去する。
は高温で金属インジウムと反応し、低い原子価の塩化インジウムである、、InClを形成する[4]。
触媒[編集]
塩化インジウムは、フリーデル・クラフツ反応やディールス・アルダー反応等の有機反応のルイス酸触媒である。後者の例としては、[11]がある。アセトニトリル-水の混合溶媒に1モル%の触媒を加えることで、反応は室温で進む。第1段階はバルビツール酸とアルデヒドのクネーフェナーゲル縮合で、第2段階はディールス・アルダー反応の逆反応である。
これはN,N'-ジメチルバルビツール酸、ベンズアルデヒド、エチルビニルエーテルの多成分反応で、触媒がある場合、90%の収率、そのうち70%がトランス異性体である。触媒がないと、収率は65%、トランス体は50%に落ちる。
出典[編集]
- ^ Araki, S.; Hirashita, T. "Indium trichloride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- ^ Indium Trichloride
- ^ Habeeb, J. J.; Tuck, D. G. "Electrochemical Synthesis of Indium(III) Complexes" Inorganic Syntheses, 1979, volume XIX, ISBN 0-471-04542-X
- ^ a b c d Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0123526515
- ^ a b Wells, A.F. Structural Inorganic Chemistry, Oxford: Clarendon Press, 1984. ISBN 0-19-855370-6.
- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。
- ^ Anthony John Downs (1993). Chemistry of aluminium, gallium, indium, and thallium. Springer. ISBN 0-7514-0103-X
- ^ Main Group Metals in Organic Synthesis vol 1, ed. Hisashi Yamamoto, Koichiro Oshima, Wiley VCH, 2004, ISBN 3527305084
- ^ The Group 13 Metals Aluminium, Gallium, Indium and Thallium: Chemical Patterns and Peculiarities, Simon Aldridge, Anthony J. Downs, wiley, 2011, ISBN 978-0-470-68191-6
- ^ Main Group compounds in Inorganic Syntheses, vol 31, , By Schultz, Neumayer, Marks; Ed., Alan H. Cowley, John Wiley & Sons, Inc., 1997, ISBN 0471152889
- ^ An efficient synthesis of novel pyrano[2,3-d]- and furopyrano[2,3-d]pyrimidines via Indium-Catalyzed Multicomponent Domino Reaction Prajapati, D. Mukut Gohain, M. Beilstein Journal of Organic Chemistry 2006, 2:11 doi:10.1186/1860-5397-2-11














