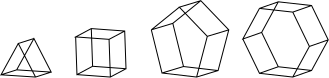
プリズマン類
プリズマン類 (prismanes) は、複数の多角形の底面と側面から構成された、角柱のような形をしている炭化水素化合物の一群である。化学的に、これらはシクロブタン環が連なったもの(全てがcis/syn配座を取ったラダーラン)を巻き上げ、末端同士を接合してシクロアルカンの縁を持つ帯としたものと見なすことができる。nをシクロブタンの側面の数(=シクロアルカンの多角形の大きさ)としたときの化学式は(C2H2)nであり、このnはここに分類される分子の体系的命名法に用いられる。最初のいくつかの分子は次のようなものである。
|
|
||
|---|---|---|---|
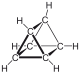
| (C2H2)3 C6H6 |
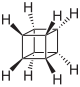
(C2H2)4 C8H8 |
(C2H2)5 C10H10 |
(C2H2)6 C12H12 |
| プリズマン [3]プリズマン トリプリズマン |
キュバン [4]プリズマン テトラプリズマン |
[5]プリズマン ペンタプリズマン |
[6]プリズマン ヘキサプリズマン |
トリプリズマン、テトラプリズマン、ペンタプリズマンは実際に合成されており、これより上位の分子に対しては計算化学的研究が行われている。最初の数種の分子は平坦なn角形の底面を持つ正角柱である。しかし分子モデリングにより、nの増大に従って対称性の高い構造は安定ではなくなり、分子はより対称性の低い構造へと歪むことが示されている。例えば、[12]プリズマンは捻れた鎖状シクロブタンの構造を取り、2つの十二角形の“底面”は平行にも平面にもならない[1][2][3]。
関連する分子構造[編集]
アステラン (asterane) は2つのn角形の底面がメチレン基で架橋された分子である。このため、各側面はシクロブタンではなくシクロヘキサンとなっている。

ポリプリズマン類 (polyprismanes) は複数のプリズマン類を積み重ねた形状の分子である[4]。中間層(各プリズマンの接合部)に位置するn角形を構成する炭素には水素が結合していない。
nを増大させてゆくと、幾つかのシクロブタン環をanti位で結合させ凹多角形の底面を持つ分子を考えることが可能になり、これらはプリズマン類における幾何異性体となる。星型の底面を持つドデカ[12]プリズマンの2つの異性体(ヘルベタン (helvetane)、イスラエラン (israelane) と命名されている)に対して計算化学的研究が行われている[5] これらの分子は元々、エイプリルフールのジョークとして提案されたものだった。
出典[編集]
- ^ Gribanova, T. N.; Minyaev, R. M.; Minkin, V. I. (2007). “Quantum-chemical investigation of structure and stability of [n]-prismanes and [n]-asteranes”. Russian Journal of Organic Chemistry 43 (8): 1144–1150. doi:10.1134/S107042800708009X.
- ^ Shinmyozu, Terou; Nogita, Riki; Akita, Motoki; Lim, Chultack (2003). “23. Photochemical Approaches to the Synthesis of [n]Prismanes”. CRC Handbook of Organic Photochemistry and Photobiology, Volumes 1 & 2, Second Edition. CRC Press. ISBN 9780203495902
- ^ Allinger, Norman L.; Eaton, Philip E. (1983). “The geometries of pentaprismane and hexaprismane insights from molecular mechanics”. Tetrahedron Letters 24 (35): 3697–3700. doi:10.1016/S0040-4039(00)94512-X.
- ^ Minyaev, Ruslan M.; Minkin, Vladimir I.; Gribanova, Tatyana N.; Starikov, Andrey G.; Hoffmann, Roald (2003). “Poly[n]prismanes: A Family of Stable Cage Structures with Half-Planar Carbon Centers”. J. Org. Chem. 68 (22): 8588–8594. doi:10.1021/jo034910l.
- ^ Wang, Xin; Lau, Kai-Chung; Li, Wai-Kee (2009). “Structures and Properties of Closed Ladderanes C24H24, Laddersilanes Si24H24, and Their Nitrogen-Containing Isoelectronic Equivalents: A G3(MP2) Investigation”. J. Phys. Chem. A 113 (14): 3413–3419. doi:10.1021/jp900161s.