ノート:自由エネルギー
等積条件について[編集]
等積条件について、会話ページに書かれた内容への返信です。IP利用者の会話ページに書いても誰も読まないでしょうからこちらに書きます。
まず一つ目のヘルムホルツエネルギーの等温過程に関してですが、この記事における構成は
- ヘルムホルツエネルギーの定義 F=U-TS があり、これに
- エネルギー保存則 Q=W+ΔU および
- クラウジウス的なエントロピーの定義と、等温条件から導かれる Q<=T_ex ΔS という結果を組み合わせれば
- W<=-ΔF という結果が導かれる
- さらに、W=0という条件を追加すれば、ΔF<=0 という結果が導かれる
という形になっている。
等積の条件が必要であることを明記するべきではないでしょうか
とのことであるが、どこで等積の条件が表れるのか。用いたのは等温条件と、仕事としての外部とのエネルギーの移動がないという条件である。
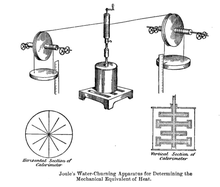
「等積条件」は、「仕事としてのエネルギーの移動がないこと」とは別物です。 有名な実験だと思うが、ジュールが行った羽根車の実験は等積条件であるが、仕事の形での外部とのエネルギーの移動がある。 これは極端な例ではあるが、ピストン-シリンダ系を考え、仕事をピストンの移動によるものに限るとしても、断面積が同じシリンダを向かい合わせにして両方のピストンをつなげば、一方の体積の増加分が他方の減少分と相殺され、全体としては体積が一定となる(重機の油圧シリンダとかで似たような形は現実にある)。もちろんピストンの移動に伴って仕事としてのエネルギーの移動があります。
二つ目のギブズエネルギーの方は似たようなことの繰り返しですから省略します。 -124.110.184.77 2016年2月27日 (土) 05:59 (UTC)
新たな編集により、「非膨張仕事」という用語が導入されていますね。電気的なエネルギーの移動など、熱的、物質的、機械的なものを除いたエネルギーの移動を指すという解釈でよろしいか。 それとも、先に挙げた例は機械的なエネルギーの移動であるが、これらも「非膨張仕事」に含むのか。 後者であれば、ヘルムホルツエネルギーの部分は、間違った記述だとは思いませんが。 電気的なエネルギーやらを含む場合にはギブズエネルギーは面倒くさいことになるんですよね。定義から色々変わってくるから細かいところまで言及しないと不正確になってしまうよね。 -124.110.184.77 2016年2月27日 (土) 06:52 (UTC)
返信[編集]
貴会話ページへ記入した者です。こちらへの転記、ありがとうございます。 他の項目(エクセルギー)との関連で、この件についてはかなり調べたつもりです。
(1) 当該項目の(以前の)記述で気になっていたのは、自発変化の方向と平衡条件に関してです。
- 等温条件下では F が減少する方向へ変化し、F が極小で平衡となる。
- 等温等圧条件下では G が減少する方向へ変化し、G が極小で平衡となる。
ということであれば、後者の場合は前者の一部ですから、F = G でない限り矛盾しています。
(2) 説明なく「非膨張仕事」との用語を用いたのは、ご指摘の通りよくないですね。私は機械屋ですので、仕事としては体積変化に伴うものしか念頭にありませんでしたが、物理化学分野では「膨張仕事」、「非膨張仕事」との用語を用いているようでしたので(例えばアトキンス物理化学)。 dW = p dV で表されるのが膨張仕事(機械屋の「工業仕事」も含む)で、それ以外が非膨張仕事と理解しています。表面張力やゴム張力を利用して取り出す力学的仕事、電気的仕事、その他すべて非膨張仕事と考えています。どこかで説明を付すことが必要ですね。
(3) W <= -ΔF は等温条件だけで成立しますが、この W にはすべての仕事が含まれています。それを等圧条件下に限った W <= - ΔG では膨張仕事を ΔG に含めていますので、W は非膨張仕事だけになります。 ヘルムホルツエネルギーの上記5ステップ構成の5において、 W = 0 と置くことは膨張仕事、非膨張仕事を共にゼロと置くことになりますので、ΔF <= 0 には dV = 0 の条件が含まれていると解すべきではないでしょうか(取り出した非膨張仕事を使って系を圧縮するような事は考えなくていいでしょう)。 これをもとに、自発変化の方向、平衡条件を論じるのであれば、等積は必須です。
(4) F を用いた自発変化、平衡条件には、W.J.Moore 物理化学(4版訳本)、P.A.Atkins 物理化学(6版訳本)には、明確に等積の条件が記載されています。ギブズ論文(1875-78)では等積であることは明示されていませんが、もっぱら容器内に閉じ込めた物質を対象としているようです。ヘルムホルツ(1882日本化学会出版センター化学の原典3)は、ギブズの論文とは独立に(知らずに) F を導いていますが、等温以外の条件はつけていません。M.Planck 熱力学(英訳版)やそれを基にしたと思える芝亀吉 熱力学(岩波1950)では、少し曖昧ですが、「体積が一定である場合や多くの化学変化のように外からの仕事が無視できる量であるとき」となっています。 当時から混同があったようで、上記ヘルムホルツ論文の解説では、ネルンストが起電力を論じる際に、G を用いるべきところを F を用いた旨、紹介されています。
(5) 例として挙げられているジュールの仕事当量実験の件、攪拌槽内の水を系と考えて、これは断熱の等圧系と考えるのが妥当と思います(水が多少膨張しますので)。この場合、重りの位置エネルギー -W はエンタルピーの増加 ΔH = ΔU + p ΔV に等しくなります。内部エネルギー変化 ΔU を見ると - W - p ΔV ですので、 (内部エネルギー減少) = (非膨張仕事) + (膨張仕事) となっています。 F と G の関係は上記の U と H の関係と同じように考えればよいと思います。
(6) 上の例の水のエントロピー変化は、可逆的に熱を加えたのと等価ですから、T の変化を無視して ΔS = mgH/T となり、増加しています。断熱の条件では当然 ΔS >= 0 が自律変化の方向です。 F または G と関連付けるには、等温にするために冷却が必要となり、結局、水の状態は変化せず、重りの位置エネルギーを熱として除去する結果にしかなりません。化学系や多成分系でない単純な系では自由度が 2 ですので、良い例を考えにくいように思います。
以上、よろしくご検討下さい。 __Shoji Yamauchi(会話) 2016年2月27日 (土) 14:59 (UTC)
- そもそも等温条件の下で必ず自由エネルギーが減る方向に状態が移るとは限りません。自発的な過程の場合に、自由エネルギーが減る方向に移ります。“自発的”とは、羽根車による撹拌や外場の印加など、外界からの影響がないということです。等温条件の場合には体積の増減に伴う仕事もないが、等温等圧条件であればこれが許されている。条件によって“自発的”の意味するところが変わるから、極小化される自由エネルギーも異なることは別に矛盾ではありません。
- W=0 と置くことは(略)dV=0 の条件が含まれていると解すべきではありません。自由膨張を考察すれば解るように、W=0 から V=const. は導かれません。
- 羽根車の実験についてですが、この実験の設定は、外界の影響を羽根車だけを通して伝えるものですから、羽根車を回すシャフトを通す部分とかを除いてほぼ断熱密閉されたリジッドな容器ですから体積は一定ですね。あと羽根が流体に及ぼす圧力を考えれば等圧系ではありません。-124.110.184.77 2016年3月7日 (月) 14:36 (UTC)
返信2[編集]
(1) 一部繰り返しになりますが、貴下のステップ5で、 W <= -ΔF の式に W = 0 を適用する場合、体積増加があれば 膨張仕事 dWV は正の値にならざるを得ません。 (簡略化のため、仕事 dW 、膨張仕事 dWV 、非膨張仕事 dWe と表します。)
膨張仕事は常に dWV ≤ p dV です。 自由膨張の例をもとに dW = 0 でも膨張できるとされていますが、これは系の外縁が真空になるという極端な非平衡の例です。 非平衡時の外縁の圧力 pex (またはそれに相当するもの)が分かれば、dWV = pex dV となります。
自発変化の方向や平衡条件を検討するには、平衡(変化しない状態)に近い状態を取り上げなければ意味がありません。 系の外縁が真空となり、自由膨張のようにガクガクと真空中へ膨張するような系では適用例をさがすのに苦労します。
dWV が多少なりとも正の値になれば、外部より別の非膨張仕事を加えて dWe < 0 として dW = dWV + dWe = 0 とすることも可能でしょうが、これも適用例を考えるのが大変です。 dV = 0 として、dWV = dWe = 0 とするのが実際に合っています。
(2) 羽根車の実験について。
強固な密閉容器を水で満たして漏れを完全に無くして攪拌すれば、等積で仕事 (- W) を加えたことになりますので、断熱等積の条件になります。同時に、圧力はそれ相当に上がりますので容器は熱膨張に加えて変形もしないように作らねばなりません。 このときは、加えたエネルギー(仕事)は内部エネルギー U の増加になります。
しかし、ジュールの実験も含めて、普通は水面上の空気は大気に通じており、大気圧のもとで、等圧条件で攪拌することになります。 ご存知のとおり、 等圧条件で加えた熱や(膨張仕事を除いた)仕事などのエネルギーは、一部は周囲の物体(空気)を押す仕事に使われ、結局、エンタルピー H の増加に等しくなります(羽根表面の複雑な圧力の問題は、水中の回転軸も系に含めてしまえば回避できます)。
水を攪拌する代わりに気体を攪拌すれば両者の違いは明白です。固体や液体では U と H の差 p V は小さいのですが、ゼロではありません。 ジュールの実験でも、もし等積で行えば、ほんの少し温度上昇が(原理的に)大きくなるはずです。 参考までに、固体や液体の比熱 c として通常用いられているのは、等圧比熱 cp です。
(3) 常に成り立つ変化の方向は、第二法則より dS ≥ dQ/T = (dU + dW)/T です。 dU - T dS + dW ≤ 0 と書いた方がいいかもしれません。自発性と仕事の有無とは別問題です。
等積であるか等圧であるか、または仕事の出入りがあるかどうかに関係なく、断熱でさえあれば dS ≥ 0 となります。 変化の方向を決めるのは、この場合はエントロピーです。 先に述べたように、羽根車実験では ΔS = mg H/T となって、増加しています。
自由エネルギー変化の -TdS の項は熱の出入りに対応しますので、断熱の場合、自由エネルギーは直接は関係ありません。
(4) 自由エネルギーが関係するのは等温の場合だけです。 水や空気のような単成分(組成一定)の物質(系)では、温度の他に体積または圧力を固定すると状態が確定し、それ以降の変化は起こることができません。
そこで次のような例を考えて見てください。 ピストン付きの容器の中に 窒素(N2) : 水素(H2) を体積比 1 : 3 で閉じ込めて、 (適当な触媒のもとで)反応させたとします (アンモニア合成のハーバー・ボッシュ法というそうです)。
容器全体を一定温度の熱浴に漬ければ等温に保つことができますし、さらに体積(または圧力)を一定に保っても、状態変化(反応がどちらかへ進んで組成が変わる変化)が起こります。
私の言い分では、
- ピストンを固定して等温等積としたときは F が減少する方向へ変化が起こり、F ミニマムで平衡する。
- ピストンの上に重りでも載せて等温等圧としたときは G が減少する方向へ変化が起こり、G ミニマムで平衡する。
- ピストンに加わる外力が微妙に変化しながら等温で膨張するのであれば、dU + p dV - T dS ≤ 0 となる方向へ変化が生じる( p dV の項を全微分で表せないので、自由エネルギーのようなポテンシャルは定義できない)。
ということになります。
これで、考えてみてください。__Shoji Yamauchi(会話) 2016年3月10日 (木) 03:05 (UTC)
- (1)について、要点が読み取れないので箇条書きします。添え字が面倒なので体積変化に伴う仕事をW、それ以外をAで表すとして
- 圧縮を考えない理由は何か?A=0として、圧縮すれば 0<-W なので 0<ΔF<=-W となり得るのは明らかですよね。
- 仕事と圧力について言えることは、一定の外圧の下で W=p_ex ΔV、外圧が変動する場合は区分的に表して W=∑ p_ex ΔV、系が常に平衡にあるとみなせる場合は内圧が外圧と等しいので W=∫p dV ですね。
- 自由膨張に熱力学は適用可能です。そもそも自由膨張は起こるが、自由収縮が起こりえないことは、自発変化の方向を検討して導かれる結果です。
- 等温条件における自発的とは W=0, A=0 であり、等温等圧条件では A=0 であるというのが「条件によって“自発的”の意味するところが変わる」と書いた意図です。
- 羽根車の実験について、上の図では密閉容器で行われているように見えるが、ジュールが大気に開放された状態でやったのであれば勘違いですので、「ジュールが行った」という部分は取り下げます。ただし羽根車の実験そのものは、ほぼ断熱密閉されたリジッドな容器で行うことが可能ですから、「等積条件」は、「仕事としてのエネルギーの移動がないこと」とは別物であるという結論に変わりはありません。
- 羽根車を系の内部に含めることは可能ですが、系の内外を区切る境界における問題は残ります。シャフトのどこかで区切るのであれば、その断面の剪断力があります。シャフト全てを系の内部に含めるとしても錘につながるヒモとシャフトの接触圧があります。まあ錘まで含めて系の内部とするのであれば等圧系と考えられますが、系の外部からの機械的な仕事がないので条件設定として不適切ですね。
- 別に自由エネルギーと関連付けるために挙げた例ではありません。
- ハーバー・ボッシュ法の例の書き様を見ると、混ぜたら勝手に反応しますといったことを自発変化だと勘違いしているのかも知れないが、勝手に反応するようでは平衡にないから初期の自由エネルギーが定義されず、最終的にどこに落ち着くかは言えますが、自由エネルギーが減る方向だとかは言えませんよ。あと外圧がずっと変化し続けるなら平衡に達する筈がないですよね。外圧が最終的にどこかで落ち着くのであれば、その外圧でギブズエネルギーを極小にする点で平衡しますね。-124.110.184.77 2016年3月19日 (土) 08:23 (UTC)
返信3[編集]
意がうまく伝わっていない面があるようですので、前回の返信2に沿って補足します。
(1) 膨張仕事と体積変化の関係について
圧縮の場合も含めて説明したつもりでしたが、 dW = pex dV < p dV は圧縮・膨張共に成り立ちます。 圧縮の場合は dV < 0 で、また pex > p となりますので -dW = pex (-dV) > p (-dV) つまり dW = pex dV < p dV となります。
この問題の当初で述べたように、最も気になっている点は、 自発変化の方向と平衡条件に関して、
- 等温条件下では F で決まるが
- 等温等圧条件下では G で決まる。
という説明です。 等温等圧条件というのは等温条件に含まれますから、 「等温等圧条件では、Fで決まるし、かつGで決まる」 と言っていることになります。 F と G が等しくならない限り、これは自己矛盾ですので、 ここに至る推論のどこかが間違っています。
自発変化の意味については、具体例をもとに後の(4)で説明する方がよいと思います。
(2) 羽根車の実験について。
議論がかみ合わない原因として、液体や固体で、貴下が圧力による体積変化を無視されているのではないかと危惧しています。 液体や固体でも、気体と同じように、体積は圧力と温度の関数 V(p,T) です。 熱力学の教科書などには水の状態曲面 V(p,T) の図が載っていると思います。 UとHの差異、FとGの差異を問題にするのであれば、圧力による体積変化は無視できません。 水を等積で加熱する(またはエネルギーを加える)こともできないわけではありませんが、 1 atm で 20℃の水 (比体積 0.00100168 m3/kg) を等積で21℃まで温度を上げると、圧力が 5.5 atm にもなります(30℃まで上げると、58.4 atm になります)。 熱膨張も全く無い圧力容器が必要です。
どこまでを系に含めるかという問題で、攪拌軸の切断面までを含めるのが簡単でしょう。 切断面に働くせん断力は膨張仕事には無関係ですし、 回転を行うことにより明確な非膨張仕事の出入りがあるだけです。 また、重りまで系に含めるのであれば、 重りの重力エネルギーは系の内部エネルギーに追加して扱えば、これも可能でしょう。
(4) 成分可変の系(自由度3)
温度と体積(または圧力)を一定に保って、なおかつ状態変化を可能とするには、成分可変とせざるを得ません。 右図のような装置を想像してください。

この場合の平衡には、力学的平衡(圧力)、熱平衡(温度)および化学平衡の3者 (まとめて熱力学的平衡)が必要です。 圧力は流体中を音速で伝わりますので、力学的平衡は短時間に到達できるでしょう。 それに比べて熱平衡は、熱移動が比較的緩慢であるため、より長い時間を要するでしょう。 化学平衡は複雑でしょうが、触媒がなければこの場合も反応が進行しませんので、 触媒の種類や量等を適当に選ぶことにより、熱移動に比べて十分遅くすることも可能でしょう。 このような仮定が実際に実現できるかどうか分かりませんが、思考実験としては可能です。
ピストンにある力が作用したまま静止し、系が熱力学的に平衡となっている状態を初期状態としましょう。 その後、下記のいずれかの操作により、この平衡を乱した後の状態変化を考えます。
- ピストンの位置を下方へずらして、固定するとします。上で仮定したように圧力はすぐに上昇し、同時に温度も多少上昇するが、容器周りの熱浴へ熱が移動し、間もなく元の温度 T に戻るでしょう。このときは系は力学的・熱的に平衡となっています。反応はゆっくり進行すると仮定しているので、圧力が上がった分徐々に NH3 が増えて圧力が少し緩和し、ある NH3 濃度である圧力の状態で、平衡に達するでしょう。このときは、貴下も同意すると思いますが F が減少する方向へ変化し、F が極小となる状態で最終的な平衡になります。
- ピストンの位置をずらす代わりに、ピストンを押さえていた重りを急に重くするとします。この場合も、系の圧力は急に高くなり、温度は一時的に少し上がるだろうが間もなく元の温度 T に戻り、引き続いて反応がゆっくり進行して NH3 が増加しながら、ピストンが少しずつ下がってくるでしょう。この場合の変化の方向は G が減少する方向であり、G が極小となる状態で反応が停止し、ピストンも動かなくなることになります。
- ピストンを固定したり重りで押さえる代わりに、適当なバネを介してピストンを支えていると考えてください。初期状態ではバネに少し圧縮力が作用した状態で静止しています。固定しているバネの上端を急に下方へ移動した後の変化を考えます。この場合も、圧力は直ぐに上昇し、その分バネは当初よりも縮み、温度は少し上がるがやがて元の温度に戻りながら、圧力が少し戻ってバネの縮みも少し緩和されて、系は力学的・熱的に平衡となります。その後は、徐々に反応が進行しますが、この場合はピストンも動くし、圧力も変化します。系の変化の方向は、私の言い分では、dU + p dV - T dS ≤ 0 となる方向です。系の圧力(=バネの力)と体積(ピストンの変位)との関係を p = p(V) と表して、J = ∫(dU + p dV - T dS) = U + ∫p(V) dV - TS で表される関数を定義すれば、変化の方向は J が減少する方向であり、J が極小となる状態で平衡することになります。J は一般には F や G に一致しませんが、等積条件では F に一致し、等圧条件では G に一致します。
貴下の言われている自発的の意味はよく分かりませんが、上の最初の二つの例は、当初のピストンや重りの操作は除外して、その後は自発的な変化と考えて異論は無いでしょう。 私は、3番目の例も自発的であると考えています。 バネの代わりに油圧装置でも取り付けて、ピストンの変位を検出して油圧を調整するような制御装置を組み込めば、任意の p(V) 関係を作り出すこともできます。 この場合でも、系の状態が決まればピストンに作用する力は決まりますので自発的です。 熱力学でいう自発的(spontaneous)とは、系の状態とは無関係な外的な要因の影響を受けない、という意味に理解すればよいのではないでしょうか。 仕事の出入りや混ぜるかどうかは、直接は関係ないのではないでしょうか。
以上、前回の返信を補足します。__Shoji Yamauchi(会話) 2016年3月21日 (月) 09:23 (UTC)
- 最も気になっておられる点について
- 等温条件の下での自発的な状態の遷移では、ヘルムホルツエネルギーが減る。
- 等温等圧条件の下での自発的な状態の遷移では、ギブズエネルギーが減る。
- 等温条件とみなしたときに、一定の圧力の下で膨張仕事を伴う遷移は外的作用を受けており、自発的ではないから下は上に含まれません。極小化される自由エネルギーが異なることは別に矛盾ではありません。
- バネ、あるいは何らかの装置を用いて外圧が制御される場合についてですが、外圧を与える装置のポテンシャル Φ(V) が存在するということです。この装置と流体の他には何もないとしておきます。装置が系の外部であると考える。流体が外部(装置)に仕事を行うと、それだけポテンシャルが増えるので W=ΔΦ です。エネルギー保存則は Q=ΔU+ΔΦ となり、等温条件から導かれる Q<=TexΔS を使えば ΔF<=-ΔΦ が得られます。この場合は 0<ΔF<=-ΔΦ となりうるので、流体のヘルムホルツエネルギーが減るとは限りません。これは外的な作用を受けながらの遷移で、自発的ではないからです。
- 装置を含めて系の内部であるとみなせば、流体の内部エネルギー U と装置のポテンシャル Φ を合わせた E=U+Φ が系全体の内部エネルギーになります。装置が純粋に機械的で、熱的な影響に左右されないとすれば、装置のエントロピーはゼロ(もしくは定数)です。系全体のヘルムホルツエネルギーは J=E-TS=F+Φ になり、等温条件の下で ΔJ<=0 が得られます。装置を内部に含めると(装置と流体の他に何もないので)外的な作用がなく、系全体のヘルムホルツエネルギーは常に減ります。
- ピストン-シリンダ系でピストンに錘を載せる場合であれば、錘の重量を w、高さを h とすれば、Φ=wh です。シリンダの断面積を σ として、錘の高さがそのままシリンダの長さになるようにゼロ点を設定しておけば、シリンダ内の体積は V=σh になり、Φ=(w/σ)V=pexV となります。錘と流体を合わせた系全体のヘルムホルツエネルギーは J=F+pexV になります。平衡にあるとき、流体の内圧が外圧に等しいので、J は流体のギブズエネルギーと等しくなります。
- 内圧と外圧の関係について言えることは「平衡にあるとき、内圧が外圧に等しい」ということの他にはありません。圧縮では内圧が外圧より小さいといった大小関係が主張されることもありますが、これは全くの間違いです。圧力の不均衡とは力の不均衡であり、力が決めるのは加速度である。速度(変位)の方向は決まらない。更に言えば、平衡にないとき、内圧が定まるとは限りません。
- 羽根車の実験について、何が言いたいのか判らない。リジッドな容器が現実には存在しないとの主張ですか?-124.110.184.77 2016年4月23日 (土) 03:56 (UTC)
返信4[編集]
最小限のコメントをします。
1. 自発的変化(および平衡)の意味の解釈(定義)に違いがあるようですね。
私は「系の状態とは無関係な外的な要因の影響を受けない」とし、p(V) 等で定まるある種の仕事の出入りを認めるのに対して、 貴下は「外的な要因の影響を受けない」としており、仕事の出入りを認めない点に相違の根源があるようです。
どちらの定義を採用しても、一貫した説明はできるでしょうから、 (1) 現状の熱力学がいずれの定義に基づいているか、 (2) 定義が日用的な意味とかけ離れていないか、 (3) いずれの定義が応用に便利であるか、 等により判断すればよいでしょう。
2. 一定荷重やバネ力による外圧を受ける系の状態変化について、 系だけを取り上げれば「自発的」でないが、 系を取り巻く外界(重りや大気)を含めると「自発的」となる との説明は不自然であり、用語の定義に無理があるのではないですか。
また、基準 F を適用する拡大系が受ける外圧はどうしますか。 W=0 とするには真空でない限り dV=0 とせざるを得ないのではないですか。 外界が真空では平衡になれません。
3. 上記 (1) に関して、「自発性」の定義を正面から取り上げている 資料は、今のところ見当たりません。
F を用いた自発変化、平衡条件に等温・等積と明記している教科書は、 以前記載の W.J.Moore、P.A.Atkins の他に、 M.W. Zemansky, ”Heat and Thermodynamics (5'ed.)、 ランダウ・リフシッツ,"統計物理学(2版)"、 原島鮮,"熱力学・統計力学(改訂版)"、 谷下市松,"工学基礎熱力学(1971)" 等が、手元にあります。
また、Wiki のThermodynamic_free_energy、Spontaneous_process、 熱力学ポテンシャル、熱力学的平衡、 エクセルギー 等もご参照下さい(最後の2項は小生の加筆です)。 これらとの整合性も考慮すべきでしょう。
調べて見てください。 __Shoji Yamauchi(会話) 2016年4月24日 (日) 10:03 (UTC)

- まず自由膨張について、これもジュールのやった実験だけど、二つの容器を仕切りを介して繋げて、片方が真空の状態から、仕切りを開放するという方法で実現可能ですね。センター試験とかでもありそうな設定だと思いますけど。
- どこまでを内部と考えるかによってモノの見え方が変わるというのは色々なところで起こることです。統計力学のカノニカルアンサンブルを導入において良くある設定として、充分な大きさの系(熱浴)と熱的に接触する系に着目しますが、着目する系だけで考えれば等温系ですが、着目する系と熱浴を併せた系では断熱系としてミクロカノニカルアンサンブルを適用します。力学の簡単な問題でも、大地に衝突して跳ね返る物体はそれだけ見ても衝突の前後で運動量が保存しませんが、しばしば言われることとして、物体と地球の二体の系として考えれば運動量が保存するだとか(実際は地球の運動量は太陽や月からの影響が無視できないので、地球だけ考えても保存しないですが)。内外の設定によってモノの見え方が変わるのは良くあることです。
- 履歴効果が無視できるなら誘電分極と外部電場や磁化と外部磁場には一定の相関関係があるけど、系の状態(分極や磁化)と関係付けられる外的な要因(外部電場や外部磁場)によるエネルギーの流入があっても自発的ってことになると思うけど。
- 書籍をどんなに挙げても、それは書籍に書いてあるというだけで、正しさの証明にはならない。間違いの再生産とかよくある話です。とはいえ Wikipedia は出典至上主義ですから挙げるとすれば田崎の本ですかね。-124.110.184.77 2016年4月29日 (金) 04:28 (UTC)

